表面增强拉曼光谱在食源性致病菌检测中的应用研究进展
王哲,陈芳,董丽,胡小松
(中国农业大学食品科学与营养工程学院,北京 100083)
食品中广泛存在着影响公共卫生的致病菌,如大肠杆菌、沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特菌和志贺氏菌[1]。2015年世界卫生组织首个全球食源性疾病估算报告显示,每年大约10人中会有1人因食源性致病菌而患病,并约有42万人因患病而死亡[2]。因此,检测致病菌对确保人体健康和安全至关重要。目前,食品中致病菌常用的检测方法包括传统的平板计数法、聚合酶链反应(polymerase chain reaction,PCR)[3]、环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)[4]、酶联免疫吸附法(enzyme-linked immuno sorbent assay,ELISA)[5]和免疫磁珠分离技术(immunomagnetic separation,IMS)[6]等。平板计数法耗时耗成本[7],PCR和LAMP的样品制备过程复杂且需要专业人员。ELISA虽然快速便捷,但是其结果往往呈现假阳性。尽管IMS具有较高的检测灵敏度和较广的检测范围,但是其价格昂贵,并且对抗原靶标的特异性要求较高[8]。因此在食品致病菌的检测中,迫切地需要一种省时省力、灵敏度高的方法。
目前,结合拉曼散射和纳米技术的表面增强拉曼光谱(surface enhanced Raman spectroscopy,SERS)是一种吸引力高和应用前景广阔的细菌检测技术[9]。Moskovits[10]发现太阳光被散射后,散射光的频率会发生变化,这种现象被命名为拉曼散射。散射光频率的变化取决于不同种类原子团的独一性振动,这使得拉曼散射的光谱具有“指纹”特性。自然状态下的拉曼散射非常弱,使拉曼光谱的实际应用受到限制。随着激光器的发展,自然状态下拉曼信号弱的问题得到改善[11]。Katan等[12]发现吸附在银电极上的吡啶的拉曼光谱中存在显著增强的效应。Albrecht等[13]发现表面效应将吡啶分子的拉曼信号放大了约105倍。至今,针对SERS增强机理和基底制备的研究以及拉曼设备的研发已经有了很大的进步,这使SERS技术可以广泛应用于化学物质、微生物及其代谢物等方面的研究。本文在简要总结SERS的增强机制和基底类别的基础上,重点概述SERS技术在食源性致病菌检测中的应用,为今后SERS技术的发展和应用提供参考。
1 SERS的增强机理
目前,学术界关于SERS的增强机理中被广泛接受的是电磁增强(electromagnetic enhancement,EM)和化学增强(chemical enhancement,CM)[14-15]。电磁增强是当光线入射到粗糙的金属表面时造成局部表面等离子体共振,进而引起拉曼信号的放大[16]。化学增强是由于SERS金属基底与吸附分子之间存在着特殊的化学相互作用,在入射光的激发下,基底和吸附分子之间产生电荷转移,如果入射光子和转移电子的能量差等于金属基底与吸附分子之间的能量差,会引发共振,最终增强拉曼信号[17]。大多数人认为在增强体系中两种机理起协同作用,但电磁增强处于主导地位[18]。在激光的作用下,高强度的局域电场在贵金属纳米颗粒的间隙形成,称为“热点”[19]。在致病菌检测中,金属纳米材料通过静电吸附或适配体特异性识别结合在致病菌的表面,纳米材料之间形成的“热点”明显放大了致病细菌或拉曼标签的分子信号,从而实现对致病菌的直接或间接检测。
2 SERS的基底材质
目前,SERS基底按材料组成的复杂程度一般分为两类:单金属基底和纳米复合基底[20]。其中纳米复合基底的检测灵敏度相对较高,但制备步骤繁琐;单金属基底制备简单,但灵敏度略显不足。
2.1 单金属基底
通常,用于SERS检测的金属基底主要是金(Au)、银(Ag)、铜(Cu)等[21-23]。除材料因素外,金属纳米颗粒的SERS增强效应还与纳米颗粒的大小、形状和聚集程度相关[24]。Frens[25]研究柠檬酸盐还原法制备金纳米颗粒(gold nanoparticles,Au NPs),为后来 SERS 金属基底的制备提供参考。Luo等[26]分别制备直径为64 nm和102 nm的Au NPs用以对苹果中广泛使用的亚胺硫磷和噻苯达唑的快速分析。其中亚胺硫磷的检测限为0.5 μg/g,噻苯达唑的检测限为 0.1 μg/g,检测范围分别为 0.5 μg/g~10.0 μg/g 和 0.1 μg/g~5.0 μg/g,线性相关度达到了0.967和0.977,回收率超过90%,在食品检测中具有广泛的应用潜力。陶进江等[27]以Au NPs为增强基底、硫酸镁为活化剂,并以819cm-1处特征峰作为己烯雌酚(dieth-ylstilbestrol,DES)的拉曼特征峰,测定鸭肉中DES的含量,检测限低至0.5 mg/L,平均回收率为83%~133%,可实际应用于鸭肉中DES含量的检测。相较于AuNPs,AgNPs具有更强大的SERS增强能力,但AuNPs生物相容性更高、稳定性更高,不容易被氧化[28]。
2.2 纳米复合基底
近年来,纳米复合基底因其更强的信号增强作用和更好的生物兼容性逐渐成为主流基底,主要包括双金属和金属-非金属两种形式[20]。
2.2.1 双金属基底
双金属基底结合了Au、Ag纳米粒子的特性,在具有强大的SERS增强能力的同时具有高度的稳定性。李梦华[29]先以柠檬酸钠还原法制备Au NPs金种子,再通过抗坏血酸还原AgNO3得到金核银壳的纳米粒子(Au@Ag NPs),用以检测面粉中的偶氮甲酰胺(azodicarbonamide,ADA)。其原理是 ADA 依靠-NH2与Au@Ag NPs的强吸附作用结合在复合基底的表面。使用该方法检测限可达到0.58 mg/kg,远低于GB 2760—2014《食品安全国家标准食品添加剂使用标准》的规定要求(≤45mg/kg),且操作简单快速,前处理时间不到20min。
2.2.2 金属/半导体纳米复合基底
由于自身具有较高的比表面积,目前半导体纳米材料已经作为一种SERS基底引起了广泛的关注[20]。常见的具有表面增强拉曼效果的半导体材料有TiO2[30]和ZnO[31]。李耕等[32]通过水热反应,用NaOH溶液成功制备原位生长的TiO2纳米线,并在其表面均匀镀银,得到Ag/TiO2复合基底。通过对3种有机污染物孔雀石绿(malachite green,MG)、罗丹明B和福美双的验证,发现该基底具有良好的拉曼信号增强能力。刘肖等[33]结合ZnO的光催化性能、高比表面积以及Ag的拉曼信号增强作用制备了ZnO/Ag复合薄膜,实现了对低浓度罗丹明B(10-9mol/L)的有效检测。
2.2.3 金属-二维材料复合基底
二维材料具有一种特殊的二维平面,该平面可以限制载流子迁移和热量扩散,因此二维材料具有其他材料所没有的独特性质。目前常见的二维材料有石墨烯和二硫化钼[34]。张朋月等[35]以硅片作为衬底,在硅片SiO2镀层的基础上,再喷射Cu、Ag两层金属膜,其中Cu位于Ag的上层,之后利用化学气相沉积法(chemical vapor deposition,CVD)在Cu基底表面原位生长出石墨烯。在以罗丹明6G(rhodamine 6G,R6G)为探针分子时,增强因子能够达到107。此外,石墨烯还可以保护金属不被氧化,提高了基底的均匀程度和稳定性。
2.2.4 金属-聚合物复合基底
研究显示,由金属纳米颗粒和聚合物组成的混合表面可能有助于产生更重要的细菌SERS信号[36]。吴焕乐等[37]通过葡萄糖还原AgNO3制备银纳米颗粒,并使其沉积在聚二甲基硅氧烷(polydimethylsiloxane,PDMS)薄片的表面,生成PDMS-Ag复合基底。该方法对MG的检测限低至0.1 mol/L,当以鱼肉的MG为检测对象时,孔雀石绿加标回收率为96.4%~128.4%,可以应用于鱼肉中MG的灵敏检测。Cao等[38]制备了覆盖Au NPs的大面积多孔聚合物薄层,用作细菌鉴定中的灵敏SERS基底。该基底在可重复利用的基础上,实现了对大肠杆菌的有效感知和捕获。
3 SERS在食源性致病菌检测中的应用
目前应用于微生物检测的SERS技术一般分为两种:无标签SERS检测和有标签SERS检测,即直接检测和间接检测。在直接检测中,纳米基底与微生物通过静电引力相互吸附,可以直接获得目标分子的SERS光谱。间接检测的拉曼标签则由纳米基底和拉曼信号分子组成,通过适配体、抗体或噬菌体等具有高度特异性地捕获元素来捕捉目标细菌,并将其和拉曼标签相连接,以拉曼信号分子的特征峰来间接定量微生物浓度。SERS识别细菌常见方法的优缺点见表1,用于SERS检测细菌的拉曼信号分子见表2。

表1 SERS识别细菌常见方法的优缺点Table 1 Advantages and disadvantages of common methods of SERS to identify bacteria

表2 用于SERS检测细菌的拉曼信号分子Table 2 Raman signal molecules used in SERS to detect bacteria
3.1 金黄色葡萄球菌
金黄色葡萄球菌是一种兼性厌氧革兰氏阳性球菌,拥有较强的环境适应性和传播性[48-50],广泛存在于乳及乳制品和肉及肉制品中[51]。其产生的肠毒素可导致腹泻、呕吐等急性毒性症状[52],研究表明,皮炎、菌血症和感染性心内膜炎等疾病均与金黄色葡萄球菌有关[53],在严重情况下,它还会导致感染者死亡[54]。
Liu等[41]以生物兼容性高的金纳米棒为拉曼探针,通过羧基化的磁性捕捉探针来富集金黄色葡萄球菌。首先利用Fe-MIL-88纳米酶的表面吸附性质,通过加入适配体达到对金黄色葡萄球菌的特异性识别;同时利用Fe-MIL-88纳米酶的催化能力,将无色孔雀石绿(leucomalachite green,LMG)催化为有强SERS信号(1 168 cm-1处有特征峰),且在620 nm处有紫外可见光(ultraviolet-visible,UV-Vis)吸光度的绿色孔雀石绿(MG);最后应用SERS光谱学和分光光度计,间接检测了10 CFU/mL~1×106CFU/mL范围内的金黄色葡萄球菌。该方法所使用的捕捉探针为羧基化磁性捕捉探针,相比于普通磁性捕捉探针,有着富集效果稳定和合成方法稳定的优点。而且该方法所用的人工制备的Fe-MIL-88纳米酶稳定、廉价、易于合成。此外,该方法检测到的金黄色葡萄球菌含量几乎与传统的生物平板计数方法相同,可信度高,且由于适配体与金黄色葡萄球菌之间的高亲和力使得该方法对金黄色葡萄球菌具有良好的特异性。
Zhu等[44]基于PDMS薄膜,通过两步组装与Au NPs共轭形成Au NPs-PDMS。首先使用食人鱼溶液和3-氨丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,APTES)对PDMS薄膜表面进行化学修饰,通过静电吸附作用制备Au NPs-PDMS薄膜。然后,硫醇端适配体通过金硫键固定在Au NPs-PDMS膜上,形成捕获基质。同时采用4-MBA修饰金芯银壳纳米管(gold-silrer core-shell nanoflowers,Au@Ag NFs),将功能化的Au@Ag NFs@4-MBA作为SERS信号探针来表达金黄色葡萄球菌的拉曼信号,4-MBA在1 085 cm-1处有拉曼特征峰产生,可通过测量4-MBA的SERS强度来量化金黄色葡萄球菌的浓度。在目标底物存在的情况下,信号分子探针和捕获基质与目标底物特异性结合,从而形成了“捕获基底-目标底物-分子探针”的“三明治”结构。该方法具有良好的特异性,可特别应用于金黄色葡萄球菌的检测。在优化的试验条件下,检测范围为4.3×10 CFU/mL~4.3×107CFU/mL,检测限为13 CFU/mL,以鱼肉为检测样品时该方法的回收率为92.5%~110%。
Wang等[45]构建了一种基于M13噬菌体的表面增强型拉曼散射纳米探针,用于金黄色葡萄球菌的选择性检测和灭活。M13噬菌体的pⅢ蛋白可以和金黄色葡萄球菌特异性结合,同时,它的pVIII蛋白作为Au NPs原位生长的共轭配体,为Au NPs在M13噬菌体表面原位生长提供了条件。之后用拉曼活性分子DTNB标记Au NPs完成M13-SERS探针的构建。加入该探针后,M13噬菌体选择性地与金黄色葡萄球菌结合,使Au NPs锚定在金黄色葡萄球菌表面。由于单个菌体可以被多个M13-SERS探针标记,同时每个探针装配有多个Au NPs,因此拉曼信号可以被极大地放大。离心收集SERS探针标记的金黄色葡萄球菌,并通过检测标记在Au NPs上的DTNB在1 331 cm-1处的特征峰的强度来实现对金黄色葡萄球菌浓度的量化。该方法在水介质中的检测限为10 CFU/mL~1×106CFU/mL,回收率为103.3%~110.0%,具有较高的实际应用性。此外,该方法检测时间较短,所用M13噬菌体对人体无害并可廉价纯化[55-56],同时对金黄色葡萄球菌有良好的选择性和灭活能力。
3.2 大肠杆菌O157:H7
大肠杆菌O157:H7属于肠杆菌科埃希氏菌属,革兰氏染色呈阴性,是主要的食源性病原体之一[57]。它产生的志贺氏毒素可感染水、牛奶、水果和蔬菜[58-59],引起腹泻、溶血性尿毒症等不良症状[60],从而造成严重的食品安全问题[61]。
Shi等[62]合成了一种分散性好、稳定性高、SERS活性优异的新型金壳硅芯纳米球(SiO2/Au NPs),并作为高性能大肠杆菌检测标签引入侧流免疫层析(lateral flow immunochromatography assay,LFIA)系统。首先,聚乙烯亚胺(polyethyleneimine,PEI)在 SiO2的表面自组装,使SiO2的表面布满大量的正电荷,通过静电吸附结合金纳米“种子”,同时,PEI暴露出氨基来结合DTNB,从而合成SiO2/seed/DTNB NPs。随后加入聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)和 HAuCl4促进金纳米“种子”的生长,形成SiO2/DTNB/Au NPs。最后用DTNB乙醇溶液修饰SiO2/DTNB/Au NPs得到双DTNB 修饰的 SiO2/Au NPs(SiO2/DTNB/Au/DTNB NPs),位于外层的DTNB-COOH与大肠杆菌O157:H7抗体的酰胺基结合形成SERS高性能标签。在磷酸缓冲盐溶液中,基于SiO2/Au NPs的SERS-LFIA带的检测限为50 CFU/mL,以自来水、牛奶、生菜提取物和牛肉为样品时,检测限为100CFU/mL。当细菌浓度在50 CFU/mL~1×107CFU/mL时,该方法与细菌浓度呈良好的正线性相关。试验时间短、操作方便、重现性高、成本低等优点也赋予了该方法快速检测食品中致病菌的良好潜力。
You等[63]通过在壳聚糖涂层淀粉磁珠(chitosancoated starch magnetic beads,CS@SMBs)表面原位合成金纳米颗粒(Au NPs)来制备金纳米颗粒涂层淀粉磁珠(Au NPs@SMBs)。作为固定特异性抗体的底物,Au NPs@SMBs表面密集的金纳米粒子为增强电磁场提供了有效的“热点”,从而放大目标细菌存在时产生的SERS信号。之后使用4×金结合肽标记链球菌蛋白G(4×gold-binding peptide-tagged streptococcal protein G,4GS)连接SERS基底和目标细菌,而且4GS还可以作为一种有效的拉曼报告分子,在SERS测量过程中表现出强大而独特的拉曼信号。当浓度范围为1 CFU/mL~105CFU/mL时,该方法具有良好线性相关性,检测限低至1 CFU/mL。
3.3 鼠伤寒沙门氏菌
鼠伤寒沙门氏菌是一种肠杆菌科革兰氏阴性细菌[64],在肉制品、乳制品以及蛋中均有检出,可造成胆囊炎等多种疾病[65],是对人类最危险的食源性病原体之一[66]。
Li等[42]提出了一种有效的双信号扩增方法,将杂交链式反应(hybridization chain reaction,HCR)与SERS相结合,双信号级联放大提高了对鼠伤寒沙门氏菌的检测灵敏度。首先鼠伤寒沙门氏菌被免疫磁珠(impeti cbead,IMB)捕获,而后IMB通过抗原抗体免疫反应打开适配体的发夹结构并暴露触发序列,随后发夹探针H1和H2交替打开茎环结构并相互补充,形成HCR产物双链脱氧核糖核苷酸(dsDNA)。之后加入过量的DAPI作为拉曼信号分子与HCR产物进行培养,再将整个系统与Ag NPs胶体混合。嵌入dsDNA的AT碱基之间的DAPI几乎没有拉曼信号,而由于静电相互作用没有与HCR产物反应的DAPI可以附着在Ag NPs基质之间,形成大量的“热点”,在1 610 cm-1处表现出强烈的SERS信号。该方法中SERS信号与细菌浓度呈负相关,用于检测样品鼠沙门氏菌的数量,检测限低至6 CFU/mL,以牛奶为样品时回收率在103.08%~104.88%之间。
Yang等[67]提出了一种基于三维DNA漫步器的SERS方法,用于鼠伤寒沙门氏菌的定量分析。在鼠伤寒沙门氏菌存在的情况下,鼠伤寒沙门氏菌识别适配体(Salmomella typhinurium-recognizing aptamer,cApt)从Apt@cApt中释放。随后游离的cApt基于互补碱基配对原则打开附着在金磁性纳米颗粒(gold magnetic nanoparticles,Au MNPs) 上的聚腺嘌呤 DNA(poly-ade nine-DNA,ployA-DNA)序列,形成 ployA-DNA@cApt。同时,SERS标签通过碱基互补与Au MNPs表面的酶片段结合形成Au MNPs@SERS,将该复合物进行磁性分离和SERS检测,当以R6G为信号分子时,发现位于1 514 cm-1处峰值的SERS强度始终最强。随着细菌数量的增加,更多的cApt序列被取代,导致更多的ployA-DNA被打开。经过酶水解和DNA漫步器循环后,可以与SERS标签结合的酶片段的数量增加,从而放大SERS信号。由于信号放大,该方法检测限低至4 CFU/mL。此外,这个SERS检测方法具有快速、低成本、灵敏的优点,回收率和相对标准偏差(relative standard deviation,RSD)的变化范围分别为96.04%~112.87%和5.69%~11.46%。
Prakash等[68]制备了一种带正电荷的无标签的Ag/Au双金属纳米颗粒(Ag/Au bimetallic nanoparticles,Ag/Au bmNPs)基底,可用来直接捕获并检测目标菌样的拉曼信号。相比于单金属纳米基底,多金属纳米基底增强了局部表面等离子体振动、催化性能和SERS“热点”的可用性,且操作简单、灵敏度高[69-73]。基于无标签的细菌的SERS特征主要来自细菌细胞壁和细胞内成分,因此可利用主成分分析(principal component analysis,PCA)和典型判别分析(canonical discriminant analysis,CDA)等多元分析来区分鼠伤寒沙门氏菌和其他细菌[74-75]。
3.4 单核细胞增生李斯特菌
单核细胞增生李斯特菌是最常见的肠病原体之一[76],存在于乳制品、肉制品和海产品等各类食品中[75,77],可引起肠胃炎、败血病、脑膜炎等多种疾病[78]。
Zhou等[79]提出了一种磁辅助SERS标签的免疫检测方法。首先利用PEI介导的种子生长方法,选择强磁响应性强和稳定性良好的Fe4作为超顺磁核来合成Fe4@Au MNPs,并将其用作磁捕获工具和SERS基底。将Fe4@Au MNPs在巯基十一烷酸(mercaptoundecanoic acid,MUA)乙醇溶液中超声处理使MUA分子覆盖在Au壳表面,之后加入氨基适配体共聚在Fe4@Au的MUA涂层,形成Fe4@Au适配体。SERS标签的制备需要先将DTNB分子修饰到Au表面,在其产生特征SERS信号的同时提供与葡萄球菌蛋白A(Staphylococcus proteins A,SPA)共轭的末端羧基,形成Au-SPA SERS标签。Au-SPA SERS标签不仅具有与Au-DTNB NPs相同的SERS能力(可以在1 331 cm-1处显示出强烈的拉曼峰值),还因SPA上的Fc区域实现与抗体的特异性结合。检测时首先将单核细胞增生李斯特菌和Fe4@Au-aptamer MNPs共同孵育,在细菌被捕获后,加入抗体再次孵育。之后加入Au-SPA SERS标签与抗体特异性结合形成Fe4@Au/细菌/SERS标签复合物,对其检测拉曼信号,当细菌浓度在10 CFU/mL~107CFU/mL之间时,SERS信号与细菌数量成正比。该方法制备的Fe4@Au-MNPs对单核细胞增生李斯特菌的捕获率为77.8%,检测限为10 CFU/mL。此外,该方法针对大肠杆菌和鼠伤寒沙门氏菌的检测限分别为10 CFU/mL和25 CFU/mL,Fe4@Au MNPs对大肠杆菌和鼠伤寒沙门氏菌的捕获率分别为86.9%和75.7%,可以实现对多种菌的同时检测。
Liu等[80]开发了一种基于SERS的LFIA与重组酶聚合酶扩增(recombinase polymerase amplification,RPA)相结合的技术,用于同时检测单核细胞增生李斯特菌和肠炎沙门氏菌。在该系统中,使用AuMBA@Ag NPs作为标签使2-巯基苯甲酸(thiosalicylic acid,MBA)信号大大增加,用共焦微拉曼光谱系统测量MBA在LFIA测试线上的SERS信号,在最佳条件下,单核细胞增生李斯特菌和肠炎沙门氏菌在1 077 cm-1处的拉曼信号与细菌浓度呈正比,检测限分别为19 CFU/mL和27 CFU/mL。该方法具有很高的特异性和适用性,可以快速、定量地检测食品样本中的细菌病原体。
3.5 志贺氏菌
志贺氏菌是一种肠杆菌科的革兰氏阴性棒状致病菌,可通过受污染的水和食品侵染人的结肠[81],引起腹泻和溶血性尿毒症综合症等肠道疾病[82]。目前,全球每年仍有超过16万例志贺氏菌死亡病例[83]。
Wu等[84]构建了一种基于适配体的传感器,通过SERS分析对志贺氏菌进行敏感和高度特异性检测。首先以 EuCl3·6H2O、1,10-菲罗啉以及 4-MBA 合成[Eu(phen)2(MBA)2]Cl,然后通过巯基结合导致Au NPs二聚化,形成Au NPs二聚体,并在“热点”处获得了极大的电磁场增强。之后适配体通过Au-s键结合修饰到AuNPs二聚体的表面。适配体功能化的Au NPs二聚体除了作为捕获探针外,由于其4-MBA成分,在1 086 cm-1和1 593 cm-1处有与4-MBA一致的两个拉曼特征峰,因此还被用作信号探针。随着志贺氏菌的引入,通过适配体使具有双重功能的Au NPs二聚体修饰在细菌上,在10 CFU/mL~106CFU/mL的浓度范围内,SERS强度反应显示出很强的正线性相关(R=0.996),检测限低至10 CFU/mL,当应用于实际样品中时,该方法的回收率为92.6%~103.8%。Au NPs二聚体制备简单、低成本可以为SERS的传感器的构建提供一种有效的途径。不同SERS基底检测食源性致病菌的优缺点见表3。
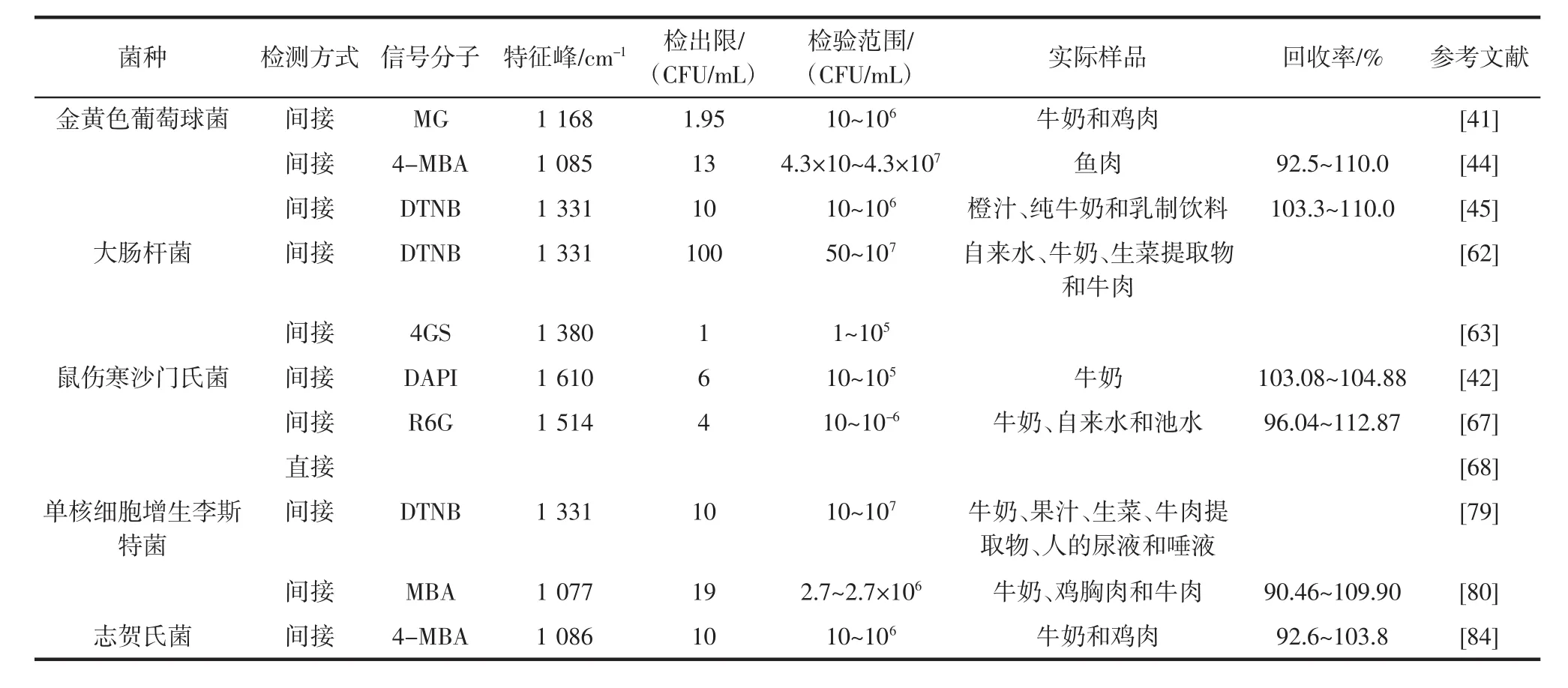
表3 不同SERS基底检测食源性致病菌的优缺点Table 3 The advantages and disadvantages of different SERS substrates for detecting food-borne pathogens
4 展望
SERS具有高灵敏度、快速、所需样品少、不受水干扰、特异性好以及无损性等特点,近年来已成为基于标签和无标签的食源性致病菌检测方法。但是仍有一些问题需要解决。1)目前所用的SERS基底多为贵金属和其他复合物材料,价格昂贵且重复利用率低,高昂的成本一定程度上限制了SERS技术的发展,因此需要开发出更多成本较低的基底材料,如半导体材料和磁性材料等。2)目前基于SERS的食品致病菌检测环境多为液体环境,且在复杂的真实环境中存在其他因素的干扰,因此需要探索开发在多种环境下可以实现捕获并检测致病菌的SERS活性基底,或是将SERS与其他技术相结合,以提高检测性能。3)目前纳米颗粒的制备技术仍无法保证纳米粒子的均一性,使得SERS基底的重现性较低且保存时间较短。4)虽然目前运用SERS检测的微生物的种类越来越多,但是仍没有标准谱图库来验证检测的准确性,因此,需要建立针对微生物的SERS标准。5)目前大多数拉曼仪器过于笨重,只适用于实验室的检测,很难实现针对食品实现现场检测。因此,功能多样、价格低廉、小巧灵活的拉曼设备的研发也是目前需要解决的问题之一。尽管目前仍有很多的困难和挑战,但是随着相关仪器技术和整个学科的不断发展,SERS在食品中致病菌的检测将拥有一个广阔的前景。

