百里香酚微胶囊的反溶剂法制备工艺
李晓宇,李瑞红,张悦,郭鹏,董爽
(山东理工大学 农业工程与食品科学学院,山东 淄博 255049)
百里香酚(5-甲基-2-异丙基酚,thymol)又称麝香草酚,是一类从百里香中分离得到的芳香族化合物。百里香酚具有杀菌抑菌,防腐,抗酸败等作用[1-2],已经被美国食品药品监督管理局(FDA)批准为食品添加剂。百里香酚添加到食品之中以后可以起到增香、除臭、防腐等方面的作用[3];其次,百里香酚的次生代谢产物是黄酮类化合物[4],可以通过清除DPPH等自由基以及一些超氧化物,减少脂质过氧化物的产生来达到抗氧化的目的,是一种天然的抗氧化剂[5-6];但是,百里香酚在水中的溶解度很低,限制其在食品水相中的应用[7],且易挥发,生物利用度比较低[8-9];因此,提出通过大分子物质将其进行包埋,提高其在水相体系中溶解度以及生物利用度。
玉米醇溶蛋白(zein)是玉米精深加工所产生的副产物中提取的一种醇溶蛋白,其疏水性氨基酸含量比较高[10],具有两亲性,并且有独特的自组装特性[11],玉米醇溶蛋白的这种性质适合于作为壁材对活性物质进行包埋。近些年对玉米醇溶蛋白独特性质的研究逐渐增多[12-14],研究表明,用其对活性物质进行包埋,一方面可以保持包埋物质的生物活性,另一方面可以提高其溶解性以及生物利用度[15-16]。
本研究主要是基于玉米醇溶蛋白的自组装功能,采用反溶剂的方法对百里香酚进行包埋。以包封率为指标选取芯壁比、混合溶液与去离子水混合溶液体积比、混合溶液向去离子水滴加速率三个因素进行单因素试验,在单因素的基础上进行三因素三水平响应面优化试验,确定最佳制备工艺,并对最佳条件制备的微胶囊进行表征。
1 实验部分
1.1 实验材料
玉米醇溶蛋白(纯度92.8%),江苏高邮日星药用辅料有限公司;百里香酚,上海麦克林生化科技有限公司;无水乙醇,天津市致远化学试剂有限公司。
1.2 仪器与设备
HL-2型恒流泵:上海沪西分析仪器厂有限公司;FD-1D型冷冻干燥机:北京博医康试验仪器有限公司;Mastersizer 2000激光粒度仪:英国马尔文仪器有限公司;Nicolet5700型傅里叶变换红外光谱仪:美国Thermo Electron公司;D8-02型X-射线衍射仪:德国Brucker AXS公司;Q2000型差示扫描量热仪:美国TA公司。
1.3 试验方法
1.3.1 玉米醇溶蛋白-百里香酚微胶囊的制备
根据Yang等[17]方法稍做修改,采用反溶剂法制备玉米醇溶蛋白-百里香酚微胶囊,将1 g玉米醇溶蛋白溶解于50 mL 80%无水乙醇,配成玉米醇溶蛋白溶液。称取不同质量的百里香酚加入到玉米醇溶蛋白溶液中,配制成不同芯壁比的混合溶液,磁力搅拌30 min,按照一定的流速缓慢注入去离子水中,并磁力搅拌30 min使其混合均匀。将制备的胶体溶液在40 ℃下真空旋蒸15 min,随后在3000 r/min下离心5 min得到上清液,即制得所需的复合粒子胶体溶液,胶体溶液进行冷冻干燥48 h,得到分散的玉米醇溶蛋白-百里香酚微胶囊颗粒(ZT)。
1.3.2 包封率的测定
将梯度浓度的百里香酚制成标准液,在最大吸收波长283 nm处测量其吸光度,以百里香酚浓度为横坐标,以吸光度为纵坐标绘制标准曲线。
称取10 mg的冻干复合颗粒于试管中,加入10 mL无水乙醇轻轻震荡1 min后静置30 min。取上清液在百里香酚最大波长283 nm处测量吸光度,根据标准曲线标曲计算百里香酚含量,记为W1。
称取10 mg的冻干复合颗粒于试管中,加入10 mL无水乙醇,在室温下超声30 min以充分提取百里香酚。将提取液在3 000 r/min下离心10 min,取上清液在百里香酚最大波长283 nm处测量吸光度,根据标准曲线计算百里香酚含量,记为W2。百里香酚复合颗粒的包封率按照如下公式计算[18]:
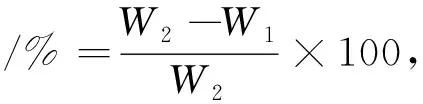
(1)
式中:W1为游离的百里香酚的含量,μg;W2为总的百里香酚的含量,μg。
1.4 单因素及响应面优化
以芯壁比(百里香酚:玉米醇溶蛋白=1∶5、1∶10、1∶15、1∶20、1∶25),溶剂反溶剂体积比(1∶2、1∶3、1∶4、1∶5、1∶6),溶剂反溶剂滴加速率(0.2、0.7、1.2、1.7、2.2 mL/min),包封率为指标进行单因素实验。在单因素试验的基础上以包封率(%)为优化指标,以芯壁比(X1)、溶剂反溶剂体积比(X2)、溶剂反溶剂混流速 (X3)为试验因素,进行三因素三水平的响应面优化试验,对ZT微胶囊粒子的制备条件进行优化,因素水平表见表1。
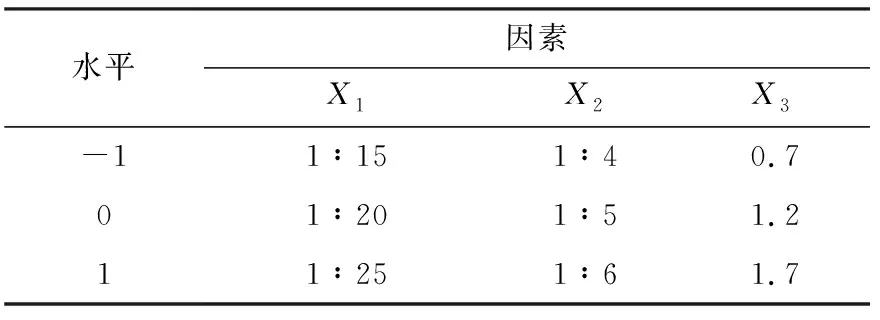
表1 响应面试验因素水平表Tab.1 Response surface test factor level table
1.5 理化特性及结构表征
1.5.1 粒径
使用激光粒度仪可以测定每份样品的粒径分布和粒径大小。使用1 000 mL烧杯加入600 mL去离子水,调节粒度仪转速为2 000 d/min,测定背景,背景测定完成后向烧杯中加入一定浓度的ZT胶体溶液,等遮光度达到80%以上开始测定。
1.5.2 热力学特性
称取5 mg冻干后的样品放入铝盘里,加盖后压紧,置于差示扫描量热仪中,以空白铝盒为对照。温度扫描范围20~200 ℃,扫描速率10 ℃/min。
1.5.3 傅里叶红外光谱
将干燥的微胶囊颗粒研磨后与KBr按照一定的比例混合,研磨均匀,经压片后对样品进行傅里叶红外光谱分析。扫描范围4 000~400 cm-1,分辨率4 cm-1,扫描次数32次。
1.5.4 X-射线衍射光谱
采用X-射线衍射仪对冻干的样品进行扫描,X-射线发射器电压为40 kV,电流为40 mA,采用Cu靶,扫描范围2θ为3°~70°,扫描速率为2°/min。得到的数据绘制XRD图谱。
1.5.5 ZT样品抗氧化性分析
DPPH溶液的配置:称取5 mg DPPH溶于95%的乙醇溶液中,超声使其溶解并定容到100 mL,避光冷藏。
样品溶液的配置:将ZT样品溶于95%的乙醇配成1mg/mL的溶液。
自由基清除率的测定:加入DPPH测试液2 mL于10mL具塞试管中,分别加入ZT样液0.5、1.0、1.5、2.0、2.5 mL,再加入95%的乙醇溶液,使具塞试管中溶液的总体积为6 mL,混合摇匀,避光反应30 min,然后测其在517 nm 处的吸光度A1,以不加样品液为空白组,其吸光度为A0。

(2)
式中:A0为空白样品的吸光度;A1为ZT样品溶液的吸光度。
1.6 数据统计与分析
所有实验重复3次,利用 Design-Expert 软件进行响应面试验的设计与分析,采用SPSS进行单因素方差分析,通过Duncan′s多重比较检验(P<0.05)进行显著性分析,所有数据均用平均值±标准偏差的形式表示,并绘制图表。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 芯壁比对包封率的影响
由1.2.2测定的百里香酚的标准曲线方程为:Y=0.005 5X+0.076 5,R2=0.998 9,n=6。在溶剂反溶剂体积比为1∶4,溶剂反溶剂滴加速率为1.2 mL/min,百里香酚与玉米醇溶蛋白的质量比为1∶5、1∶10、1∶15、1∶20、1∶25的条件下,玉米醇溶蛋白-百里香酚微胶囊的包封率如图1所示。
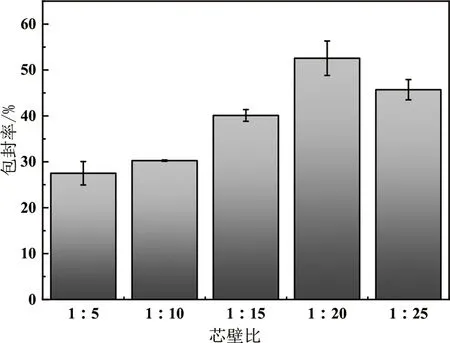
图1 芯壁比对包封率的影响Fig.1 Effect of core-wall ratio on encapsulation efficiency
由图1可知,随着芯壁比的减小,玉米醇溶蛋白对百里香酚的包封率逐渐增大,当芯壁比为1∶20时包封率达到最大为52.56%±3.75%,随着芯壁比的进一步减小,包封率开始逐渐下降。其原因是在芯壁比较大的制备条件下,百里香酚的质量过大,百里香酚与玉米醇溶蛋白的结合过饱和,大量的百里香酚游离,致使包封率不高。随着玉米醇溶蛋白比例的增加,百里香酚与玉米醇溶蛋白的结合位点增多,包封率随之上升。当到达最佳芯壁比后,芯壁比继续减少,就会由于芯材百里香酚含量不足,而致使包封率的降低,这与李晓辉等[19]的研究结果一致,因此选择芯壁比为1∶20。
2.1.2 溶剂反溶剂混合体积比对包封率的影响
在芯壁比1∶15,溶剂反溶剂滴加速率为1.2 mL/min,溶剂反溶剂混合体积比为1∶2、1∶3、1∶4、1∶5、1∶6的条件下,对包封率的影响如图2所示。

图2 溶剂反溶剂混合体积比对包封率的影响Fig.2 Effect of mixing volume ratio of solvent and anti-solvent on encapsulation efficiency
由图2可知随着溶剂反溶剂的混合体积比的减少,ZT微胶囊的包封率逐渐上升,在溶剂反溶剂体积比为1∶5时,包封率达到最大,这主要是由于反溶剂蒸馏水的体积较少时,混合溶液溶度过高,玉米醇溶蛋白分子之间会通过相互作用发生沉淀聚集而析出,壁材含量下降,导致包封率降低;而随着体积比的进一步减小,反溶剂体积过多,混合溶液滴加到反溶剂中被稀释,玉米醇溶蛋白和百里香酚的粒子碰撞减少,导致包封不足,包封率降低,综上溶剂反溶剂体积比应选择1∶5。
2.1.3 溶剂反溶剂滴加速率对包封率的影响
在芯壁比为1∶15,溶剂反溶剂体积比为1∶4,溶剂反溶剂混合流速为0.2、0.7、1.2、1.7、2.2 mL/min的条件下,玉米醇溶蛋白-百里香酚微胶囊包封率的变化如图3所示。

图3 溶剂反溶剂混合流速对包封率的影响Fig.3 Effect of mixed solvent flow rate on entrapment efficiency
由图3可知,随着溶剂反溶剂的滴加速率增加,ZT微胶囊的包封率逐渐提高,在流速为1.2 mL/min时达到最大为37.20%±3.39%,主要是由于滴加速率过慢,玉米醇溶蛋白粒子之间通过疏水相互作用相互吸引,聚集形成大颗粒以及絮凝物[20]。随着滴加速率的增加,粒子的流动速度增加,并且随着搅拌方向做有规律的离心运动,减少玉米醇溶蛋白粒子发生碰撞的机会,抑制了玉米醇溶蛋白聚集体的形成,从而使得包封率有所提高[21],因此溶剂反溶剂的滴加速率应为1.2 mL/min。
2.2 响应面实验结果与分析
根据单因素的实验结果进行响应面优化试验,设计方案及结果见表2。以芯壁比、溶剂反溶剂混合体积比、溶剂反溶剂滴加速率(mL/min)为响应变量,以包封率为响应值对表2进行方差分析、模型显著性分析以及数据结果见表3。

表2 响应面实验方案及结果Tab.2 Response surface experiment scheme and results
将响应面的实验结果用Design-Expert数理统计软件进行回归拟合,得到响应值Y和各个因子之间的二次多元回归方程模型为:Y=72.26+3.66X1-2.22X2+4.60X1X2-5.69X12-9.63X22-9.10X32,并对此模型进行方差分析,模型显著性分析,结果见表3。
由表3的方差分析可知,该模型显著性检验P<0.000 1,模型极显著,失拟项P>0.05不显著,表明该模型具有统计学意义。该模型的R2值为0.986 8,变异系数=3.71%,表示98.68%的数据符合拟合模型,该模型的拟合程度良好且误差较小。一次项X1,X2、交互项X1X2以及二次项X12,X22,X32对包封率的影响均为极显著(P<0.01)。此外,各因素对包封率影响的排序为X1(芯壁比)>X2(溶剂与反溶剂体积比)>X3(反溶剂流速)。
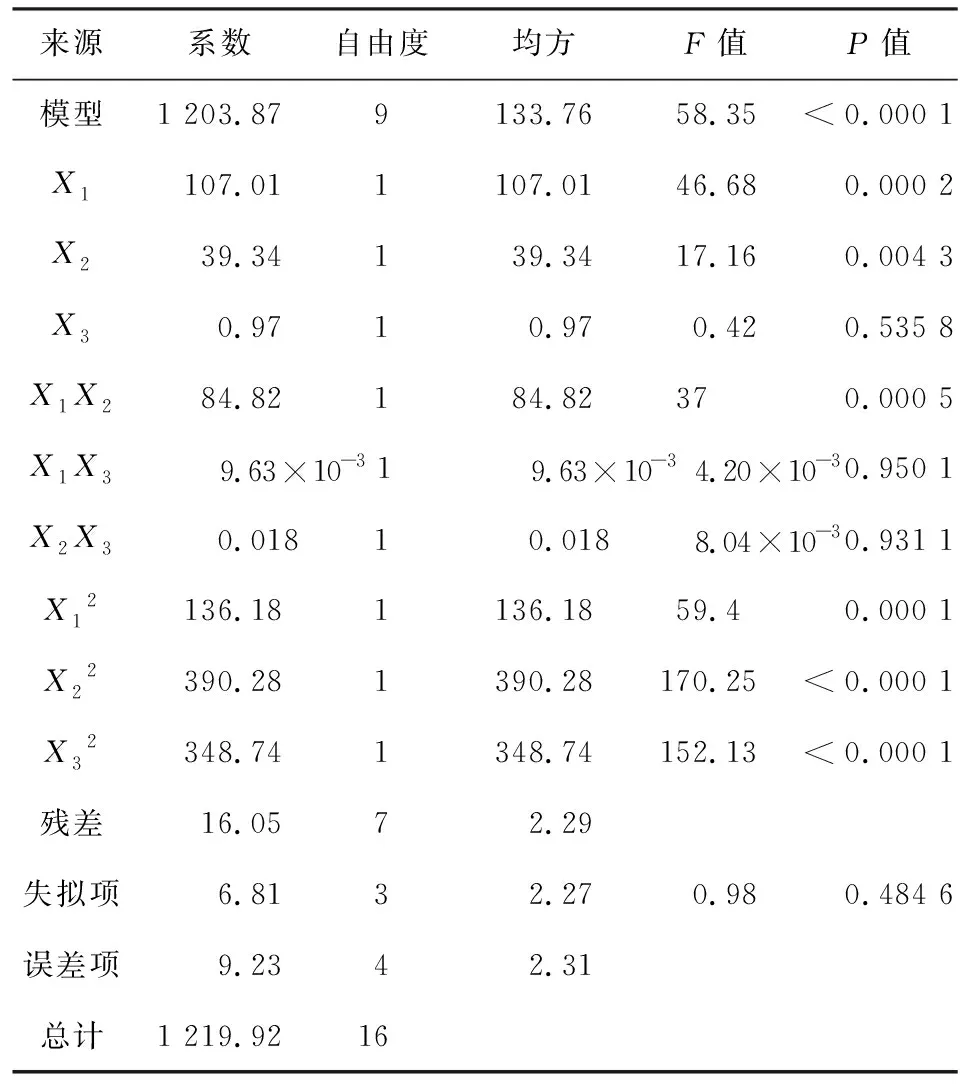
表3 回归模型方差分析表Tab.3 Variance analysis table of regression model
响应面优化实验模型得出的最优试验条件为芯壁比为1∶21.52,溶剂反溶剂混合体积比为1∶4.98,溶剂反溶剂滴加速率为1.18 mL/min。考虑到实际操作的可行性,将最优条件调整为芯壁比1∶21.5,溶剂反溶剂混合体积比1∶5,溶剂反溶剂滴加速率1.2 mL/min,进行验证试验,试验重复三次。在最优条件下包封率达到54.04%±2.27%,基本符合预测值,说明模型拟合程度良好,优化实验正确有效。
2.3 粒径分析
图4显示了玉米醇溶蛋白(a)以及最优条件下制备的ZT复合微粒(b)的粒径分布图。基本都是成双峰分布体积四次矩平均径D(4,3)是4.863 μm,表面积体积平均径D(3,2)为0.182 μm,ZT胶体颗粒的粒径分布呈三峰分布,D(4,3)是1.087 μm,D(3,2)为0.112 μm。与单一的玉米醇溶蛋白相比,ZT复合粒子的曲线呈现出更宽更低的形态,原因可能是百里香酚与玉米醇溶蛋白进行结合,导致粒子的粒径增大,但是复合颗粒不稳定,因此形成的峰较低
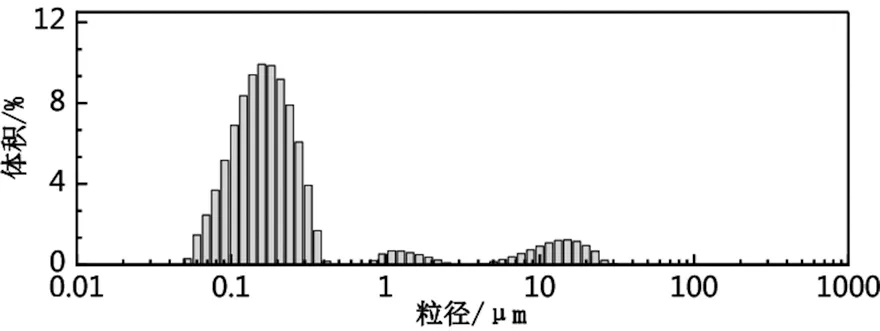
(a)玉米醇溶蛋白
2.4 DSC
通过DSC表征复合微胶囊的热力学性质,如图5所示,百里香酚在50.43 ℃出现一个尖锐的吸热峰,主要是由于百里香酚晶体熔化所形成的。在ZT复合微胶囊的图谱中并没有出现此吸热峰,表明在形成微胶囊的过程中百里香酚原有的晶体结构消失,以无定型的状态存在于微胶囊中,同时抑制了百里香酚在复合粒子中的结晶,也有可能是百里香酚颗粒基质与玉米醇溶蛋白粒子形成了无定型复合物[22];同时,ZT复合颗粒的吸热峰温度为84.08℃,焓值为117.4 J/g纯玉米醇溶蛋白的吸热峰温度为83.39℃,焓值为107.2 J/g略低于复合颗粒,说明复合微粒的热稳定性提高,这可能是由于百里香酚与玉米醇溶蛋白质之间形成新的作用力所导致的。
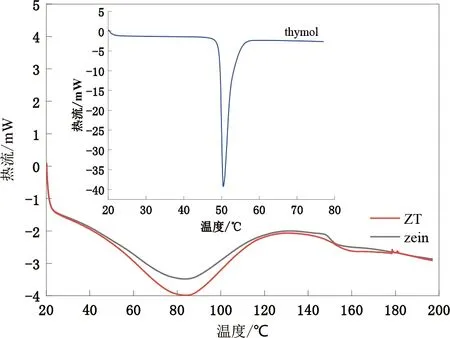
图5 差示扫描量热图Fig.5 Differential scanning calorimetry
2.5 FTIR
图6显示了在4 000~400 cm-1范围内玉米醇溶蛋白、百里香酚以及ZT复合微胶囊的红外光谱图。红外光谱的峰形、位移发生的微小变化都可以表明分子间相互作用的发生。从图中可以看出,在3 300 cm-1左右玉米醇溶蛋白以及ZT复合微胶囊都出现一个较强的吸收峰,根据之前的研究报道可知3 500~3 100 cm-1范围内的谱带归属于O-H的振动收缩[23]。玉米醇溶蛋白与百里香酚形成ZT复合颗粒以后,相较于纯的玉米醇溶蛋白,该特征峰谱带向低波数方向移动,主要是因为玉米醇溶蛋白中的酰胺基与百里香酚的羟基之间形成相互结合形成氢键,从而使该处的特征峰向低波数方向移动,可以说明百里香酚成功被玉米醇溶蛋白包埋,这与DSC的结果一致。
此外,玉米醇溶蛋白在酰胺Ⅰ带(1 750~1 600 cm-1)以及酰胺Ⅱ带(1 550~1 510 cm-1)也出现两个特征峰,酰胺Ⅰ带主要是由于C-O基团以及C-N的基团的伸缩振动形成的,酰胺Ⅱ带主要是由于N-H基团以及C-N基团的弯曲振动形成的[24- 25]。从图6中观察到加入百里香酚形成ZT复合颗粒以后峰值的强度都有不同程度上的降低,并且两个特征峰都向低波数方向移动,这些变化都表明玉米醇溶蛋白与百里香酚之间不仅有氢键作用,由于玉米醇溶蛋白含有较多的疏水性氨基酸,因此复合粒子中还有部分疏水作用以及静电相互作用的存在[26]。
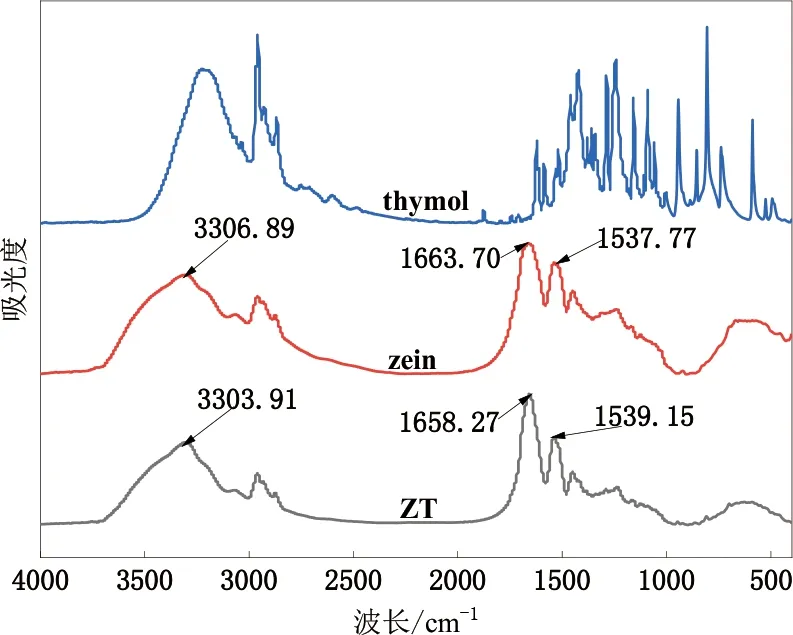
图6 傅里叶红外光谱图Fig.6 Fourier infrared spectra
2.6 XRD
X-射线衍射分析主要用来分析物质的结晶状态。百里香酚等活性物质被包埋的时候,其晶体状态变成无定型状态[27]。图7是百里香酚、玉米醇溶蛋白以及ZT复合颗粒的X-射线衍射图,由图中可以看出玉米醇溶蛋白在2θ=9°以及19°的时候出现两个较宽的衍射峰,而ZT复合颗粒的峰型与玉米醇溶蛋白相似,但是峰的强度较低,说明玉米醇溶蛋白以及ZT复合颗粒均为无定型结构[28]。百里香酚的XRD图谱中有很多尖锐的峰出现,表明百里香酚在自然的状态下是高度结晶的;但是,在ZT复合微胶囊的XRD图谱中这些尖锐的特征峰完全消失,表明百里香酚被包埋之后是以无定型的状态存在于包埋物中的,这与傅玉颖等[29]的研究结果一致。

图7 X-射线衍射图Fig.7 X-ray diffraction pattern
2.7 DPPH自由基清除率
DPPH自由基清除率是体外抗氧化能力的测定方法,自由基清除率越高则抗氧化能力越强[30]。图8显示的是最优条件下(芯壁比1∶21.52,溶剂反溶剂混合体积比1∶5,滴加速率1.2 mL/min)制备的样品对DPPH的清除率。结果表明:随着ZT含量的增加,自由基清除率逐步增加,在样品添加量为2.5 mg时清除率可达47.29%±0.71%。该结果也说明百里香酚被成功包埋并保持了原有的生物活性。
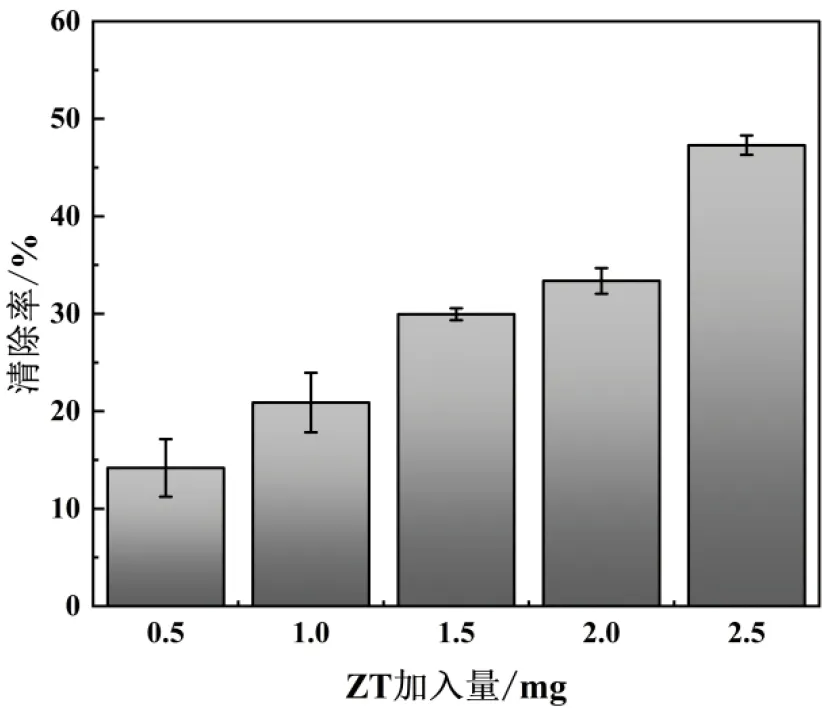
图8 DPPH自由基清除率Fig.8 DPPH free radical scavenging rate
3 结论
本文通过反溶剂法成功制备玉米醇溶蛋白-百里香酚复合微胶囊,并对其制备工艺进行优化,在最佳的工艺(芯壁比1∶21.5,溶剂反溶剂混合体积比1∶5,滴加速率1.2 mL/min)条件下制备的复合微胶囊,具有较高的包封率为54.04%±2.27%。粒径分布图显示复合微胶囊粒子大小更均匀。DSC、FTIR以及XRD则证实百里香酚被成功包埋,百里香酚是通过氢键、静电相互作用以及疏水作用嵌入到玉米醇溶蛋白之内的。DPPH自由基清除率结果表明该方法制备的复合粒子可以有效地保持芯材的生物活性;因此,将玉米醇溶蛋白作为活性物质的有效载体,可以对百里香酚等活性物质达到有效的包埋,提高百里香酚的稳定性以及生物利用率。

