穿心莲内酯恢复突变型p53野生型功能的作用及机制研究*
宋 斌 王嘉健 苏永南 王玉玲 杨 帆 张继虹*
(昆明理工大学医学院,昆明 650500)
p53蛋白是由393个氨基酸组成的转录因子,在缺氧、DNA损伤等压力刺激时受到激活,并通过调节p21(cyclin-dependent kinase inhibitor 1A)、BAX(B-cell lymphoma-2-associated X)、PUMA(BCL2 binding component 3)、PTEN(phosphatase and tensin homolog)、NOXA(PMA induced protein 1)等下游靶基因,引起细胞周期阻滞、使DNA损伤得以修复、导致细胞凋亡与衰老、抑制血管生成,从而抑制肿瘤发生与发展[1]。p53主要由N端转录激活区域、C端寡聚结合区域、DNA核心结合区域[2]3个功能区域组成。但在肿瘤中,p53基因的突变率较高,约有50%以上的肿瘤发生了p53基因的突变,其中,晚期前列腺癌和高级别浆液性卵巢癌患者TP53基因的突变频率分别高达75%和96%[3]。75%的TP53突变为错义突变,且这一突变频繁发生于DNA核心结合区域。p53蛋白核心区(core domain)由2个四股和五股反平行β片层形成一个三明治样的片层骨架结构、1个环-片-螺旋结构域(loop-sheet-helix motif、LSH)和2个大的环状结构(L2/L3)组成。2个大的环结构和β片层骨架结构形成DNA结合面,而在肿瘤中大多数p53热点突变的残基全都集中在此结合面上,从而失去与DNA的结合能力[4]。p53热点突变主要包括Arg175、Ser245、Arg248、Arg273、Arg249和Arg282。p53蛋白突变可分为两种类型:一类为DNA结合性突变(如R248Q、R273H),此类突变主要是影响p53蛋白与DNA的接触点,如第273位和第248位精氨酸发生突变后,盐桥和疏水作用减弱,并且对DNA的亲和力降低甚至丧失;另一类为构象型突变,此类突变可导致突变位点原位(如R249S、G245S)或蛋白质整体的构象扭曲(如R175H、R282W)突变,如R175H位点突变后,疏水作用消失,使得环状结构L2和L3不再作用,导致p53蛋白核心结构松散而失去功能[5]。p53蛋白主要以四聚体的形式存在,通常p53发生突变后会导致热力学和动力学稳定性下降,蛋白质结构不稳定,活性构象改变,失去转录激活能力,但其不会失活,仍保持着构象从非折叠向折叠转换的能力[6]。
大量的研究已经报道,许多小分子化合物可作为mutp53潜在的重激活剂,引入小分子或多肽与mutp53结合可以恢复其与DNA的结合功能而发挥抗肿瘤作用[7]。这种突变构象改变的微弱性以及自身结构的可恢复性,为设计小分子化合物恢复mutp53构象提供了可能性。由于突变型p53(mutp53)在肿瘤细胞中通常有较高表达,从而成为区别于正常细胞的一个特异性抗肿瘤药物靶点[8]。迄今为止,只有PRIMA-1的衍生物APR-246进入Ⅱ期临床实验[9]。因此,急需开发新的mutp53潜在重激活剂。在大自然中,存在很多天然产物,而且天然产物在创新药物发现中是其他新技术和新手段无法替代的。因此从天然化合物中寻找和研究靶向mutp53的化合物具有重要的意义。
穿心莲内酯(andrographolide)是从穿心莲(A.paniculata)中提取的化合物,穿心莲是一种传统中草药,在中国古代和东亚其他地区被用来治疗一系列疾病,如癌症、类风湿性关节炎、腹泻、上呼吸道感染和喉炎[10]。此外,它还具有抗氧化、抗炎、抗凋亡和神经功能调节作用,如在阿尔茨海默病、创伤性脑损伤和缺血性中风的动物模型中具有很好的抗炎活性和治疗效果[11]。通过腺苷A2a受体激活Nrf2/HO-1途径,发挥抗氧化防御系统的功能[12];在抗肿瘤方面发现可通过抑制自噬并增强顺铂介导的肺癌A549细胞的凋亡[13];此外,通过以p53依赖的方式上调TRAIL死亡受体(DR4和DR5)抑制T24膀胱癌细胞的迁移和促进caspase介导的细胞凋亡[14]。还能通过抑制COX-2表达及失活p300信号通路和VEGF途径抑制乳腺癌发生与发展;诱导人恶性黑色素瘤C8161和A375细胞发生G2/M期阻滞而有效抑制其细胞增殖[15]。而在mutp53的肿瘤细胞中,可以诱导热休克蛋白(Hsp70)的表达,增加Hsp70与mutp53蛋白的结合,从而促进p53的蛋白酶体降解[16]。
本研究在进行靶向mutp53重激活剂的筛选中发现,穿心莲内酯可能作为mutp53潜在的重激活剂,初步探讨了穿心莲内酯在恢复mutp53的功能及其抗肿瘤作用。还发现穿心莲内酯可能通过影响Hsp70的表达从而激活p53下游靶基因而发挥抗肿瘤作用。本研究为靶向mutp53的药物研发提供一定的理论依据,同时也扩大了穿心莲内酯在抗肿瘤研究方面的应用价值。
1 材料与方法
1.1 实验材料
人结肠癌HT29、人乳腺癌SK-BR-3、人肺癌H1299细胞购自中科院细胞库;H1299(p53R273H)-WTPUMApromoter BS2、H1299(p53R175H)-WTPUMApromoter BS2细胞,穿心莲内脂、PRIMA-1购置Selleck公司;胎牛血清、1640培养基购置Gibco公司;DMSO(溶解药物)购自Amresco公司;Secrete-PairTMDual Luminescence Assay Kit购自GeneCopoeia公司;CHIP、p53、Noxa抗体购自Santa公司;PAb1620、PAb240抗体购自Millipore公司;PARP抗体购自CST公司;MDM2、PUMA抗体购自Abcam公司;p21抗体购自BD公司;Hsp70抗体购自CST公司。
1.2 实验方法
1.2.1 细胞培养
人肺癌H1299(p53R273H)-WTPUMApromoter BS2、H1299(p53R175H)-WTPUMApromoter BS2细胞是通过DNA重组技术,将PUMA启动子序列插入到双报告基因载体pEZX-GA01的GLuc报告基因上游,并通过脂质体转染得到稳定表达PUMA启动子荧光素酶报告基因系统,通过检测化合物对细胞中报告基因的表达量影响,可以表征p53与PUMA启动子的结合情况,作为mutp53重激活的筛选依据。以上细胞和人结肠癌HT29、SK-BR-3细胞培养于含10%胎牛血清的1640培养基中,置于37℃、5%CO2培养箱中培养。
1.2.2 MTT实验
取生长状态良好的细胞,用0.25%的胰蛋白酶消化后制成细胞悬液,血球计数板计数,按照一定的细胞密度接种到96孔板中(不同的细胞设置不同的接种密度),37℃培养箱中培养过夜;穿心莲内 酯 设 置5个 浓 度 梯 度(0.1、1、10、50、100 μmol/L)3个复孔,37℃培养箱中培养72 h后终止培养;每孔加入5 g/L MTT溶液25 μl,放置于培养箱中4 h;去除细胞悬液加入150 μl DMSO,置于摇床上振荡10 min;多功能酶标仪(美国Bio-TeK)仪器490 nm波长下测定A值。根据测定的A值计算出IC50值和细胞的相对存活率。
1.2.3 相对荧光素酶活实验
取生长状态良好的H1299(p53R273H)-WTPUMApromoter BS2、H1299(p53R175H)-WTPUMApromoter BS2细胞,用0.25%的胰蛋白酶消化后制成细胞悬液,血球计数板计数,按照一定的细胞密度接种到24孔板中(不同的细胞设置不同的接种密度),37℃培养箱中培养过夜;加入10或20 μmol/L穿心莲内脂、50 μmol/L PRIMA-1作为正对照(已经被证实作为mutp53的重激活剂)处理24 h,吸取细胞上清后,通过Secrete-PairTMDual Luminescence Assay Kit进行相对荧光酶活检测。
1.2.4 AnnexinV/PI双染检测细胞凋亡
取生长状态良好的HT29、SK-BR-3细胞种于带有盖玻片的6孔板中,待细胞贴壁后,用穿心莲内酯(10或20 μmol/L)处理48 h后,1×PBS洗涤细胞,加入0.25%胰酶(不含EDTA)消化,然后用培养基终止消化,轻轻吹散细胞,并将转移至15 ml离心管中,4℃,1 000×g,离心5 min。去上清,用1×PBS重悬细胞沉淀,转移至1.5 ml EP管中,4℃,1 000×g,离心5 min。然后根据凋亡试剂盒(北京四正柏生物公司,货号:FXP021)使用说明进行染色,避光孵育20 min,每个离心管加入缓冲液终止染色,采用BD Accuri C6流式细胞仪进行上机检测以及数据分析和统计。
1.2.5 免疫荧光实验
取生长状态良好的HT29、SK-BR-3细胞种于带有盖玻片的6孔板中,待细胞贴壁后,用穿心莲内酯(10或20 μmol/L)处理48 h后,1×PBS洗涤细胞,固定液(5%多聚甲醛∶1×PBS∶20%蔗糖=6∶3∶1)固定10 min,5%BSA室温封闭2 h,加一抗PAb240抗体(识别突变型p53)、PAb1620抗体(识别野生型p53)孵育过夜,加Goat-anti-mouse 488(绿光)荧光二抗,避光室温孵育2 h,1×PBS洗涤,染DAPI,室温孵育15 min,然后封片,拍片,观察穿心莲内酯处理HT29、SK-BR-3细胞后PAb240(识别突变型p53)与PAb1620(识别野生型p53)表达情况。
1.2.6 免疫印迹(Western blot)实验
穿 心 莲 内 酯(10或20 μmol/L)处 理 后 的HT29、SK-BR-3细胞用细胞刮刮下并收集细胞悬液,1 500 r/min离心5 min,用1×PBS清洗1次,加入细胞裂解液,提取细胞总蛋白质。用12%SDS聚丙烯酰胺凝胶对细胞样品进行电泳,电泳结束后将蛋白质转移至聚偏二氟乙烯膜(PVDF膜),用5%的脱脂奶粉封闭1 h,加入一抗4℃过夜,用1×TBST清洗3次,加入辣根过氧化物酶标记的二抗,室温孵育2 h。用化学发光检测系统检测。
1.2.7 细胞总RNA提取实验
穿 心 莲 内 酯(10或20 μmol/L)处 理 后 的HT29、SK-BR-3细胞,弃去旧培养基并用1 ml预冷的1×PBS充分清洗。然后,加入1 ml Trizol裂解液充分晃匀后静置1 min。用1 ml微量移液器反复吹吸,使细胞离壁并将细胞悬液转移至预冷的1.5 ml EP管中,样品经涡旋剧烈振荡30 s后,冰浴中静置孵育10 min,然后加入200 μl氯仿。再次涡旋振荡30 s后,冰浴中静置孵育10 min,4℃,13 000 r/min离心15 min。将上层水相(RNA分布在上层)移至已预冷的新1.5 ml离心管中,加入等体积的预冷异丙醇,充分混匀后,放入-20℃冰箱中孵育30 min后,4℃下13 000 r/min离心15 min,小心弃去上清,用1 ml 75%乙醇(用DEPC水配制)轻轻重悬清洗RNA沉淀,然后4℃,以8 000 r/min离心5 min,小心弃去上清。打开样品管的盖子并倒扣在干净的滤纸上直至乙醇完全挥发,加入适量DEPC水溶解RNA沉淀,样品在多功能酶标仪(Bio-TeK)仪器测量浓度,样品用于后续实验存于-80℃备用。
1.2.8 实时荧光定量PCR
反应体系:4 μl SYBR Green,2 μl上游引物(1 μmol/L),2 μl下游引物(1 μmol/L),2~5 μl DNA模板,加ddH2O至20 μl。反应参数:Cycle 1(1×)、50℃、30 min;Cycle 2(1×)、90℃、10 min;Cycle 3(35×)、95℃、15 s,60℃、60 s,95℃、15 s;Cycle 4(1×)、65℃、60 s;95℃、15 s。根据3次实验所得到的各基因Ct平均值,通过2-ΔΔCt计算基因相对表达量。
1.2.9 RNA干扰实验
对数生长期的HT29、SK-BR-3细胞消化及终止消化后制成单细胞悬液,按计数结果将8×105个细胞种于培养皿(60 mm规格),并以1640完全培养基将体积补足至5 ml后将细胞置于培养箱培养至次日。待细胞汇合度为60%~80%左右时,即可进行siRNA/ShRNA转染。首先,将TransIntroTMEL转染试剂从4℃取出并移取适量至1.5 ml离心管使其恢复至室温,然后取已在冰水浴解冻的500 pmol siRNA/8.0 μg ShRNA至装有500 μl Opti-MEM培养基的1.5 ml EP管中,轻轻混匀。然后,加入18 μl已恢复至常温的TransIntroTMEL转染试剂再次混匀后在常温孵育20 min,制备siRNA-转染试剂复合物。将待转染的细胞从培养箱取出,弃去旧培养基后加入5 ml新鲜Opti-MEM培养基,将siRNA-转染试剂复合物缓慢加至细胞中,轻微晃匀后放于培养箱培养6 h。最后,将Opti-MEM更换为1640完全培养基,并将细胞继续培养48 h后收集蛋白质进行免疫印迹实验检测干扰情况。siRNA NC与siRNA Hsp70片段(5'-AGAAGAAGGTGCTGGACAA-3')是由广州锐博生物科技有限公司定制合成。
2 结 果
2.1 穿心莲内酯对mutp53具有重激活作用
为了能够从天然产物中寻找mutp53潜在的重激活因子,将mutp53(R273H和R175H)转入到H1299(p53null)细胞中,同时将PUMA启动子荧光素酶报告基因载体构建至细胞中构建了H1299-p53 R273H-WTPUMApromoter和H1299-p53R175H-WTPUMApromoter BS2稳定细胞株,并且筛选了一系列天然化合物。结果发现穿心莲内酯(20 μmol/L)处 理H1299(p53R273H)-WTPUMApromoter BS2、H1299(p53 R175H)-WTPUMApromoter BS2细胞48 h后,可以增加PUMA荧光素报告基因相对荧光酶活2倍,而PRIMA-1(50 μmol/L)(已经报道是mutp53的重激活剂)增加了3倍(图1)。提示化合物穿心莲内酯可能对mutp53 R273H和R175H有重激活功能。
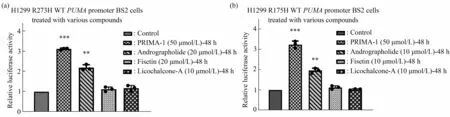
Fig.1 The relative luciferase activity of compounds in the H1299 p53R273H-PUMA promoter(a)and H1299 p53R175H-PUMA promoter(b)cells
2.2 穿心莲内酯可以诱导肿瘤细胞发生凋亡
采用MTT方法检测了穿心莲内酯在不同突变p53背景下肿瘤细胞的增殖作用,发现穿心莲内酯能够抑制肿瘤细胞的增殖,其中对SK-BR-3(R175H)细胞的抑制作用最强,其IC50值4.81 μmol/L,其次为HT29(R273H)和H1299-R273H,IC50值分别为17.69 μmol/L和15.55 μmol/L(表1),提示穿心莲内酯对mutp53细胞具有抗肿瘤作用。为了进一步探究穿心莲内酯是否能够诱导突变p53细胞产生凋亡,采用穿心莲内酯(10、20 μmol/L)处理HT29、SK-BR-3细 胞12、24、48 h后,随着时间梯度的增加,通过Western blot的方法检测,发现凋亡相关蛋白PARP产生切割,mutp53表达降低(图2)。此外通过C6流式细胞自动分析仪(美国BD)分析检测发现,在穿心莲内酯(10、20 μmol/L)处理HT29细胞48 h后,此细胞的凋亡比例明显增加(图3)。上述结果说明穿心莲内酯可以抑制肿瘤细胞的增殖和诱导细胞发生凋亡。

Table 1 The anti-tumor effect of andrographolide on cell proliferation
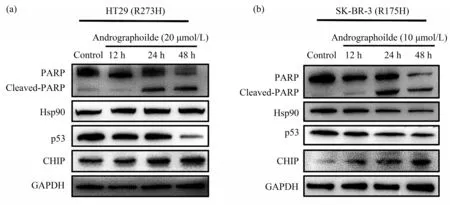
Fig.2 The anti-proliferation and apoptosis effects of andrographolide in HT29(a)and SK-BR-3(b)cells
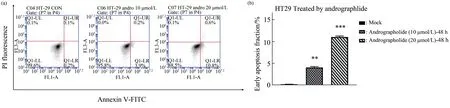
Fig.3 The apoptosis effects of andrographolide in HT29 cells by cell flow cytometry analysis and statistical analysis of early apoptosis fraction
2.3 穿心莲内酯恢复mutp53的野生型构象
为了进一步探究穿心莲内酯是否能够将mutp53转变为野生型构象,采用穿心莲内酯(10、20 μmol/L)处理HT29、SK-BR-3细胞48 h后,在分别用识别突变型p53抗体PAb240和识别野生型p53抗体PAb1620进行免疫荧光。实验发现,随着化合物浓度的增加,突变型p53(PAb240)的比例降低,而野生型p53(PAb1620的比例增加(图4)。提示穿心莲内酯具有将mutp53转变为野生型的功能。
2.4 穿心莲内酯上调p53下游靶基因的表达
为了进一步探讨穿心莲内酯在能够恢复mutp53野生型功能的基础上,是否也能够恢复p53的转录活性,采用穿心莲内酯(10、20 μmol/L)处理HT29、SK-BR-3 12、24、48 h后,随着时间的增加,细胞中p53下游基因PUMA、p21和Noxa的蛋白质和mRNA水平上升(图5、6)。提示穿心莲内酯可能是通过恢复部分野生型p53的活性,进而转录激活p53下游凋亡相关蛋白PUMA、Noxa和细胞周期相关蛋白p21的表达而发挥抗肿瘤作用以及诱导细胞发生凋亡。
2.5 穿心莲内酯上调p53下游靶基因依赖于mutp53
由于p53家族成员TAp63、TAp73可以调控PUMA、BAX、NOXA、p21等共同下游靶基因[17],因此,进一步验证穿心莲内酯处理后,PUMA、p21等p53靶基因的上调是否是依赖于mutp53。联合p53转录抑制剂PFT-α抑制p53转录作用后,观察到穿心莲内酯对HT29、SK-BR-3细胞中PUMA、p21等p53靶基因的蛋白质水平(图7)和mRNA水平(图8)明显受到抑制,提示穿心莲内酯可能通过依赖于重激活mutp53而上调p21、PUMA等p53下游靶基因的表达。
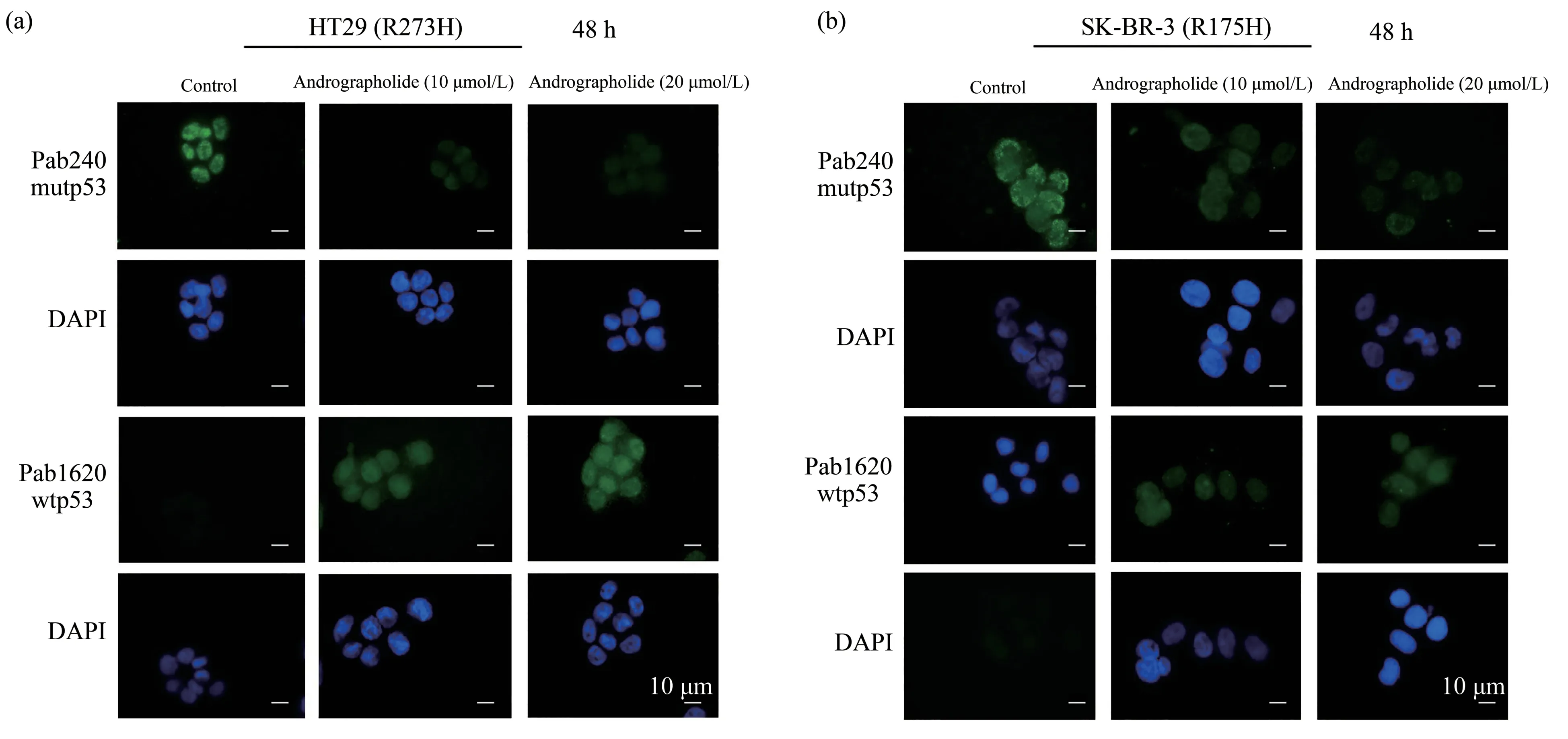
Fig.4 The effect of andrographolide on the expression of mutp53 and wild-type p53 in HT29(a)and SK-BR-3(b)cells

Fig.5 The effect of andrographolide on the expression of p53 signaling pathway proteins in HT29(a)and SK-BR-3(b)cells

Fig.6 The effect of andrographolide on the mRNA expression of p53 signaling pathway in HT29(a)and SK-BR-3(b)cells
2.6 穿心莲内酯通过调控分子伴侣Hsp70的表达来影响mutp53转录激活
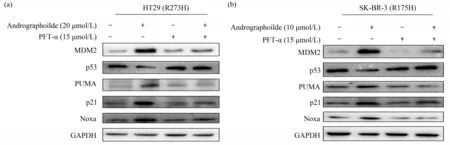
Fig.7 The p53 related protein expressions in combination with p53 transcription inhibitor PFT-α in HT29(a)and SK-BR-3(b)cells

Fig.8 The mRNA expression of p53 target genes in combination with p53 transcription inhibitor PFT-α in HT29(a)and SK-BR-3(b)cells
已经有文献报道[16],穿心莲内酯可以通过增加Hsp70的表达,来促进Hsp70与mutp53的结合,使mutp53通过蛋白酶体途径降解。热休克蛋白家族关键成员(如Hsp40、Hsp70、Hsp90)除了可与客体蛋白mutp53形成保护性复合体,使mutp53逃逸CHIP、MDM2介导的泛素化降解之外,还可以驱动错叠蛋白发生构象转变,以及稳定其活性[17]。因此,本文进一步探究了是否穿心莲内酯对mutp53重激活是否也与分子伴侣Hsp70表达有关。在穿心莲内酯处理后发现Hsp70的表达增加,采用RNA干扰技术,在敲低Hsp70后,穿心莲内酯对p53下游靶蛋白的上调作用明显受到抑制(图9)。因此,提示穿心莲内酯对mutp53重激活作用可能依赖于Hsp70的调控。

Fig.9 The effect of andrographolide with Hsp70 knock-down on the p53 target protein expressions in HT29(a)and SK-BR-3(b)cells
3 讨 论
突变p53不仅失去其原有野生型的抑癌功能,同时通过功能获得性效应(gain-of-function,GOF)并与其他一些因子相互作用,使其稳定并积累促进肿瘤的发生和发展[18]。由于在肿瘤细胞中p53突变频率高,因此,靶向作用mutp53(降解mutp53或恢复为野生型p53)而发挥抗肿瘤作用具有较好的研究前景[5]。针对靶向mutp53的肿瘤治疗策略之一是恢复mutp53野生型功能[19-20]。
穿心莲内酯作为一种神经系统保护的药物[21],同时也具有抗肿瘤的作用,Yuwen等[12]发现在人肺癌A549细胞中,穿心莲内酯通过抑制自噬途径来增强顺铂诱导的凋亡。此外它还能通过抑制COX-2表达和失活p300信号通路和VEGF途径抑制乳腺癌发生与发展[14]。前期Sato等[16]发现,穿心莲内酯可以通过增加Hsp70的表达,来促进Hsp70与mutp53的结合,使突变p53通过蛋白酶体途径降解,同时增加细胞周期阻滞和细胞凋亡。而本实验结果发现,在具有mutp53背景的细胞中,穿心莲内酯能够明显抑制肿瘤的增殖,发挥很好的抗肿瘤效果;同时,穿心莲内酯可以使mutp53背景的细胞中野生型p53比例增加,并且上调p53下游靶蛋白PUMA、p21、Noxa的表达,从而参与调控细胞凋亡和细胞周期因子PARP切割增强,诱导细胞发生凋亡。从蛋白质水平的实验结果推测,穿心莲内酯处理HT29、SK-BR-3细胞后可能导致细胞凋亡和细胞周期阻滞的发生,与Sato等[16]报道的结果一致。Deng等[13]发现穿心莲内酯以p53依赖的方式上调TRAIL的死亡受体(DR4和DR5)来抑制T24膀胱癌细胞的迁移,并促进caspase介导的细胞凋亡。说明穿心莲内酯可以调控野生型p53的功能。化合物如PRIMA-1、STIMA-1、MIRA-1等在恢复mutp53野生型功能后,对肿瘤细胞的生长具有很好的抑制效果[22-23]。此外,由于mutp53在肿瘤细胞中可以与其他肿瘤抑制因子(如TAp63和TAp73)形成复合物,使肿瘤抑癌基因失活;在恢复mutp53的野生型功能后,可以使这些肿瘤抑制因子激活,发挥抗肿瘤作用;Zhang等[24]发现,化合物NSC59984可以打破mutp53与TAp73的作用,从而激活TAp73调控p53的下游靶基因,诱导结肠癌细胞发生调亡。本课题组也发现在联合p53转录抑制剂PFT-α处理时,穿心莲内酯对mutp53重激活作用明显受到抑制,说明穿心莲内酯对mutp53的转录激活是依赖于mutp53;同时,能够明显上调CHIP的表达,CHIP作为E3泛素连接酶,在肿瘤细胞中对mutp53的稳定性起关键作用,已经有报道,一些化合物可以通过CHIP泛素化途径降解mutp53[17,25]。HSP90作为分子伴侣与mutp53形成稳定的复合体而抑制MDM2和CHIP介导的泛素化降解途径,使突变更好地发挥其癌基因功能[26]。HSP90抑制剂geldanamycin、17-DMAG(geldanamycin derivative)、ganetespib等都可破坏mutp53-HSP90/Hsp70-复合体,使mutp53去稳定性,诱 导 突 变p53发 生 降 解[27]。HDAC抑 制 剂SAHA(Vorinostat)、丁酸钠(sodium butyrate)、Romidepsin等,通过破坏HDAC6-HSP90/Hsp70-mutp53复合体,诱导mutp53通过MDM2和CHIP介导的泛素化途径降解[28]。本研究也发现,穿心莲内酯可以增加Hsp70、CHIP蛋白的表达,提示穿心莲内酯可能从CHIP泛素化途径降解mutp53的表达,与此前报道一致。
此外,热休克蛋白家族作为重要的分子伴侣,可结合错叠蛋白并促进其重折叠或泛素化降解。mutp53的稳定性及构象转变均受热休克蛋白的影响,并且mutp53与热休克蛋白家族之间存在反馈调节机制。已发现热休克蛋白家族关键成员Hsp40、Hsp70、Hsp90可与客体蛋白mutp53形成保护性复合体,使mutp53逃逸CHIP、MDM2介导的泛素化降解[17,29]。此外,mutp53可将pHSF1(Ser326)募集到靶基因启动子区转录激活Hsp70、Hsp90从而进一步稳定mutp53[30]。热休克蛋白家族除了可以调控mutp53的稳定性外,对其构象及功能也具有潜在影响。由于mutp53与Hsp70、Hsp90形成复合体后会发生构象解旋,mutp53从复合体解离后会自行重新折叠,因此mutp53有恢复野生型构象的可能性[17],由于热休克蛋白家族可以促进错叠蛋白发生构象转变,这提示着热休克蛋白家族除了与mutp53的降解有关外,也与mutp53的重激活有潜在联系。已经研究证实,毛壳菌素通过Hsp40家族成员DNAJB1恢复mutp53(R175H)的野生型构象及功能[31],而SLMP53-2则是通过另一分子伴侣Hsp70来重激活mutp53[7,31-32]。上述研究进一步证实分子伴侣与mutp53这种潜在联系。在生理和热休克温度下,Hsp70和Hsp90分子伴侣网络不仅对维持野生型p53转录活的发挥重要作用,而且对mutp53蛋白的错误折叠构象稳定性起着决定作用[33]。而本文研究发现,穿心内酯可能直接或间接通过与Hsp70作用,从而影响mutp53重激活,发挥抗肿瘤效果。但其具体的分子机制还有待进一步探索。
4 结 论
本研究初步揭示了穿心莲内酯可以作用不同突变p53的肿瘤细胞HT29、SK-BR-3,抑制肿瘤细胞的增殖、诱导凋亡和降低mutp53的表达,同时增加野生型p53的比例,并且增加了p53下游相关蛋白PUMA、p21、Noxa的表达,且下游因子表达的增加是依赖于p53,进一步的研究发现穿心莲内酯恢复mutp53野生型功能主要是通过Hsp70调控。为靶向mutp53抗肿瘤药物治疗提供了理论依据,同时也阐述了穿心莲内酯的抗肿瘤机制,为其抗肿瘤药物开发治疗提供了实际应用价值。

