达格列净对阿霉素所致心肌损伤保护机制的初步研究*
付 勇,俸艳英
(广西医科大学附属肿瘤医院心肺功能中心,南宁 530021)
阿霉素(doxorubicin,DOX)是第二代蒽环类抗肿瘤药物,广泛用于淋巴瘤、白血病、乳腺癌、卵巢癌、软组织肉瘤、肺癌等血液系统恶性肿瘤和实体瘤的治疗[1]。然而,DOX 可诱发心脏毒性导致心肌病和心力衰竭,并且心肌病和心力衰竭是限制DOX临床应用的最主要不良反应之一[2]。虽然当前许多学者仍致力于防治DOX 诱导心脏毒性的新药研究[3-4]。但迄今为止,仍然缺乏预防和管理DOX诱发心脏毒性的最佳策略。因此,寻找有效防治DOX心脏毒性的药物对改善肿瘤患者化疗后生活质量具有重要临床意义。
达格列净(dapagliflozin,Dapa)属于钠—葡萄糖共转运蛋白2(sodium-glucose transporter 2,SGLT2)抑制剂类非胰岛素依赖性降糖药物。近年来,越来越多的研究表明,SGLT2 抑制剂除降糖作用外,还可显著降低糖尿病或非糖尿病患者的心力衰竭住院率及心血管疾病死亡风险[5]。有研究发现,Dapa对接受DOX 治疗的患者有保护心肌功能的作用[6]。然而,Dapa 心肌保护作用的相关机制尚需要进一步探索。因此,本研究探讨Dapa 对DOX 所致心肌损伤的保护作用及可能相关机制。
1 材料与方法
1.1 材料与试剂
H9c2 大鼠心肌细胞株购自中国科学院上海细胞库。细胞计数试剂盒8(cell counter kit-8,CCK-8)购自日本Dojindo Lab 公司;DOX购自深圳万乐药业有限公司;Dapa 购自美国MedChemexpress(MCE)公司;DMEM培养基购自美国Corning公司;特级胎牛血清(FBS)、0.25%胰蛋白酶(含EDTA)购自美国Gibco 公司;TUNEL 细胞凋亡检测试剂盒、DAPI染色液购自上海碧云天生物技术有限公司;肌酸激酶(CK)检测试剂盒购自北京索莱宝生物科技有限公司;Bax(货号:2772)、白细胞介素(IL)-6(货号:12153)、GAPDH(货号:5174)、HRP 结合二抗(货号:7074)购自美国CST 公司;Bcl-2(货号:ab196495)、肿瘤坏死因子-α(TNF-α)(货号:ab6671)购自美国Abcam公司。
1.2 细胞培养
H9c2 大鼠心肌细胞于37 ℃、5%CO2培养箱中培养,置于含10%FBS 和1%青链霉素混合液的DMEM 培养基,选取对数生长期细胞胰酶消化、传代进行后续实验。
1.3 CCK-8法检测H9c2细胞增殖率并确定药物最佳作用条件
将H9c2 细胞接种于96 孔板中,每孔3 000 个,设置5 个复孔。待细胞贴壁后,以不加药处理的H9c2 细胞为NC 组,根据实验目的进行以下处理:(1)采用浓度为(0.5 μmol/L、1 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L)DOX 处理H9c2细胞12 h、24 h,以确定DOX 最佳实验研究条件;(2)采用浓度为0.1 μmol/L、1 μmol/L、10 μmol/L Dapa 处理H9c2 细胞24 h、48 h,以观察Dapa 对H9c2 细胞增殖率影响。(3)采用浓度为0.1 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L Dapa 预处理细胞24 h,除NC 组外,其余各组加入1 μmol/L DOX 处理24 h,以确定Dapa 最佳预处理条件。终止培养后,每孔加入10 μL CCK-8,混匀后于培养箱中孵育2 h,用酶标仪(λ=450)记录各孔吸光度(OD 值)。细胞增殖率计算公式:细胞增殖率(%)=(处理组OD 值-空白孔OD 值)/(NC 组OD 值-空白孔OD 值)×100%。实验重复3次。
1.4 实验分组
将H9c2 细胞分为4 组:NC 组(不加药处理)、DOX 组(用1 μmol/L DOX 处理24 h)、Dapa 组(用1 μmol/L Dapa预处理细胞24 h)、Dapa+DOX组(用1 μmol/L Dapa 预处理细胞24 h,换液后再加用1 μmol/L DOX处理24 h)。
1.5 TUNEL试剂盒检测H9c2细胞凋亡
H9c2细胞按1.9×105个细胞/孔接种于6孔板中的细胞爬片上,待细胞贴壁恢复正常形态后,按“1.4项”分组处理细胞。各组细胞处理后,4%多聚甲醛固定细胞,用0.3%Triton X-100 通透细胞,TUNEL检测液于37 ℃避光孵育60 min,DAPI染色5 min,用抗荧光淬灭封片液封片后荧光显微镜下观察并拍照。每组随机选取3 个视野并计数凋亡细胞数,细胞凋亡率(%)计算公式=每个视野下凋亡细胞数/该视野下细胞总数×100%。实验重复3次。
1.6 CK试剂盒检测CK活性
H9c2 细胞按9×105个细胞/孔接种于直径为100 mm 培养皿中,实验分组如“1.4 项”所示。处理完成后,取细胞培养液按试剂盒说明书测定CK 活性。实验重复3次。
1.7 Western blotting检测心肌促炎因子TNF-α、IL-6和凋亡蛋白Bcl-2、Bax表达水平
取各组H9c2 细胞加入RIPA 裂解液于冰上裂解,离心后取上清液,用BCA 法测定蛋白浓度。蛋白上样量30 μg/20 μL,以10%SDS-PAGE凝胶进行电泳分离,电压80~120 V,电泳1~1.5 h,转膜后用含5%脱脂奶粉的TBST 封闭2 h,加入TNF-α(1∶1 000)、IL-6(1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶1 000),GAPDH(1∶1 500),4 ℃摇床孵育过夜。TBST 冲洗3 次,每次15 min。加入二抗(HRP 接合IgG,1∶1 500),室温孵育2 h,配制ECL发光显影液,于化学发光成像仪上显影,摄片。用Image J 计算每个蛋白条带的灰度值,以GAPDH 为内参。实验重复3次。
1.8 统计学方法 采用SPSS 21.0软件进行统计分析,计量资料用均数±标准差()表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 Dapa对DOX诱导H9c2细胞增殖率的影响
如图1A所示,不同浓度(0.5 μmol/L、1 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L)DOX 作用H9c2 细胞12 h、24 h 后,细胞增殖率随DOX 作用浓度和时间增加而降低;与对照组比较,其中1 μmol/L DOX 作用H9c2细胞24 h时,细胞增殖率为[(78.81±4.91)%,P<0.05],与本课题组前期实验模型一致[7],以该处理浓度和时间作为DOX诱导H9c2心肌细胞模型的处理条件。
如图1B所示,不同浓度(0.1 μmol/L、1 μmol/L、10 μmol/L)Dapa作用H9c2细胞24 h、48 h后,当Dapa浓度为1 μmol/L作用24 h时,细胞增殖率明显提高(P<0.05)。如图1C 所示,与DOX 组H9c2 细胞增殖率比较,Dapa浓度 为1 μmol/L、5 μmol/L、10 μmol/L时可提高H9c2细胞增殖率(P<0.01),且Dapa浓度为1 μmol/L、5 μmol/L、10 μmol/L时,细胞增殖率之间差异无统计学意义(P>0.05)。因此,选择1 μmol/L Dapa预处理H9c2细胞24 h进行下一步实验。

图1 Dapa对DOX诱导H9c2细胞增殖率的影响
2.2 Dapa对DOX诱导H9c2细胞凋亡的影响
如图2所示,与NC组比较,DOX组细胞凋亡率升高(P<0.001),Dapa 组细胞凋亡率无显著差异(P>0.05)。与DOX 组比较,Dapa+DOX 组细胞凋亡率降低(P<0.01)。
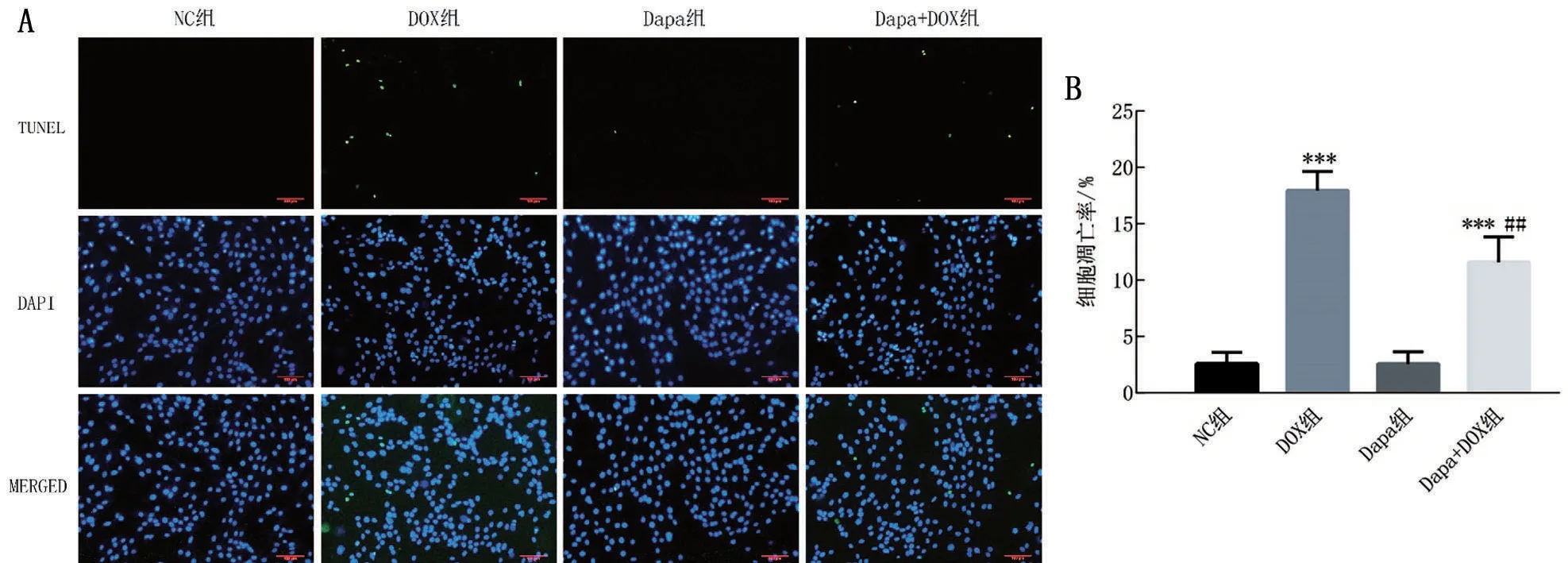
图2 Dapa对DOX诱导H9c2细胞凋亡的影响
2.3 Dapa对DOX诱导H9c2细胞损伤的影响
如图3 所示,与NC 组比较,DOX 组CK 活性升高(P<0.001);Dapa 组CK 活性差异无统计学意义(P>0.05)。与DOX组相比,Dapa+DOX组CK活性下降(P<0.01)。

图3 Dapa对DOX诱导H9c2细胞损伤的影响
2.4 Dapa 对DOX 诱导H9c2 细胞炎症反应和凋亡的影响
如图4 所示,与NC 组比较,DOX 组H9c2 细胞Bcl-2 蛋白表达水平降低(P<0.001),TNF-α、IL-6、Bax蛋白表达水平升高(P<0.001);Dapa组TNF-α、IL-6、Bcl-2、Bax 蛋白表达水平差异无统计学意义(P>0.05)。与DOX 组比较,Dapa+DOX 组H9c2 细胞Bcl-2蛋白表达水平升高(P<0.05),TNF-α、IL-6、Bax蛋白表达水平降低(P<0.001)。

图4 Dapa对DOX诱导H9c2细胞炎症反应和凋亡的影响
3 讨论
DOX作为实体瘤和血液系统肿瘤化疗的基石,部分患者接受DOX治疗后会出现心脏功能受损,且其心脏毒性呈现时间—剂量依赖性[1],严重影响其肿瘤治疗中的使用剂量及疗效。由于过度氧化应激导致心肌细胞凋亡,是DOX诱导心脏毒性的主要病理机制之一[8]。DOX可直接增加心脏组织中的活性氧生成而激活凋亡调节因子,通过激活内源性凋亡通路诱导BCL-2 凋亡蛋白家族中,促凋亡蛋白Bax的上调[9]和抗凋亡蛋白Bcl-XL下调[10]。Wang等[11]的研究发现,DOX 可引起患者全身性炎症反应,增强促炎因子TLR4(Toll-like receptor 4)的表达,导致严重的心脏毒副作用,同时研究通过阻断炎症因子的表达可有效降低DOX 诱导的毒副作用。本研究亦显示,DOX对心肌细胞的损伤中表现出细胞凋亡率、促炎因子TNF-α、IL-6 和凋亡蛋白Bax 表达升高,抗凋亡蛋白Bcl-2 表达降低。此外,DOX还可增加炎症因子IL-6、TNF-α和NF-κB的表达[12],亦可激活NF-κB 信号通路[13],诱导心肌凋亡。因此,减轻心肌炎症反应抑制细胞凋亡亦可能是防治DOX所致心脏毒性的作用机制。
Dapa属于SGLT2抑制剂,作为一种新型非胰岛素依赖性降糖药,在减少心血管不良事件方面的积极作用已经得到证实[14-15],欧洲心脏病学会最新指南中建议,该药为心力衰竭或多心血管风险患者优先选用药物[5]。据报道,SGLT2 抑制剂对接受DOX治疗的患者有保留心肌功能作用,推测其可能机制是通过改善心脏能量代谢、预防炎症、抑制心脏Na+/H+交换器和降低氧化应激[16]。实验发现,Dapa通过RONS/STAT3 通路调节巨噬细胞M1 型向M2 型转化,可显著减轻野生型大鼠心肌梗死后心肌的炎症反应,减少心肌梗死面积,改善心肌重塑[17]。本实验研究发现,Dapa预处理后,DOX诱导的H9c2细胞凋亡率降低,促炎因子TNF-α、IL-6和凋亡蛋白Bax表达降低,抗凋亡蛋白Bcl-2 表达升高。表明Dapa 可能通过减轻H9c2 细胞中促炎因子和凋亡蛋白的表达,进而减少细胞凋亡,发挥保护心肌细胞免受DOX毒性损伤作用。
综上所述,Dapa可能通过降低心肌的炎症反应和细胞凋亡,对防治DOX诱导心肌细胞毒性起到保护作用。本实验仅从细胞水平对相关机制进行初步研究,其涉及的信号通路仍需进一步实验探索。

