萤火虫荧光素酶标记的马尔尼菲篮状菌的构建与应用*
罗 强,韦吴迪,,3,王 刚,何锦豪,张 洪,包秀丽,陈丽香,蒋俊俊,,3,叶 力,,3,梁 浩,,3△
(1.广西医科大学生命科学研究院,再生医学与医用生物资源开发应用省部共建协同创新中心,南宁 530021;2.广西医科大学公共卫生学院,广西艾滋病防治研究重点实验室,南宁 530021;3.中国(广西)-东盟新发传染病联合实验室,南宁 530021)
马尔尼菲篮状菌(talaromyces marneffei,TM)是一种温度依赖型二相真菌,作为一种机会性的致病性真菌,可在免疫系统功能低下人群中引起感染性疾病,尤其是在HIV/AIDS 人群[1]。HIV/AIDS 合并TM感染可导致高复发率与病死率[2],是一种严重危害人类健康的病原体。目前的研究主要聚焦于TM与宿主间的相互作用[3],但关于TM潜伏感染与复发的机制尚未阐明。传统真菌相关研究主要涉及细胞与动物感染模型构建,而动物实验需在特定时间处死小鼠并取材,观察脏器变化和真菌负荷等指标,进而评估TM的感染进程[4-6]。然而,该手段无法实现对TM感染全过程的动态监测。因此建立一种可追踪的工具菌来实时评估TM的感染进程尤为重要。
生物发光成像作为一种非侵入性的成像方法,广泛的应用于细胞、细菌、真菌及病毒的实时追踪。其中,基于萤火虫荧光素—荧光素酶(firefly luciferase,Luc)的报告系统研究最为广泛,该方法涉及肿瘤进展的监测、疾病诊断与治疗、病原微生物感染的实时监测等多个方面[7-10]。该技术已应用在白色念珠菌的研究中,以基因组学技术将Luc 基因整合至真菌基因组,实现对真菌的标记,可视化真菌在宿主体内的定植部位以及评价药物对真菌的清除效果[11]。然而,尚未有利用Luc标记TM菌株的报道。本研究采用农杆菌介导转化(agrobacteriun tumefaciens-mediated transformation,ATMT)将Luc基因插入TM基因组,使TM菌株可稳定表达Luc基因,并在形态与功能上与TM标准株比较,探究TMLuc作为工具菌的效果及潜力。
1 材料与方法
1.1 材料
1.1.1 细胞与菌株 TM 标准株ATCC18224,购买于美国ATCC;pASP-hyg 质粒购于武汉锐志魔方生物科技有限公司;农杆菌感受态细胞EHA105 购于上海维地生物技术有限公司;THP-1 细胞系购于中国科学院上海生命科学研究院细胞库。
1.1.2 主要试剂 Q5 High-Fidelity DNA Polymerase(NEB),2×Taq Plus Master Mix Ⅱ(Dye Plus)(Vazyme),ClonExpress ⅡOne Step Cloning Kit(Vazyme),HiScript ⅢRT SuperMix for qPCR(+gDNA wiper)(Vazyme),EHA105(pSoup)(唯地生物),LB培养基(海博生物),沙氏葡萄糖液体培养基(青岛海博),卡那霉素(索莱宝),利福平(索莱宝),As 乙酰丁香酮(索莱宝),潮霉素B(索莱宝),DMEM basic 高糖培养液(Gibco),RPMIMedium 1640 basic培养液(Gibco)。
1.1.3 主要仪器 PCR 仪(ABI),北京六一电泳仪(DYY-7C),哈东联恒温摇床(DLHR-X250),化学成像系统(Bio-Rad Chem Doc),冷冻离心机(Beckman Microfuge 20R),微量移液器(瑞宁),微量分光光度计(Thermo Nanodrop 2000),活体成像动物仪(PerkinElmer),Cyto FLEX2 流式细胞仪(Beckman Coulter)。
1.2 方法
1.2.1 重组质粒pCAMBIA1303-TrpC-Hygro-gpdALuc的构建 以pGL3-basic质粒为模板,设计Luciferase 引物进行扩增,引物序列见表1。对pCAMBIA1303-TrpC-Hygro-gpdA-GFP载体骨架进行双酶切。37 °C 反应1 h,80 °C 失活10 min,之后通过1.5%琼脂糖凝胶电泳回收酶切后的载体骨架,将回收的PCR 产物与酶切后回收的pCAMBIA1303-TrpC-Hygro-gpdA-GFP 载体骨架进行重组连接。37°C 反应30 min 后迅速置于冰上冷却;随后将重组产物转化至TranT1感受态细胞,涂布于含有卡那霉素(50 μg/mL)的LB 培养基上,37°C 培养箱中倒置培养12~16 h;挑取重组反应转化平板上若干个克隆进行菌落PCR 鉴定,引物见表1。扩增后进行电泳验证,随后对目标菌落扩大培养,进行小质粒提取并进行测序。
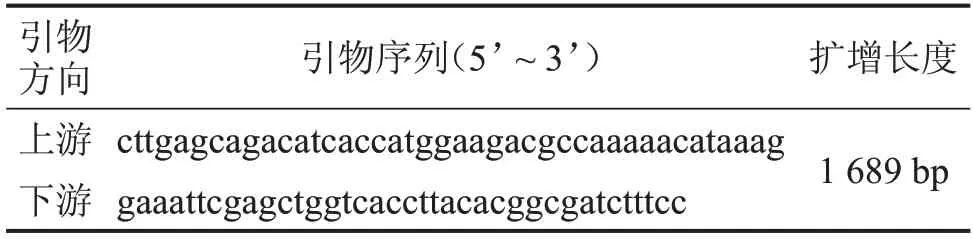
表1 Luciferase引物序列
1.2.2 潮霉素浓度筛选 将TM标准株涂布于含有不同浓度潮霉素(0 μg/mL,20 μg/mL,40 μg/mL,60 μg/mL,80 μg/mL,100 μg/mL)沙氏葡萄糖培养基平板中,在37°C温箱中培养3 d,筛选出无菌落生长的最低潮霉素浓度。
1.2.3 农杆菌转化培养及TM-Luc转化子的构建 取适量重组质粒与EHA105 感受态细胞,加入无抗生素的LB 液体培养基在28°C 环境下培养2~3 h,离心留取上清,将上清涂布于含50 μg/mL 卡那霉素,20 μg/mL 利福平的LB 平板继续培养2 d,挑取阳性克隆株于含20 mg/LAs 的LB 液体培养基,28°C震荡培养至OD600nm为0.8左右待用。将含有质粒的EHA105感受态细胞与TM标准株按比例进行共培养24 h,收集悬液涂布至含潮霉素的沙氏葡萄糖培养基平板上,放入37°C 温箱培养至有菌落产生,随后挑取菌落至新的含潮霉素的沙氏葡萄糖培养基平板进行扩大培养,提取基因组进行PCR 鉴定,引物见表2。
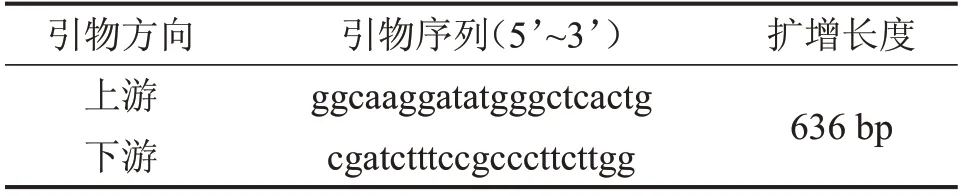
表2 TM-Luc引物序列
1.2.4 TM 标准株与TM-Luc 生长形态对比 根据说明书配比配置PDA与BHI培养基,121°C,20 min高压后,倒入培养皿中,待其冷却后分别在培养皿中央滴加10 μL TM 标准株菌液或TM-Luc 菌液,PDA和BHI培养基分别放入27°C和37°C培养箱,持续培养18 d;每日取出培养皿进行拍照,采用十字交叉法量取菌落直径。
1.2.5 细胞培养与感染模型构建 使用RPMIMedium 1640 basic(含10%胎牛血清,1%青链霉素混合液)完全培养液培养THP-1 细胞,并置于37 °C、含5%CO2的恒温培养箱中。使用含有PMA的DMEM(含10%胎牛血清,1%青链霉素混合液)完全培养液刺激48 h,即可转化为THP-1 来源的巨噬细胞。随后用TM标准株与TM-Luc感染THP-1巨噬细胞,感染复数为1∶3,分别收集感染后24 h、48 h的总RNA进行后续炎症因子检测,同时收集24 h、48 h和72 h的细胞悬液进行细胞死亡情况的检测。
1.3 统计学方法
采用GraphPad Prism 8与SPSS Statistics 26软件进行统计学分析,计量资料采用均数±标准差(),假设检验采用Student t检验与双因素重复测量方差分析检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 重组质粒pCAMBIA1303-TrpC-Hygro-gpdALuc的构建及验证
使 用NcoI、BstEII酶切pCAMBIA1303-TrpCHygro-gpdA-GFP 质粒(图1A),经琼脂糖凝胶电泳回收后与扩增的Lucifera 产物(图1D)进行重组连接,构建pCAMBIA1303-TrpC-Hygro-gpdA-Luc 重组质粒(图1B),挑取重组反应产物进行PCR 鉴定,在12 个单克隆菌落中发现3 个菌落在目的位置出现条带(图1C)。随后挑选其中一个单克隆菌落(泳道7)进行扩大培养,提取少量质粒进行测序比对,比对结果证明重组质粒构建成功。
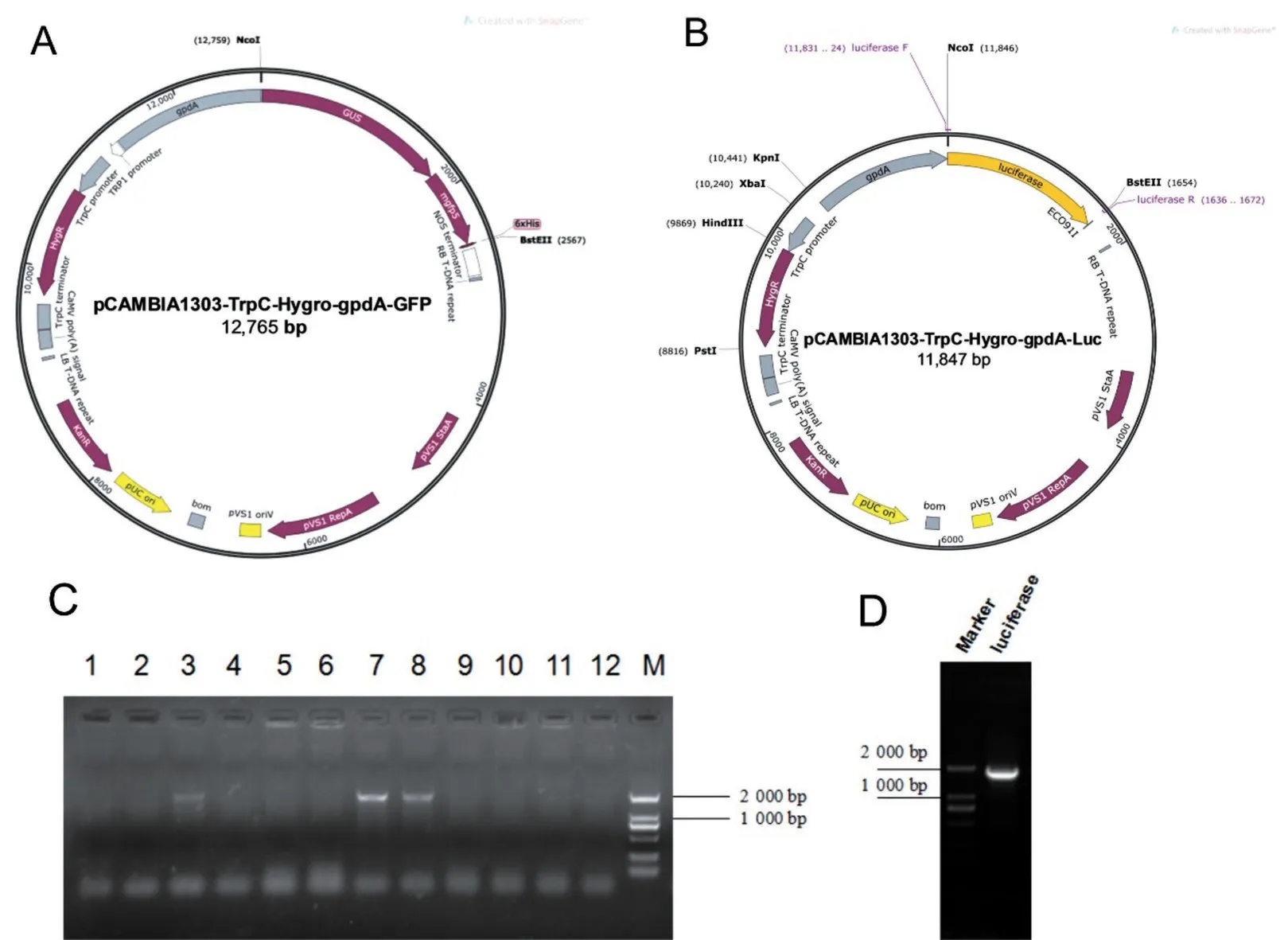
图1 Luc质粒和转化产物的构建与验证
2.2 TM标准株对潮霉素的敏感性筛选
在早期研究结果的基础上[12],本课题组摸索了TM标准株在含不同浓度的潮霉素培养基上的生长情况。结果显示TM 标准株在含有80 μg/mL 的潮霉素培养基上不生长,见图2。
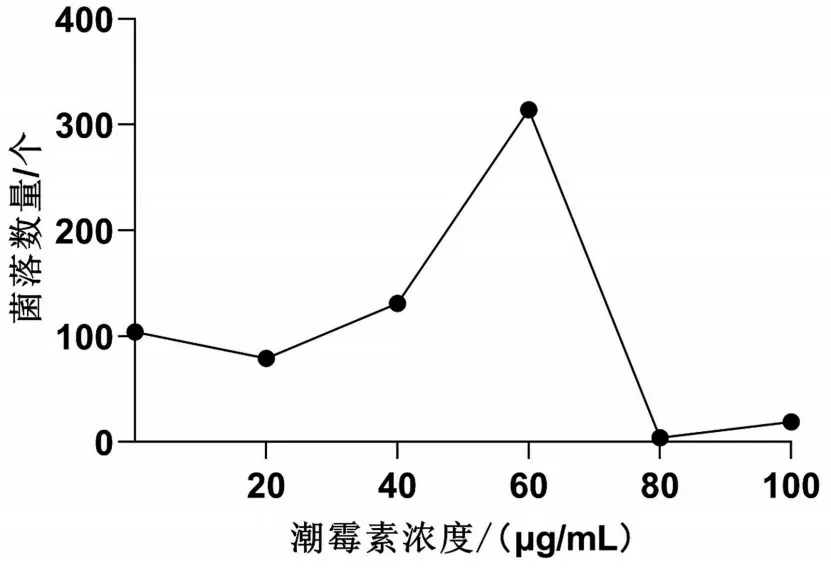
图2 潮霉素浓度对TM标准株的生长影响
2.3 农杆菌侵染TM标准株
通过ATMT 法将Luc 基因插入TM 标准株的基因组中,对转化子进行PCR 扩增和Luciferase 的检测,电泳结果在500~750 bp 之间出现条带(图3A);成像结果见图3B,在D-荧光素钾盐底物存在时,TM-Luc 可发出明显的荧光,证明TM-Luc 构建成功。
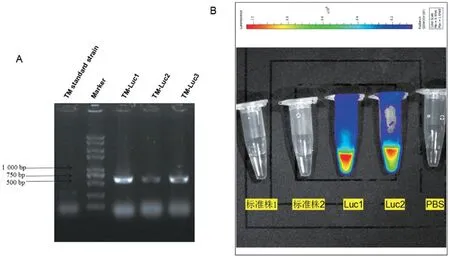
图3 TM-Luc的验证
2.4 TM-Luc 与TM 标准株生长形态与生长速率的对比
两种菌株分别放置于27°C 与37°C 培养箱培养,连续14 d记录菌落生长情况。二者在PDA培养基生长形态均为扁平绒毛状,可在菌落底部观察到特征性红色素扩散现象(图4A);在BHI培养基上呈深褐色,表面光滑(图4A)。培养14 d后,在PDA培养基中,TM 标准株生长直径为(6.54 ± 0.22)cm,TM-Luc 生长直径为(6.45 ± 0.23)cm,两者之间的生长曲线(P=0.273)与生长速率曲线(P=0.49)比较,差异均无统计学差异(图4B、图4C)。荧光显微镜下观察二者形态相似,均可发现经典的帚状枝形态(图4A)。
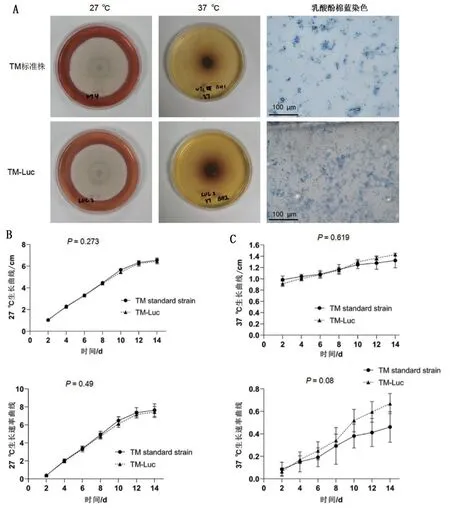
图4 TM标准株与TM-Luc生长情况
2.5 TM标准株与TM-Luc对THP-1巨噬细胞的影响
在比较了二者的生长情况后,本课题组探索了两种菌株对THP-1巨噬细胞的影响。TM标准株和TM-Luc 与THP-1 来源的巨噬细胞共培养后,检测24 h 和48 h 的炎症因子TNFA、IL1B和IL10的表达水平,差异无统计学意义(图5A);在细胞死亡的检测中,观察到TM-Luc 对于THP-1 巨噬细胞的杀伤稍少于TM 标准株(图5B),虽在48 h 时有差异,但随着时间延长,二者对细胞杀伤效果趋于一致。

图5 TM标准株与TM-Luc感染THP-1巨噬细胞
3 讨论
本研究采用ATMT 法将Luc 基因转入TM 的基因组,从而构建稳定转化的TM-Luc。农杆菌介导的转化法受体材料广泛,分生孢子、原生质体、菌丝体等材料都可进行遗传转化。相较于原生质体转化、脂质体转化等方法,ATMT 转化难度低、转化效率高、转化子遗传稳定高,并且T-DNA 随机整合至基因组,这些优点让ATMT广泛应用于动植物的真菌疾病病理研究中[13]。在TM基因组插入诱变的研究中,发现T-DNA在TM基因组的整合方式为随机整合,并且部分突变体表现出形态方面的异质性,如可溶性红色素产生缺陷、分生孢子较少甚至无分生孢子等现象[14]。这表明T-DNA 的插入可能会对宿主的基因组造成影响,从而影响宿主的形态或功能。
本课题组将农杆菌LB 与RB 序列间的T-DNA替换为Luc 基因,从而将Luc 基因整合至TM 基因组,因其在整合过程中的随机性,笔者针对TM-Luc与TM标准株之间的形态与部分功能特征进行了对比,结果发现TM-Luc 可产生特征性的可溶性红色素,并且菌落形态、生长直径等与TM 标准株无差异。TM-Luc 和TM 标准株与THP-1 来源的巨噬细胞共培养后,TNFA、IL10等炎症因子的表达趋势一致;在TM 杀伤巨噬细胞实验中,发现TM-Luc 对巨噬细胞的杀伤较弱于TM 标准株,在48 h 时差异具有统计学意义,而72 h时细胞死亡趋势趋于一致。
Luc 在动物活体成像领域的应用十分广泛,同一批次的动物可得到所有动物的横向实验数据,也可得到单个动物的纵向实验数据,避免了批次间的误差,实验数据更加真实。本研究构建的TM-Luc目前仅用于细胞感染模型的构建,和TM 标准株进行了部分形态与功能学特征进行了对比。后续将TM-Luc应用于动物感染模型的构建,可为TM的体内机制研究提供新的手段。
——一道江苏高考题的奥秘解读和拓展

