槲皮素抑制肠道病毒71型感染的机制研究*
张亚婷,陈静,张娟丽,徐丁
兰州大学第二医院,甘肃 兰州 730000
肠道病毒71型(enterovirus 71,EV71)是一种无包膜的单正链RNA病毒,属于小核糖核酸病毒科,是引起手足口病或疱疹性咽峡炎的主要病原体。自1967年在美国加利福尼亚州发现以来,在全球范围内EV71已引起数次大规模流行,重症病例多由其引起,且病情凶险,病死率高[1-2]。国内最严重的疫情发生在2010年,估计有170万人感染,其中27 000例合并严重的神经系统并发症,最终导致了905人死亡[3]。据统计,在国内因手足口病引起的死亡病例中,超过90%由EV71感染所致。随着EV-71灭活疫苗的使用,过去几年死亡率逐步下降。
目前尚无确切有效的治疗手足口病的药物[4],临床工作中,利巴韦林及Ⅰ型干扰素是最常用的用于治疗EV71感染的药物[5],此外,一些化合物,如Rupintrivir[6-7],在两种细胞系中均表现出抗EV71的活性,但临床应用尚不成熟。因此,研究有效的抗EV71病毒药物具有重要的临床意义。槲皮素是植物中分布最广的黄酮类化合物之一,目前多项研究已经证实其能够有效抑制多种逆转录病毒感染,如疱疹病毒Ⅰ型、呼吸道合胞病毒[8]、丙型肝炎病毒[9];此外,也有体外抑制乙型肝炎病毒、甲型流感病毒H1N1和人2型登革病毒感染的研究[10-12]。为此,本实验旨在研究槲皮素体外抗肠道病毒71的能力,并对其抗病毒机制进行探讨。
1 材料与方法
1.1 实验材料肠道病毒71型(C4亚型)(甘肃省疾病控制中心临床分离株);人横纹肌肉瘤细胞RD细 胞(Human rhabdomyosarcoma cells,RD细胞)(中科院上海细胞所),槲皮素(Sigma-Aldrich,批号:100081-201509),EV-A71 VP1抗体(台湾Abnova公司,批号:MAB5667-M03),Toll样受体7(Toll-Like Receptor 7,TLR-7)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,GAPDH)及半胱氨酸蛋白酶3(Caspase-3)抗体(均购自上海Cell Signaling Technology公司)。
1.2 主要实验仪器PCR仪(Takara公司);蛋白电泳仪,转膜仪(Bio-Rad)。
1.3 实验方法
1.3.1 TCID50测定病毒滴度将EV71病毒用细胞维持液从1×10-1~1×10-8做10倍系列稀释,每个稀释度设6个重复孔,将各稀释度的病毒液取100µL接种于细胞生长良好的单层RD细胞的96孔细胞培养板中,置37℃、5% CO2培养箱中,观察细胞病变程度并记录。用Reed-Muench法计算感染RD细胞中具有细胞病变效应(cytopathic effect,CPE)的孔数,计算半数组织培养感染剂量(tissue culture infective dose 50%,TCID50),即50%的细胞发生CPE时的病毒稀释度。
1.3.2 槲皮素药物毒性测定将槲皮素分别用细胞维持液稀释为100、50、25、12、6、3µM 6个浓度,然后分别加入RD细胞已长成单层的96孔细胞培养板中,每孔100µL,每一浓度设置3个复孔,同时设立正常细胞对照组,置37℃、5% CO2培养箱中培养,观察48 h,MTT法测定细胞活力,50%的细胞发生病变时的药物浓度为CC50。实验重复3次。
1.3.3 槲皮素抗病毒活性实验将处于对数生长期的RD细胞接种于96孔培养板上,37℃条件下用100 TCID50 EV71在槲皮素连续稀释液中感染细胞,直到达到适当的细胞病变效应,在显微镜下观察槲皮素对EV71诱导的CPE的影响,并记录细胞形态。MTT法测定细胞活力,能够有效抑制50%细胞感染病毒的药物浓度为EC50,SIs按CC50∶EC50比值计算。
1.3.4 槲皮素抗病毒CPE实验原理:被感染后细胞大多可引起细胞病变(感染细胞会出现变圆、坏死、破碎或者脱落),这与其他病毒的表现形式有所不同,无需染色便可直接在普通光学显微镜下观察。因此我们通过比较相同条件下的MOI病毒感染下实验组与对照组的细胞病变效应差异,便可直接看出槲皮素抗EV71病毒感染的能力。操作步骤:培养细胞在铺板后24 h感染相同MOI病毒,实验组加槲皮素,24 h后在镜下观察并拍照。
1.3.5 Western blot法检测EV71病毒蛋白VP1表达情况RD细胞铺于6孔细胞培养板,槲皮素预处理细胞2 h,接入病毒,培养24 h后,不同处理细胞样品进行电泳并转膜。加入一抗,4℃过夜,弃一抗,再加入辣根过氧化物酶标记的二抗于37℃条件下摇床孵育2 h,化学发光系统成像拍照分析。
1.3.6 RT-PCR法检测槲皮素对IL-6、IL-8及Caspase3的作用将不同实验组处理的六孔板细胞接入相同MOI的EV71病毒,培养24 h后,弃去上清,以PBS洗细胞1次,每孔加入1 mL Trizol裂解,抽提细胞总RNA,并反转录为cDNA。PCR运行程序为:95℃4 min,94℃45 s,58℃45 s,72℃1 min,35个循环,72℃10 min。将PCR扩增产物进行1%的琼脂糖凝胶电泳,溴化乙锭染色,UVP凝胶成像系统拍照。引物系列见表1。
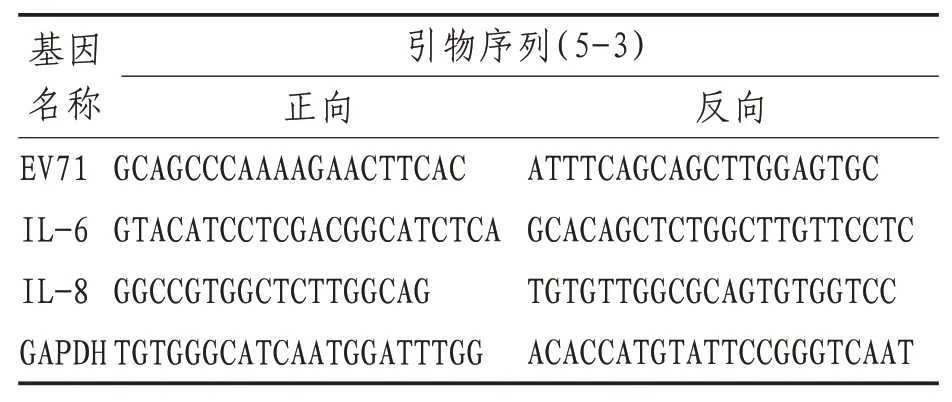
表1 引物序列
1.4 统计学方法数据分析采用SPSS 17.0软件包,计量资料以±s表示,采用t检验;计数资料以率表示,采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 槲皮素体外抗病毒能力实验
2.1.1 病毒毒力及槲皮素抑制病毒感染检测RD细胞感染EV71病毒48 h后,镜下观察,病毒组细胞形态与正常对照组比较,细胞变圆、萎缩、脱落,细胞间连接断裂甚或消失,出现细胞病变效应,进一步研究发现,相同MOI的EV71感染的RD细胞出现会明显的CPE,而槲皮素处理(20µM)能够明显抑制病毒诱导的CPE,见图1。
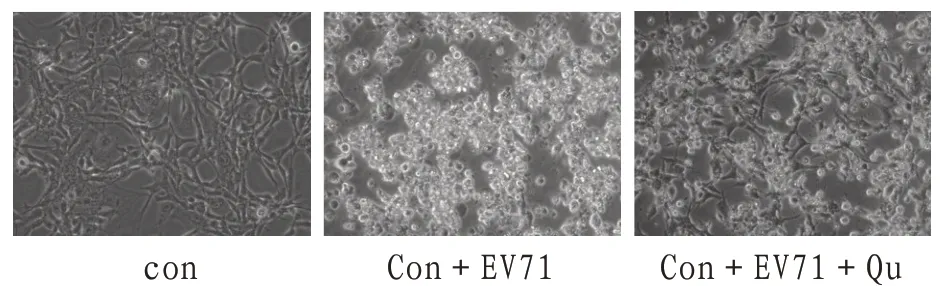
图1 光学显微镜下各组细胞形态(x200)
2.1.2 病毒毒力及槲皮素细胞毒性试验MTT法测定结果表明EV71对RD细胞的TCID50为10-4.5,槲皮素的细胞毒性效应通过细胞活力测定,结果表明,槲皮素对RD细胞具有较低的细胞毒性,MTT法检测细胞活力,见图2。并且在浓度达到100µM时未观察到明显的形态学细胞毒作用,50%细胞毒性浓度(CC50)值>100µM,同时发现槲皮素在10~25µM之间均能够有效抑制RD细胞感染EV71,在没有槲皮素的情况下,相同MOI的EV71感染的RD细胞出现明显的CPE,而槲皮素处理(12µM)能够明显抑制病毒诱导的CPE。
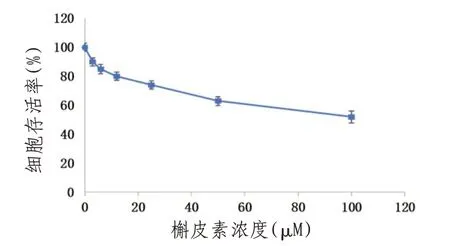
图2 MTT法检测不同处理组细胞活力
2.1.3 EV71病毒蛋白表达受槲皮素抑制情况将不同实验组[RD细胞组、RD+EV71组、RD+EV71+槲皮素组(5µM)、RD+EV71+槲皮素(10µM)及RD+EV71+槲皮素(20µM)],相同MOI病毒感染RD细胞,在槲皮素处理实验组中,病毒蛋白表达量明显低于其余组,并且槲皮素对于病毒抑制具有剂量依赖性,在20µM时EV71在细胞中的复制受到明显抑制,见图3。
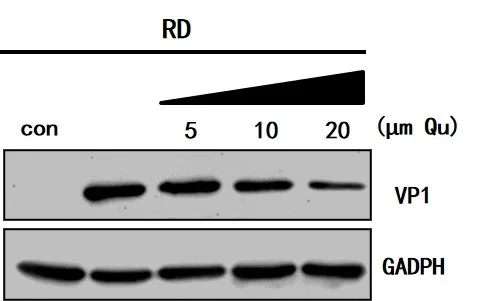
图3 Western blot检测病毒VP1蛋白电泳图
2.2 槲皮素抑制EV71机制研究
2.2.1 槲皮素对TLR-7(toll样受体7)表达的影响针对上述不同实验组,Western blot检测TLR-7表达水平,结果发现,EV71病毒感染可明显诱导TLR7蛋白表达,但槲皮素处理组不影响TLR7表达水平,见图4。
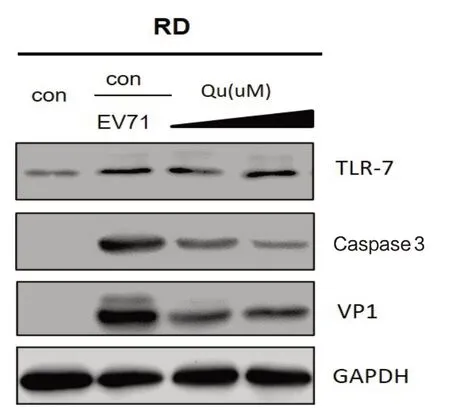
图4 槲皮素处理对TLR-7表达的影响
2.2.2 槲皮素处理对IL-6、IL-8及Caspase3的作用病毒产量及IL-6随着槲皮素浓度的增加而下降,提示槲皮素能够通过抑制TL-6诱导的细胞毒性效应,同时具有剂量依赖性,见图5。EV71感染组Caspase-3表达明显增高,而槲皮素处理组Caspase3表达水平受到抑制。
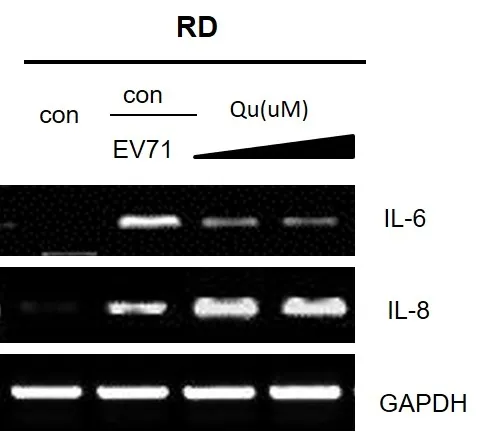
图5 EV71感染后槲皮素对IL-6及IL-8表达的影响
3 讨论
肠道病毒71型所致手足口病目前仍是世界各国,尤其是亚太地区的一个重要公共卫生问题,目前尚无有效治疗药物[13-14]。作为黄酮类化合物的重要组成-槲皮素,目前已有大量相关文献体外证实其具有显著抗病毒活性。然而,更进一步针对其药理特性及抗病毒机制的研究是非常必要的。本课题组体外实验证实,槲皮素50%细胞毒性浓度(CC50)值>100µM,EC50为15µM。这表明,治疗剂量的槲皮素不会显著抑制细胞生长,能有效抑制病毒感染,计算SI至少大于6,依据(SI)值≥4种被认为适用于抗病毒药物[8],表明槲皮素可以作为一种有效的抗EV71药物,其在治疗EV71感染方面具有潜在的应用价值。
先天免疫系统对病原微生物的快速识别及清除对于自身稳态的维持至关重要,固有免疫细胞绝大多数是通过细胞表面或者不同细胞内隔间表达的模式识别受体识别病毒的感染,这些模式识别受体包括Retinoic acid-inducible gene I(RIGI)样受体(RLRs),Toll样受体(TLRs),以及NOD样受体(NLRs)。TLR-7,该 基 因也被称为PYPAF3、NALP7、PAN7、NOD12、CLR19.4和HYDM,在人类19号染色体长臂q13.42位置,TLR7不仅在脑内的主要免疫细胞小胶质细胞中表达,而且神经元中也有表达[15]。尽管TLR7和TLR8都能识别单链RNA(ssRNA),但多项研究证实,TLR7是大脑中识别ssRNA的主要TLR[16]。针对其功能研究发现,TLR7在中枢神经系统的神经紊乱和炎症反应中起着多种作用,猴免疫缺陷病毒(SIV)感染恒河猴脑后,分泌的microRNA21激活TLR7通路,导致神经系统疾病[17];有学者研究发现,TLR7-MyD88-Caspase3轴在单链RNA病毒引起的神经系统炎症病变中发挥重要作用[18]。动物实验证实,TLR7-MyD88-c-Fos-IL-6信号通路能够在脑内负向调控树突状细胞的生长[16]。值得关注的是,2019年有学者通过体内体外试验提出,TLR7/IL-6/Caspase3凋亡轴在EV71感染发病机制中起重要作用[19]。
进一步研究发现,高水平的细胞因子,如IL-1、IL-6、IL-10等与肺水肿和神经系统损伤严重程度相关[20]。研究发现,IL-6是EV71相关性脑炎的独立预测因子,在EV71感染的发病机制中起重要作用[21]。与此同时,另外一项针对新生小鼠模型的研究显示,EV71感染后产生的持续高水平IL-6会导致严重的组织损伤,而在临床症状出现后给予抗IL-6中和抗体,可以极大地改善宿主的生存率和临床评分,因此,抗IL-6可作为EV71感染的潜在治疗候选者[22]。此外,目前已有大量研究证实,EV71感染后通过非结构性蛋白3C激活caspase-3,由此诱导的宿主细胞凋亡在其发病机制中起重要作用[23]。2018年有学者发现,抑制caspase-3的活性可以减弱3C引起的细胞凋亡,同时降低EV71病毒蛋白的表达,提示抑制caspase-3可作为一种潜在治疗手足口病的选择靶点来考虑[24-25]。
2021年,一项系统评价研究认为,补充槲皮素及其衍生物可以减少促炎症细胞因子、趋化因子、活性氧、黏液分泌等,可以作为治疗病毒性下呼吸道感染的候选药物[26]。此外,目前也有多篇文献从机制方面探讨槲皮素治疗新冠肺炎的意义,例如有研究认为,槲皮素能够抑制抑制3CLpro和PLpro的结合能分,槲皮素在理论上具有干扰SARS-CoV-2复制的能力[27]。针对EV71感染,研究认为,槲皮素能有效抑制EV71的3Cpro活性,从而阻断EV71的复制[28]。但须明确的是,如果要将槲皮素作为抗病毒药物使用,那更进一步地针对其药理特性和临床使用的研究是非常有必要的,且目前针对槲皮素体内研究尚处于初步阶段,缺乏长期体内研究的临床数据及相关部门的监管,而详细的药代动力学,药效学和长期毒理学研究亦是必要的。
本实验发现,EV71体外感染RD细胞可上调TLR-7表达水平,而槲皮素可以显著抑制IL-6及Caspase-3表达,体外实验证实具有明显的抗细胞凋亡作用,且细胞毒性较低,具有潜在的临床应用前景,有望用于EV71感染引起的手足口病的治疗。

