UHPLC-Q-Orbitrap MS/MS检测益生菌来源的3种吲哚衍生物
周冰洋, 吕嘉枥, 吴定燕, 张明新, 巨瑞, 王维波, 贾玮, 鲁曦
(陕西科技大学 食品与生物工程学院, 西安 710000)
0 引言
色氨酸是人体必需的氨基酸。膳食在生物体内仅有5%左右的色氨酸会被吸收利用[1], 相当比例未被吸收的色氨酸会被肠道微生物利用产生多种吲哚衍生物[2-5], 发挥调节宿主免疫、改变与宿主相互作用的功能[6]。罗伊氏乳杆菌(Lactobacillus reuteri, L.reuteri)作为一种益生菌, 广泛存在于哺乳动物的肠道中, 能够抑制肠道病原菌生长, 改善宿主肠道微环境[7]。
目前对吲哚衍生物检测方法的研究主要集中于植物来源[8]和细胞来源[9-10], 且目前检测吲哚衍生物的方法对样品前处理要求严格。微生物培养基成分复杂, 干扰物质较多且益生菌源吲哚衍生物产量较低。而UHPLC-Q-Orbitrap MS/MS将高选择性的四极杆与轨道离子阱高分辨准确质量数测量技术有机结合[11-12], 具有样品前处理净化能力要求低、高效、方便等优点[13]。
建立益生菌源吲哚衍生物定量方法, 不仅有助于益生菌菌株筛选, 也为进一步深入研究吲哚衍生物的生理功能和作用机制奠定基础[10,14-16]。本研究基于UPLC-Q-Orbitrap MS/MS, 建立能够同时检测益生菌(L.reuteri)培养上清液中吲哚-3-乳酸(ILA)、吲哚-3-乙酸(IAA)和吲哚-3-丁酸(IBA)的技术方法, 并对7株L.reuteri的吲哚衍生物表达量进行定量筛选。
1 材料与方法
1.1 材料与试剂
MRS肉汤培养基, 北京奥博星生物技术有限责任公司;M9培养基, 天津市科密欧化学试剂有限公司;色氨酸和吲哚-3-乳酸(纯度≥99%), 上海麦克林生化科技有限公司;无水硫酸钠, 天津市天力化学试剂有限公司;PBS, 中晖赫彩;吲哚-3-乙酸(纯度≥99%), MYM生物技术公司;吲哚-3-丁酸(纯度≥99%), 国药集团化学试剂公司;乙酸乙酯、甲醇、乙腈、醋酸铵(均为色谱纯), 美国Sigma公司。
1.2 仪器与设备
Q-Exactive超高效液相色谱—四极杆—静电场轨道离子阱串联质谱, 美国Thermo Fisher Scientific公司;配备Syringe自动取样器系统、电喷雾离子源;HC-3018R高速冷冻离心机, 安徽中科中佳科学仪器有限公司;VORTEX Genius 3型涡旋振荡器, 德国IKA公司;分析天平, 德国Sartorius BSA224S;DH-360恒温培养箱, 北京科伟永兴仪器有限公司;RE-2000B旋转蒸发仪, 上海亚荣生化仪器厂;Milli-Q Integral型纯水仪, 美国Millipore公司。
1.3 菌株
罗伊氏乳杆菌:L.reuteri GH211-4、L.reuteri GH319-13、L.reuteri GH812-16、L.reuteri GH812-17、L.reuteri GH329-22、L.reuteri DSM 17938和L.reuteri GH226-12均由陕西科技大学实验室保存。
1.4 方法
1.4.1 标准溶液的配制
用甲醇配制吲哚-3-乳酸、吲哚-3-乙酸和吲哚-3-丁酸的1 mg/mL混合标准品母液, 置于-20℃冰箱中保存。取一定量的混合标准品母液, 用改良M9培养基, 即M9培养基+0.6μmol/L色氨酸, 稀释成1000、500、100、20、4 ng/mL工作液。
1.4.2 色谱条件
色谱柱为Hypersil Gold C18反相色谱柱(100 mm×2.1 mm×1.7μm), 流动相A为10 mmol/L醋酸铵水, B为10 mmol/L醋酸铵和乙腈;进样体积为5μL, 流速为300μL/min, 柱温为30℃, 梯度洗脱程序如表1所示。

表1 液相色谱梯度洗脱程序
1.4.3 质谱条件
电喷雾离子源, 质量分析器为Orbitrap, 扫描模式采用正离子扫描模式, 数据依赖性扫描Full MSdd MS2, 喷雾电压3.5 kV。电喷雾电离源(ESI)参数为:鞘气体流量为40 arb;辅助气体流量为-10 arb;毛细管温度为320℃;全扫描和二级扫描分辨率分别为70 000和17 500;质量采集范围为m/z 100~1 500, 3种吲哚衍生物的具体质谱信息如表2所示。
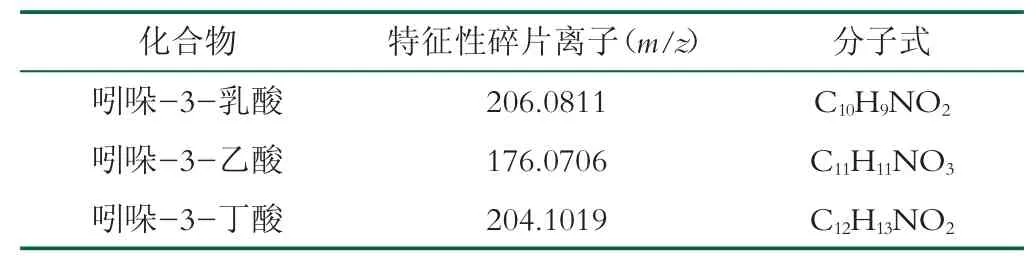
表2 3种吲哚衍生物的质谱信息
1.4.4 L.reuteri发酵上清中吲哚衍生物的检测
1.4.4.1 L.reuteri发酵上清液的培养
用一次性无菌接种环分别从MRS琼脂平板上挑取单个L.reuteri菌落接种到5 mL新鲜MRS肉汤培养基中, 37℃过夜厌氧培养, 将活化的L.reuteri菌液摇匀, 按1 %的接种量接种到5 mL MRS肉汤培养基37℃, 厌氧培养12 h后, 12 000 rpm离心5 min收集菌体, 用PBS洗涤菌体沉淀, 12 000 rpm离心5 min弃上清。将收集到的7株L.reuteri菌体沉淀2份分别添加到7管5 mL新鲜M9培养基和改良M9培养基(+0.6μmol/L色氨酸)中培养48 h, 12 000 rpm离心5 min取上清液待用。
1.4.4.2样品前处理
取L.reuteri发酵上清液5 mL, 加200μL的甲醇, 摇匀, 用PBS缓冲液调节pH至6-7。加入2.5 mL乙酸乙酯萃取, 剧烈震荡30 s, 静置3 min, 重复3次。收集乙酸乙酯层液体于15 mL离心管中, 加入少量无水硫酸钠干燥5 min, 氮气常温吹干, 用150μL甲醇复溶后上机检测。
1.4.4.3基于3种吲哚衍生物产量筛选L.reuteri
将所选7株L.reuteri分别在M9和改良M9培养基中厌氧培养, 经1.4.4.2前处理后上机检测, 利用超高效液相色谱-四极杆-静电场轨道离子阱串联质谱测定样品与标准品相同质荷比和保留时间的峰面积, 根据测定的标准曲线求得样品中3种吲哚衍生物的含量。基于3种吲哚衍生物的含量筛选出产量最高的L.reuteri。
2 结果与讨论
2.1 标准曲线及线性范围
将吲哚-3-乳酸、吲哚-3-乙酸和吲哚-3-丁酸的混合标准品1 000、500、100、20、4 ng/mL 5个工作液经1.4.4.2样品前处理后, 按照1.4中的色谱和质谱条件上机检测, 待测混合标准品中3个吲哚衍生物都可以有效分离。以纵坐标为标准品峰面积、横坐标为浓度(ng/mL)绘制标准曲线, 得到吲哚-3-乳酸、吲哚-3-乙酸和吲哚-3-丁酸的拟合线性方程。结果发现, 3种吲哚衍生物的标准曲线线性关系良好, 相关系数R2>0.99(图1~3、表3)。
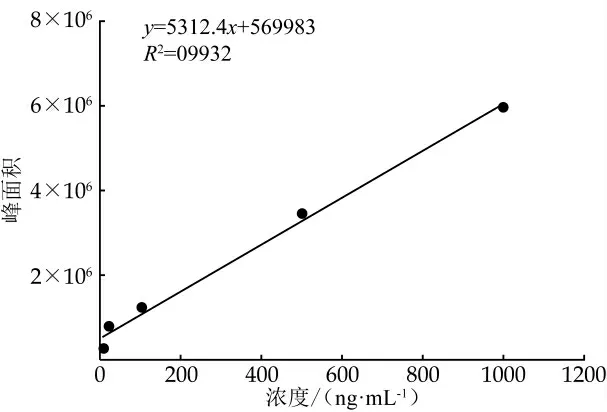
图1 吲哚-3-乳酸标准曲线
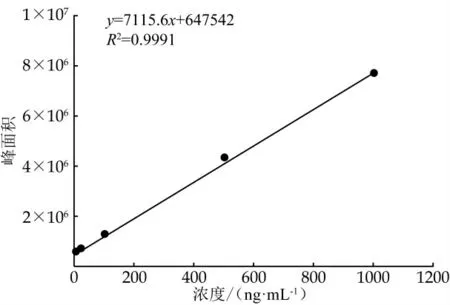
图2 吲哚-3-乙酸标准曲线

图3 吲哚-3-丁酸标准曲线
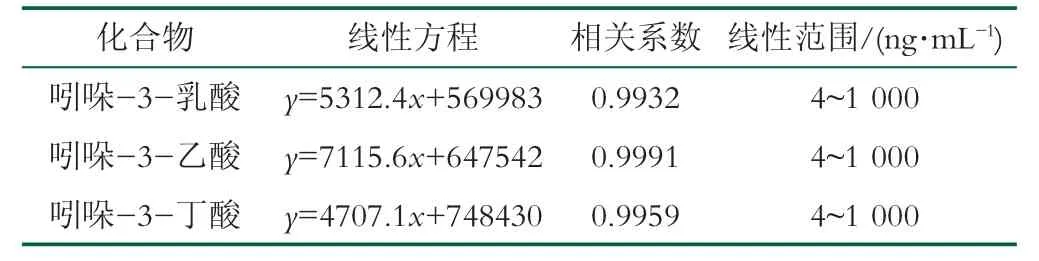
表3 吲哚-3-乳酸、吲哚-3-乙酸和吲哚-3-丁酸线性方程、相关系数及线性范围
2.2 方法检出限及定量限
本研究方法以信噪比(S/N)≥3的标准品浓度为检出限(Limits of detection,, LOD), 以信噪比(S/N)≥10的标准品浓度为定量限(Limits of quantitation, LOQ)。吲哚-3-丁酸的检出限和定量限最低分别为1.0和3.2 ng/mL, 其次是吲哚-3-乙酸分别是2.2和7.2 ng/mL, 吲哚-3-乳酸的检出限和定量限分别是2.4和8.0 ng/mL, 如表4所示。

表4 3种吲哚衍生物的检出限和定量限
2.3 方法准确度及精密度
在改良M9培养基中分别添加终浓度为500、100、20 ng/mL的吲哚-3-乳酸、吲哚-3-乙酸和吲哚-3-丁酸混合标准品溶液, 每个浓度设3个平行。将改良M9培养基及加标培养基, 按1.4.4.2前处理方法处理之后上机检测。如表5所示, 该方法测量回收率在90%~110%之间, 且相对标准偏差RSD<5%, 数据表明测量方法精确度良好。

表5 改良M9培养基加标回收率及相对标准偏差
2.4 样品测定
将L.reuteri GH211-4、L.reuteri GH319-13、L.reuteri GH812-16、L.reuteri GH812-17、L.reuteri GH329-22、L.reuteri DSM 17938、L.reuteri GH224-12等7株罗伊氏乳杆菌, 按照1.4.4方法制备L.reuteri发酵上清液, 对L.reuteri发酵上清液中吲哚-3-乳酸、吲哚-3-乙酸、吲哚-3-丁酸3种吲哚衍生物的含量进行测定。色谱图如图4~6所示:其中吲哚-3-乳酸、吲哚-3-乙酸和吲哚-3-丁酸的特征性碎片离子分别为m/z 206.0811[M+H]+、m/z 176.0706[M+H]+和m/z 204.1019[M+H]+。由特征性碎片离子峰面积定量得出的吲哚衍生物分析结果如表6所示。由表6可以看出, L.reuteri对色氨酸的代谢能力存在菌株差异, 而且外源色氨酸的添加可以显著增加L.reuteri发酵上清液中3种吲哚衍生物的含量。L.reuteri能够代谢色氨酸产生吲哚-3-乳酸, 这与Cervantes-Barragan等人[17]的研究结果一致, 而在培养基中外源添加色氨酸可以增加吲哚-3-乙酸等吲哚衍生物的产量, 与刘悦[10]等人的研究结果相一致。
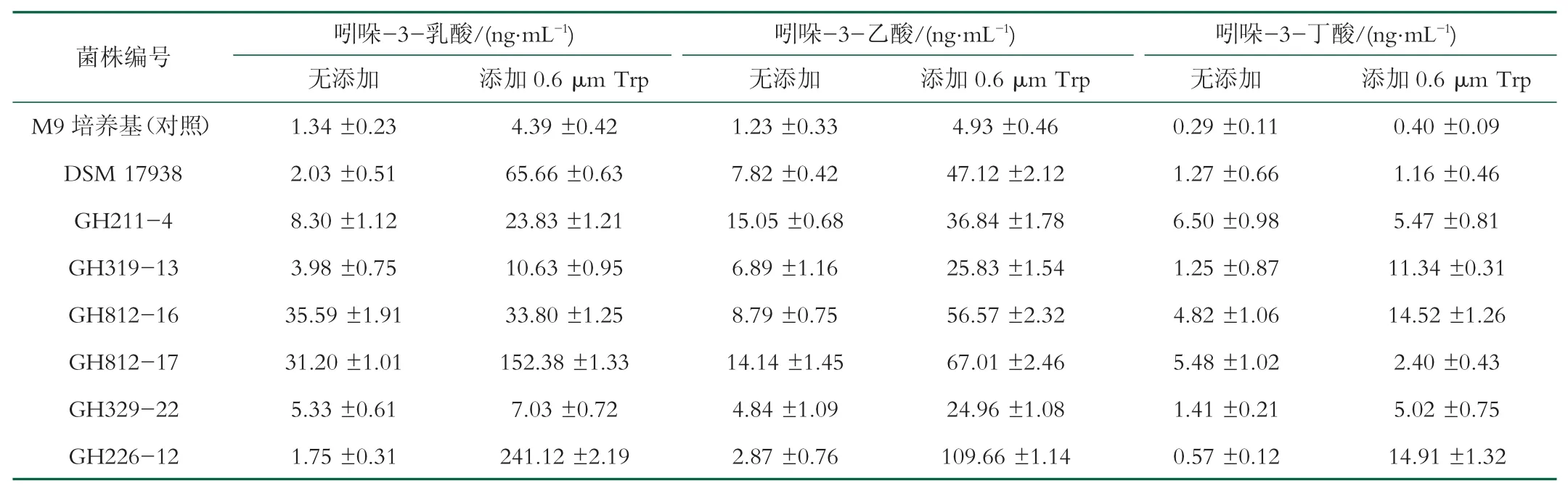
表6 不同L.reuteri菌株经过M9培养基是否外源添加色氨酸培养48 h后, 发酵上清液中吲哚-3-乳酸、吲哚-3-乙酸、吲哚-3-丁酸的含量
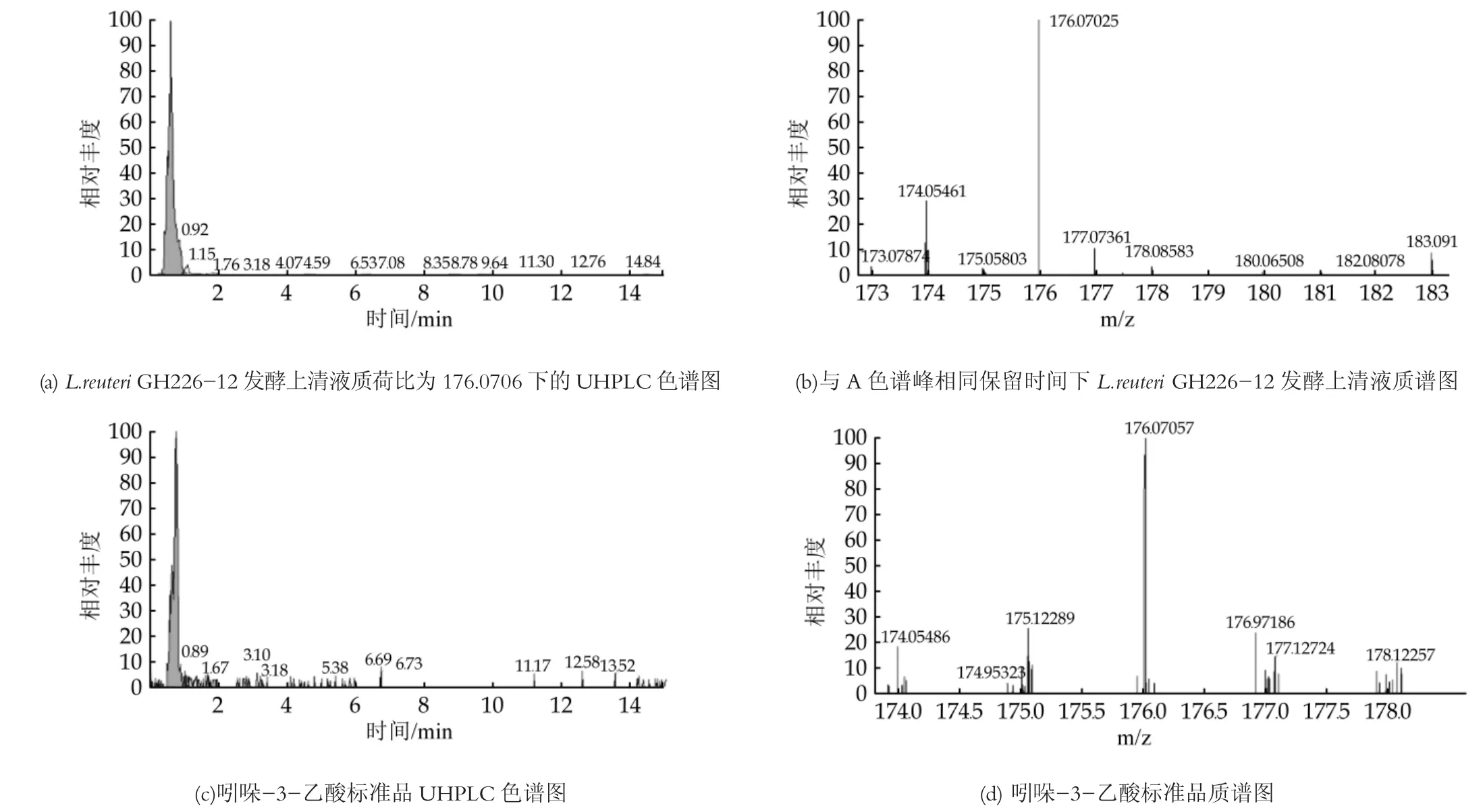
图5 UHPLC-Q-Orbitrap MS/MS分析L.reuteri GH226-12发酵上清液和吲哚-3-乙酸标准品检测结果
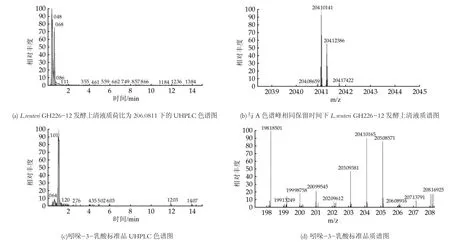
图6 UHPLC-Q-Orbitrap MS/MS分析L.reuteri GH226-12发酵上清液和吲哚-3-丁酸标准品检测结果
2.5 基于3种吲哚衍生物的产量L.reuteri菌株的筛选
根据表6结果显示, 在外源添加0.6μmol/L色氨酸后, 各株菌株吲哚衍生物产量都发生显著提高, 其中GH226-12号样品中3种吲哚衍生物浓度均显著高于其它组, 其中吲哚-3-乳酸浓度为241.12±2.19 ng/mL、吲哚-3-乙酸为109.66±1.14 ng/mL、吲哚-3-丁酸为14.91±1.32 ng/mL。以上数据提示, GH226-12号菌株为此次备选的7株L.reuteri中3种吲哚衍生物产量最高的一株。L.reuteri作为人体肠道中广泛存在的一种益生菌, 产生的吲哚衍生物具有抗炎作用[18]、调节宿主免疫、改善肠上皮屏障等多种益生功能。因此, 筛选出得到的吲哚衍生物产量高的L.reuteri可作为一种潜在的食物干预手段为炎症性肠病的治疗提供新思路。
3 结论
由于微生物培养基成分复杂, 干扰物质较多且吲哚衍生物产量较低, 如Cervantes-Barragan等人的研究采用1 L的益生菌发酵上清液来浓缩检测[16], 而本研究建立的样品前处理方法只需要5 mL上清液。上清液经简单的离心处理, 然后用乙酸乙酯萃取、浓缩, 即可用于UHPLC-Q-Orbitrap MS/MS检测。因此, 所建立的方法具有样品用量少, 操作流程方便、快捷的优点。其次, 该方法回收率高, 精确度高、重现性好。而基于超高效液相色谱-四极杆-静电场轨道离子阱串联质谱技术, 成功建立了益生菌发酵上清液中吲哚-3-乳酸、吲哚-3-乙酸和吲哚-3-丁酸3种吲哚衍生物的检测方法。该方法R2>0.99、线性范围4~1 000 ng/mL、回收率在90%~110%之间, 且相对标准偏差在5%以内;利用该方法, 成功筛选出1株高产吲哚衍生物的罗伊氏乳杆菌, 为吲哚衍生物益生功能的研究和益生菌产品的开发奠定了技术基础。

