超声引导甲状腺肿瘤微波消融术后肿瘤区远期组织修复及血供状况的临床研究
韩江涛,刘纪蓉,鹿文静,卿建兵,高艳颖,朱 欣
(1. 宜宾市第一人民医院超声科,四川 宜宾 644000 ;2. 川北医学院,四川 南充 637000)
微波消融技术对具有消融指征的甲状腺良恶性肿瘤的治疗已在国内大力开展[1-2]。超声引导甲状腺微波消融即是在超声引导下对病灶进行微波热消融,从而导致其坏死,但消融后坏死组织仍位于肿瘤区。随着术后时间的延长,消融区组织将会呈现不同的超声改变。目前临床上关于此手术近期疗效的研究较多[3-4],对消融区远期情况的研究较少。在本文中,笔者主要是探讨超声引导甲状腺肿瘤微波消融术后肿瘤区远期组织的修复及血供状况。
1 资料与方法
1.1 一般资料
选取2016 年1 月至2019 年1 月在宜宾市第一人民医院经病理证实的甲状腺肿瘤23 例于微波消融术后约半年到2 年内进行消融区常规超声复查、活检及超声造影。其中,男9 例,女14 例;年龄30 ~55 岁,中位数年龄42.5 岁。
1.1.1 病例纳入标准 具有消融指征的甲状腺腺瘤,生长速度较快,最大径1 ~4 cm;乳头状癌,最大径小于或等于1 cm 且未见异常淋巴结(特别是6、7 区)。
1.1.2 病例排除标准 有消融禁忌证、严重肝肾功能损害、严重出血倾向、冠心病心肌梗死、病灶过大且靠近大血管等重要结构、恶性病灶大于1 cm 或有淋巴结转移者。
1.2 治疗和检测方法
1.2.1 超声引导甲状腺肿瘤消融治疗 对于符合消融指征的甲状腺肿瘤,先在彩超引导下向病灶周围注入生理盐水,以隔离保护病灶周围正常组织。再将微波消融针准确穿入病灶,对病灶较大者由深到浅移动式逐次全面消融,微波消融治疗采用南京亿高微波消融仪,设置为连续模式,微波发射源距针尖约3.5 mm,微波向后辐射。设定功率30 W,采用脚踏控制(也可设定20 s 后自动断开电源)。采用模式2,打开水循环冷却系统, 累计消融时间约1 ~3 分钟。消融至肿瘤区呈强回声改变。
1.2.2 肿瘤消融区远期组织检测 消融术后半年到2年内使用西门子S2000-Helx 彩超、9L4 线阵探头进行常规彩超检查,并进行细针活检及超声造影。嘱患者取头部过伸仰卧位,详细探查其甲状腺消融区病灶,在二维图像上清楚显示消融区大小、位置、形态、边界、内部回声情况,采用彩色多普勒技术检测消融区及周边血流信号。制作细针针吸消融区细胞涂片,用无水乙醇固定后送检。以团注的方式经肘正中静脉注射SonoVue 混悬液(Braceo 公司)2.4 mL,启动造影程序并行定量分析,观察时间约3 min。观察消融区造影剂的充盈情况,在SonoLiver CPS 定量分析软件中将消融区及周围正常甲状腺组织设为感兴趣区,测定Peak、TP、AUC、MTT,均测定5 次,求其平均值。
1.3 统计学方法
采用SPSS 22.0 软件进行数据分析,超声造影参数Peak、TP、AUC、MTT 等计量资料用均数± 标准差(±s)表示,采用t检验,计数资料用百分比(%)表示,采用χ²检验。P<0.05 为差异有统计学意义。
2 结果
2.1 术后远期肿瘤消融区与周围正常组织时间强度曲线造影参数的比较
在术后远期,肿瘤消融区的Peak、TP、AUC、MTT 分 别 为(8.20±0.81)%、(47.88±3.81)s、(528.43±87.56)%s、(59.50±6.50)s,周围正常区的Peak、TP、AUC、MTT 分 别 为(8.21±0.76)%、(48.02±3.65)s、(527.13±56.23)%s、(59.51±7.02)s。术后远期肿瘤消融区与周围正常区的Peak、TP、AUC、MTT 相比,差异无统计学意义(t=-0.019、-0.121、0.06、-0.05,P>0.05)。详见表1。
表1 术后远期肿瘤消融区与周围正常组织时间强度曲线造影参数的比较(± s)

表1 术后远期肿瘤消融区与周围正常组织时间强度曲线造影参数的比较(± s)
造影区 例数 Peak(%) TP (s) AUC(%s) MTT(s)肿瘤消融区 23 8.20±0.81 47.88±3.81 528.43±87.56 59.50±6.50周围正常区 23 8.21±0.76 48.02±3.65 527.13±56.23 59.51±7.02
2.2 常规彩超检查
甲状腺肿瘤消融区术后远期(半年至两年)常规彩超与周围正常甲状腺组织回声高度相近,且分界不清,如下图。
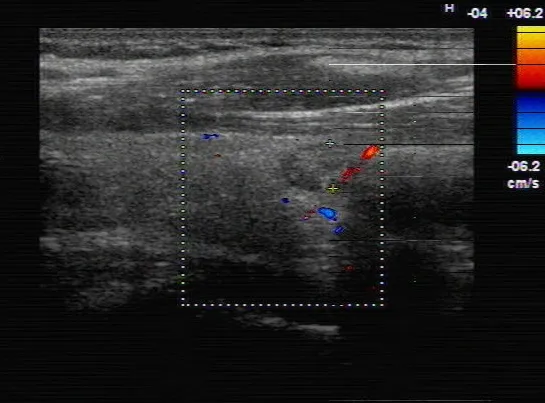
图1 消融术前甲状腺左叶TPC

图2 甲状腺左叶TPC 消融术
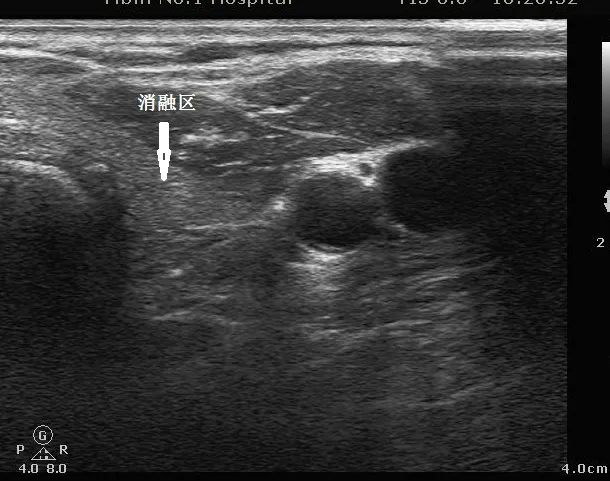
图3 术后消融区远期常规超声
2.3 活检
消融术后远期消融区针吸活检可见正常的甲状腺滤泡上皮细胞(follicular epithelial cell,FEC),如图4。
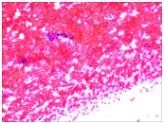
图4 消融区远期针吸细胞病理
2.4 术后远期消融区超声造影
术后远期消融区超声造影显示,肿瘤区的造影剂充盈情况与周围正常组织无明显差异,如图5,造影时间强度曲线如图6。

图5 消融区远期超声造影

图6 消融区远期超声造影参数
3 讨论
随着高清晰彩超的发展,越来越多的甲状腺疾病被发现。甲状腺肿瘤(结节)是常见病、多发病,其中良性肿瘤多为甲状腺腺瘤,恶性肿瘤多为乳头状癌,约占5%[5-7]。有研究指出,在针吸细胞学(FNAB)诊断为良性肿瘤的甲状腺实性结节患者中,手术切除病理结果为恶性者约占6%[8],故对于临床和影像学检查可疑恶性的甲状腺肿瘤(结节),即使FNAB 诊断为良性病变仍应积极治疗[9]。另外,对一些生长迅速、易引起局部压迫症状的甲状腺肿瘤或不能排除潜在恶性的甲状腺肿瘤也要及时处理[10]。目前,甲状腺肿瘤的治疗趋向于微创化,其中对恶性肿瘤的治疗越来越备受关注[11-12]。对于生长速度较快、小于4 cm的甲状腺良性结节和良性肿瘤、怀疑恶性而小于1 cm的单发且无淋巴结肿大无外周侵犯或转移的甲状腺肿瘤、术后残留或转移的肿块及淋巴结,临床上应对其进行微波消融[13-14]。对邻近气管、食管、动脉、喉返神经、喉上神经、甲状旁腺等重要结构的甲状腺肿瘤进行液体隔离(hydro-dissection)可有效减少术后并发症的发生。甲状腺肿瘤微波消融既能有效去除肿瘤,又可最大限度减少并发症,且能保持颈部美观。这一微创技术的近期疗效较为理想[15]。有研究指出,甲状腺肿瘤微波消融后近期偶可出现疼痛、一过性声音嘶哑、一过性甲功异常等并发症。目前,临床上对甲状腺肿瘤微波消融后远期疗效、消融区远期组织修复及血供情况的研究文献相对较少。对甲状腺肿瘤微波消融术后消融区的评估主要通过常规彩超、穿刺活检[16-17]和超声造影[18-19]。常规彩超可扫查肿瘤消融区的二维改变、回声是否均匀、与周围正常甲状腺组织的回声是否一致。穿刺活检可得到消融区组织的病理结果,可区分坏死组织、纤维组织与修复后的正常甲状腺组织。常规彩超可以检查消融区的血流信号(即血供状况),但超声造影可更全面地反映组织的血液灌注。造影相关参数(如TP、Peak、AUC、MTT)可精确量化组织的血液供应。肿瘤区消融术后即刻呈强回声改变,超声造影时无造影剂进入,表现为黑洞征,粗针活检为消融坏死组织。随着消融术后时间的延长,消融区范围逐渐缩小,回声逐渐变低并接近周围正常甲状腺组织,术后远期(大约在术后半年到两年内)消融区坏死组织会逐渐吸收。对于病灶较大的消融区常规超声偶可表现为回声欠均匀,但随着时间的再延长,其最终超声表现与周围正常甲状腺组织无明显差异, 很少出现因消融区较大致吸收不全而液化形成脓肿的情况;针吸活检可见正常甲状腺滤泡上皮或少许增生的滤泡上皮细胞;超声造影可见造影剂进入并与周围正常甲状腺组织造影时间强度曲线的TP、Peak、AUC、MTT 无统计学差异。微波消融与传统外科手术相比具有创伤小、患者恢复快的优点,可被认为是符合患者利益的建设性治疗模式,由于产生的能量高,用于较大体积甲状腺肿瘤治疗时,疗效同样可靠[20-21]。由于本研究病例数相对较少,对消融区远期组织的修复尚不能充分显示。有文献表明,射频消融时部分患者会出现术中颈部疼痛及耳根、牙齿放射痛[22],少数患者即使进行液体隔离,仍有可能出现喉返神经损伤的表现[23], 本组病例中也有因并发症的不适等原因而术后拒绝活检者。有研究指出,超声引导甲状腺肿瘤微波消融术有望成为甲状腺良性肿瘤(结节)、早期恶性及术后复发肿瘤的一线治疗方案[24-26]。
综上所述,有消融指征的甲状腺肿瘤患者进行超声引导甲状腺肿瘤微波消融术后其肿瘤区远期组织的修复及血供状况良好。

