miR-126-3p靶向AKT2对葡萄膜黑色素瘤细胞增殖、迁移、侵袭的影响
王玉风 乔建治 梁莉
(南阳医学高等专科学校第一附属医院眼科,河南 南阳 473000)
葡萄膜黑色素瘤是眼部疾病中常见的原发性恶性肿瘤,其具高发病率与高死亡率的特点,临床采用手术摘除眼球的方法进行治疗,但患者预后较差〔1,2〕。微小RNA(miRNA)属于非编码单链RNA,在葡萄膜黑色素瘤中一些miRNA发挥抑癌或促癌作用,对肿瘤细胞增殖、迁移等有影响〔3,4〕。微小RNA-126-3p(miR-126-3p)在梭形细胞型与上皮细胞型葡萄膜黑色素瘤组织中表达下调,但关于其具体作用机制尚未可知〔5〕。靶基因网站TargetScan预测显示丝氨酸/苏氨酸蛋白激酶(AKT)2可能是miR-126-3p的靶基因,研究表明AKT2在胃癌组织中的表达水平升高〔6,7〕。但miR-126-3p与AKT2在葡萄膜黑色素瘤中的调控机制尚未可知。本研究主要探讨miR-126-3p可能通过靶向AKT2影响葡萄膜黑色素瘤细胞的生物学行为。
1 材料与方法
1.1材料与试剂 葡萄膜黑色素瘤细胞MUM2B购自美国ATCC公司;miR-126-3p、miR-NC、si-AKT2、si-NC均购自广州锐博;山羊抗兔二抗购自武汉艾美捷;miR-126-3p及anti-miR-NC购自上海吉玛;DMEM、胎牛血清购自美国Gibco公司;兔抗人AKT2、细胞周期蛋白(Cyclin)D1、基质金属蛋白酶(MMP)-2、P21、上皮型钙黏蛋白(E-cadherin)购自美国Santa Cruz公司;Transwell小室购自美国Corning公司;基质胶购自美国BD公司;反转录试剂盒与SYBR Green试剂盒购自北京天根生化;MTT购自美国Sigma公司;Trizol试剂、Lipofectamine2000购自美国Invitrogen公司。
组织标本来源:收集南阳医学高等专科学校第一附属医院2016年8月至2018年5月24例确诊原发性人葡萄膜黑色素瘤患者,男15例,女9例,年龄为30~65岁,平均年龄为(48.57±6.57)岁;同时取同期医院收治的因外伤需摘除眼球的患者15例为对照,受试人员眼部组织均为正常葡萄膜组织,其中男8例,女7例,平均年龄为(50.42±7.73)岁,年龄为32~65岁。本研究经医院伦理委员会批准。
1.2方法
1.2.1细胞转染及分组 将对数期MUM2B细胞接种于6孔板,分为miR-NC组(转染miR-NC)、anti-miR-NC组(转染anti-miR-NC)、miR-126-3p组(转染miR-126-3p mimics)、anti-miR-126-3p组(转染anti-miR-126-3p)、si-NC组(转染si-NC)、si-AKT2组(转染si-AKT2)、miR-126-3p+pcDNA3.1组(共转染miR-126-3p mimics与pcDNA3.1)、miR-126-3p+pcDNA3.1-AKT2组(共转染miR-126-3p mimics与pcDNA3.1-AKT2),继续培养48 h,收集细胞。
1.2.2qRT-PCR检测细胞中miR-126-3p的表达水平 用Trizol法提取组织及MUM2B细胞中总RNA,反转录合成cDNA后,进行PCR扩增反应。miR-126-3p以U6为内参,采用2-ΔΔCt法计算miR-126-3p相对表达量。
1.2.3MTT检测细胞增殖 各组MUM2B细胞接种96孔板,加MTT溶液20 μl/孔,继续培养4 h,孔内加150 μl二甲基亚砜(DMSO),酶标仪检测各孔吸光度值,计算细胞存活率。
1.2.4平板克隆形成实验 取对数生长期MUM2B细胞接种于48孔板,按照“1.2.1”分组,每组设置3个复孔,各组转染48 h时,弃旧培养基,磷酸盐缓冲液(PBS)洗涤,依次加入消化液与培养液制备细胞悬液(3×104个/ml),取细胞悬液接种于12孔板(100个/孔),每3 d更换一次培养液,观察克隆细胞形成数。
1.2.5Transwell实验检测细胞迁移与侵袭 侵袭实验:用预冷培养液(8∶1比例)稀释基质胶,取在Transwell上室加40 μl稀释液,下室加含血清培养液600 μl,培养24 h,多聚甲醛固定20 min,0.1%结晶紫染色20 min,显微镜下观察侵袭细胞数。迁移实验:Transwell上室内不加基质胶,后续实验步骤同侵袭实验。
1.2.6双荧光素酶报告基因检测 TargetScan预测AKT2与miR-126-3p存在互补序列,将AKT2-3′UTR插入荧光素酶报告基因载体,构建野生型报告质粒WT-AKT2、突变型报告质粒MUT-AKT2。取生长期MUM2B细胞,将MUT-AKT2、WT-AKT2与miR-NC或miR-126-3p共转染。转染24 h,检测细胞相对荧光素酶活性。
1.2.7Western印迹检测AKT2、CyclinD1、MMP-2、P21、E-cadherin蛋白表达 加入RIPA裂解液到细胞,提取细胞总蛋白,测定蛋白浓度用BCA法,十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离,转膜,封闭,加一抗稀释液AKT2(1∶800)、CyclinD1(1∶1 000)、MMP-2(1∶1 000)、P21(1∶1 000)、E-cadherin(1∶800),4℃孵育24 h,二抗稀释液(1∶2 000),室温孵育1 h,加电化学发光(ECL)显影。应用ImageJ软件分析各蛋白条带灰度值。
1.3统计学处理 采用SPSS21.0软件进行独立样本t检验、单因素方差分析。
2 结 果
2.1正常葡萄膜组织和葡萄膜黑色素瘤组织中miR-126-3p表达 与正常葡萄膜组织比较,葡萄膜黑色素瘤组织中miR-126-3p表达显著降低(1.01±0.10 vs 0.20±0.02,t=38.754,P<0.001)。
2.2过表达miR-126-3p对MUM2B细胞增殖、迁移及侵袭的影响 miR-126-3p组细胞存活、克隆数、迁移、侵袭细胞数、CyclinD1、MMP-2蛋白表达明显低于miR-NC组(P<0.05),P21、E-cadherin蛋白表达均明显高于miR-NC组(P<0.05),见图1~3、表1。

图1 过表达miR-126-3p对MUM2B细胞克隆形成的影响
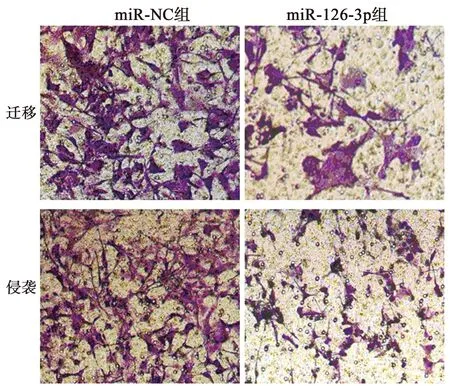
图2 过表达miR-126-3p对MUM2B细胞迁移、 侵袭的影响(×200,结晶紫染色)
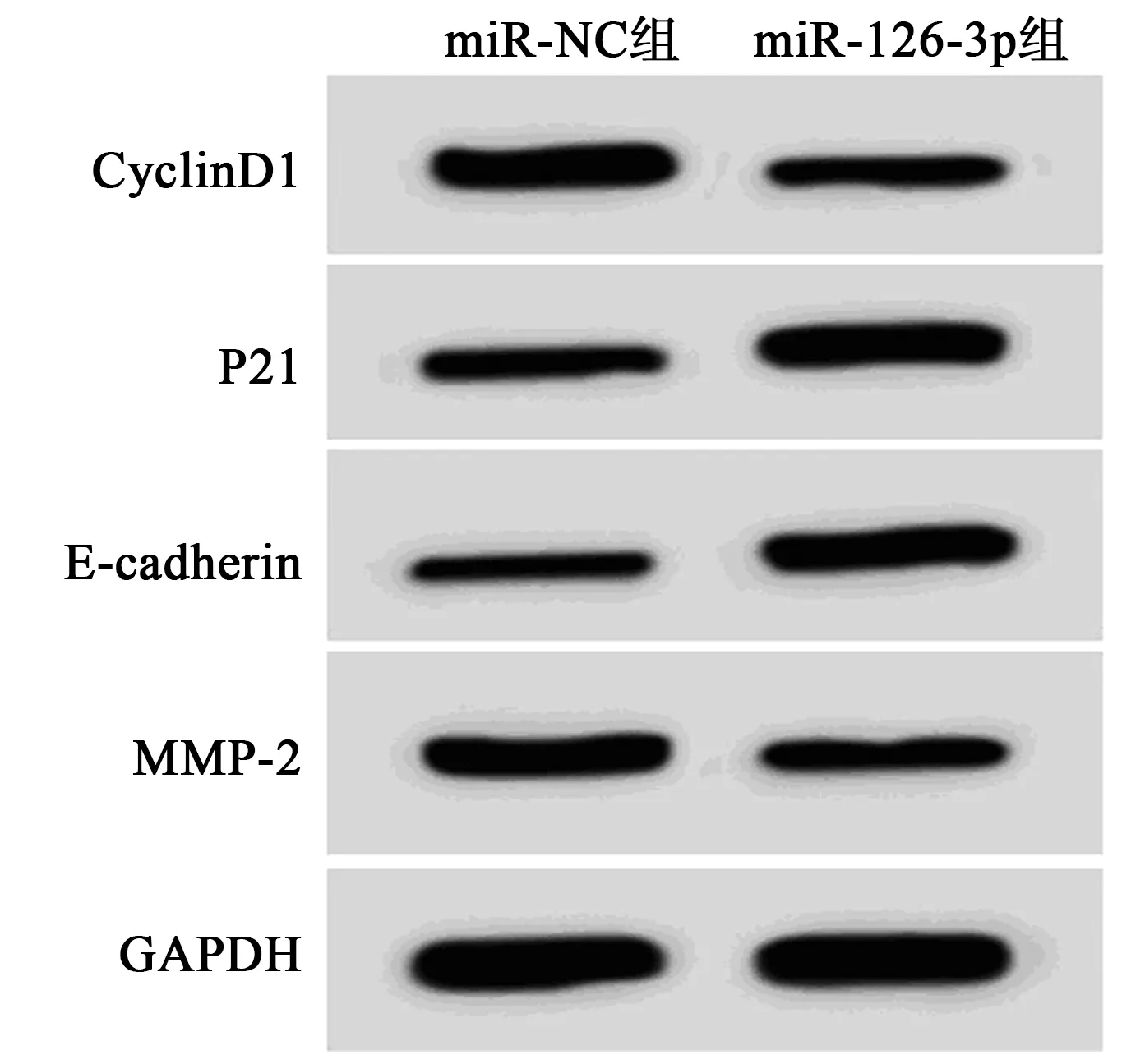
图3 过表达miR-126-3p对MUM2B细胞增殖、 迁移、侵袭蛋白表达的影响
表1 过表达miR-126-3p对细胞MUM2B增殖、迁移、侵袭的影响
2.3miR-126-3p靶向、调控AKT2 TargetScan预测显示AKT2的3′UTR含有miR-126-3p的互补序列,见图4A。与miR-NC组相比,miR-126-3p组WT-AKT2荧光素酶活性显著降低,见表2。与anti-miR-NC组相比,anti-miR-126-3p组AKT2蛋白表达显著升高(0.65±0.06 vs 1.07±0.11,P<0.05);与miR-NC组相比,miR-126-3p组AKT2蛋白表达显著降低(0.66±0.07 vs 0.23±0.02,P<0.05),见图4B。
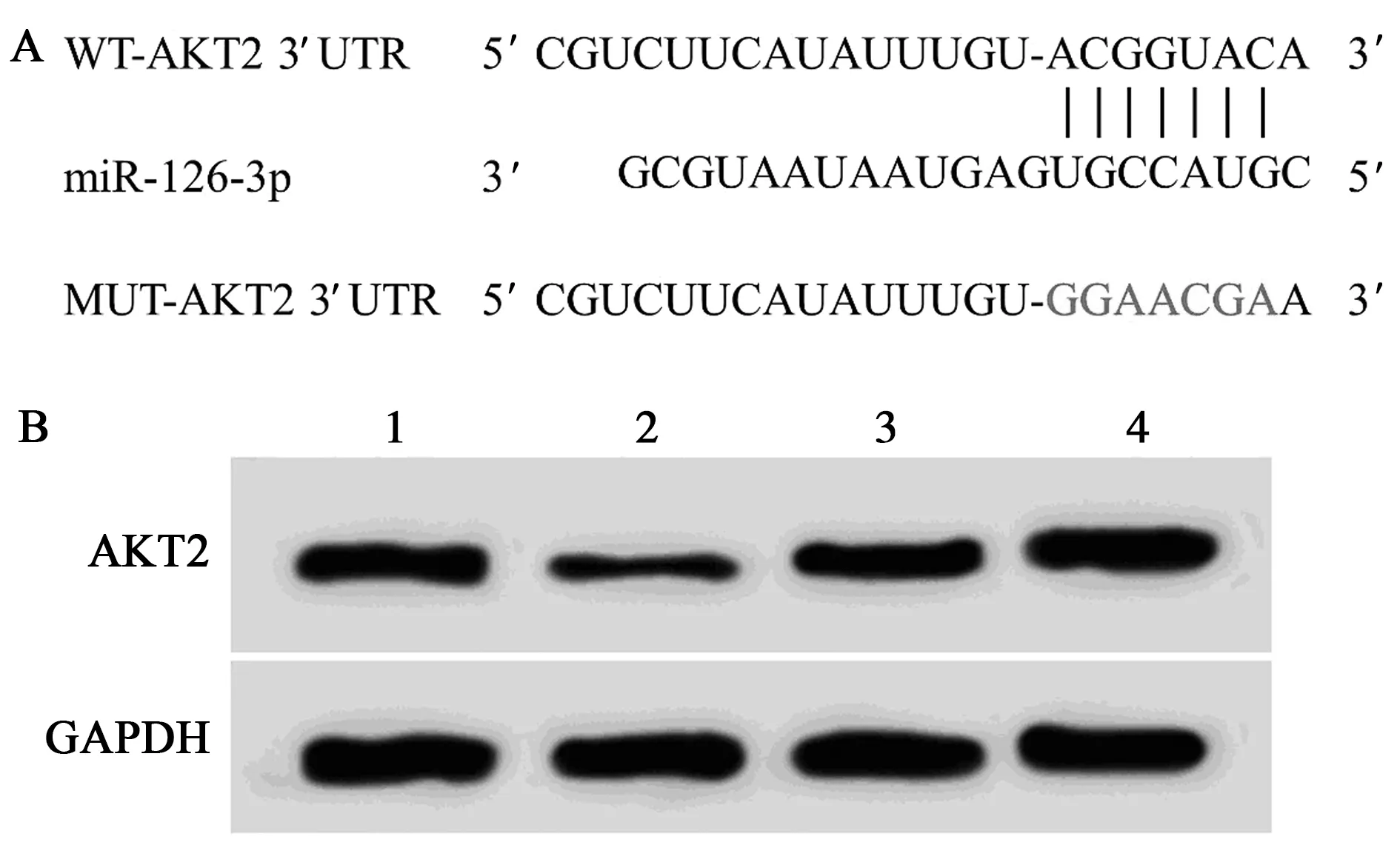
A:AKT2与miR-126-3p的互补序列;B:miR-126-3p调控AKT2的表达;1~4:miR-NC组,miR-126-3p组,anti-miR-NC组,anti-miR-126-3p组图4 miR-126-3p靶向调控AKT2
2.4抑制AKT2对MUM2B细胞增殖、迁移、侵袭的影响 si-AKT2组细胞存活率、克隆数、迁移、侵袭细胞数、CyclinD1、MMP-2蛋白表达明显低于si-NC组(P<0.05),P21、E-cadherin蛋白表达明显高于si-NC组(P<0.05),图5、表3。
表2 双荧光素酶报告实验
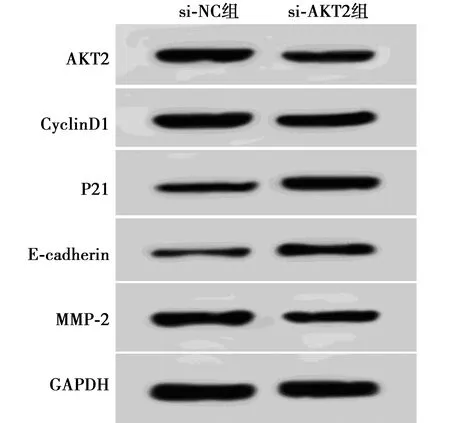
图5 抑制AKT2对MUM2B细胞增殖、迁移、 侵袭蛋白表达的影响
2.5过表达AKT2能逆转miR-126-3p对MUM2B细胞增殖的影响 miR-126-3p+pcDNA3.1-AKT2组中AKT2蛋白表达、细胞存活率、克隆数、CyclinD1蛋白表达明显高于miR-126-3p+pcDNA3.1组(P<0.05),P21蛋白表达明显低于miR-126-3p+pcDNA3.1组(P<0.05),表4、图6。
表3 抑制AKT2对MUM2B细胞增殖、迁移、侵袭的影响
2.6过表达AKT2能逆转miR-126-3p对MUM2B细胞迁移、侵袭的影响 miR-126-3p+pcDNA3.1-AKT2组迁移、侵袭细胞数、MMP-2蛋白表达明显高于(P<0.05),E-cadherin蛋白表达明显低于miR-126-3p+pcDNA3.1组(P<0.05),图7、表5。
表4 过表达AKT2能逆转miR-126-3p对细胞MUM2B增殖的影响
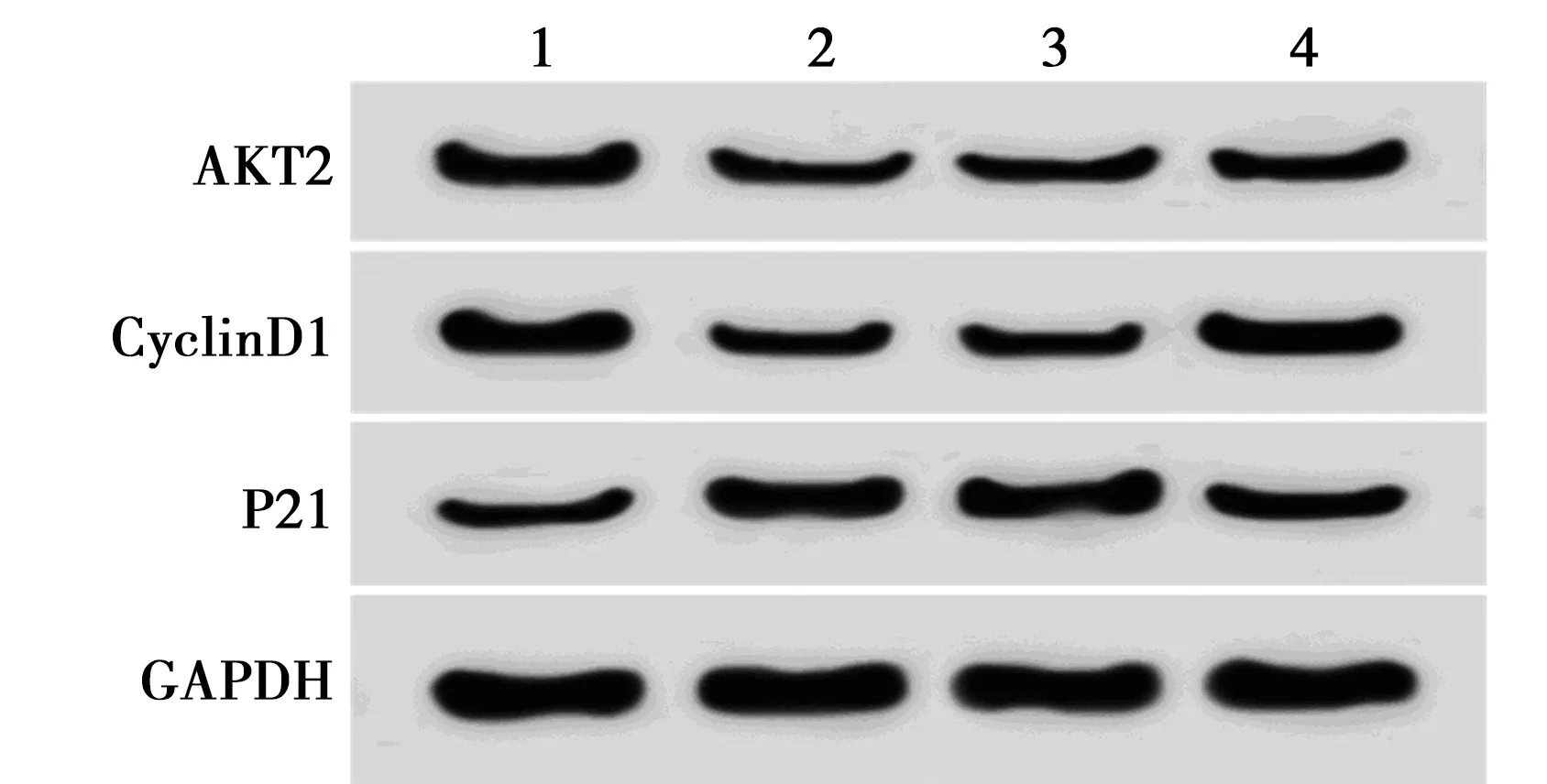
1~4:miR-NC组,miR-126-3p组,miR-126-3p+pcDNA3.1组,miR-126-3p+pcDNA3.1-AKT2组图6 过表达AKT2能逆转miR-126-3p对 MUM2B细胞增殖蛋白表达的影响
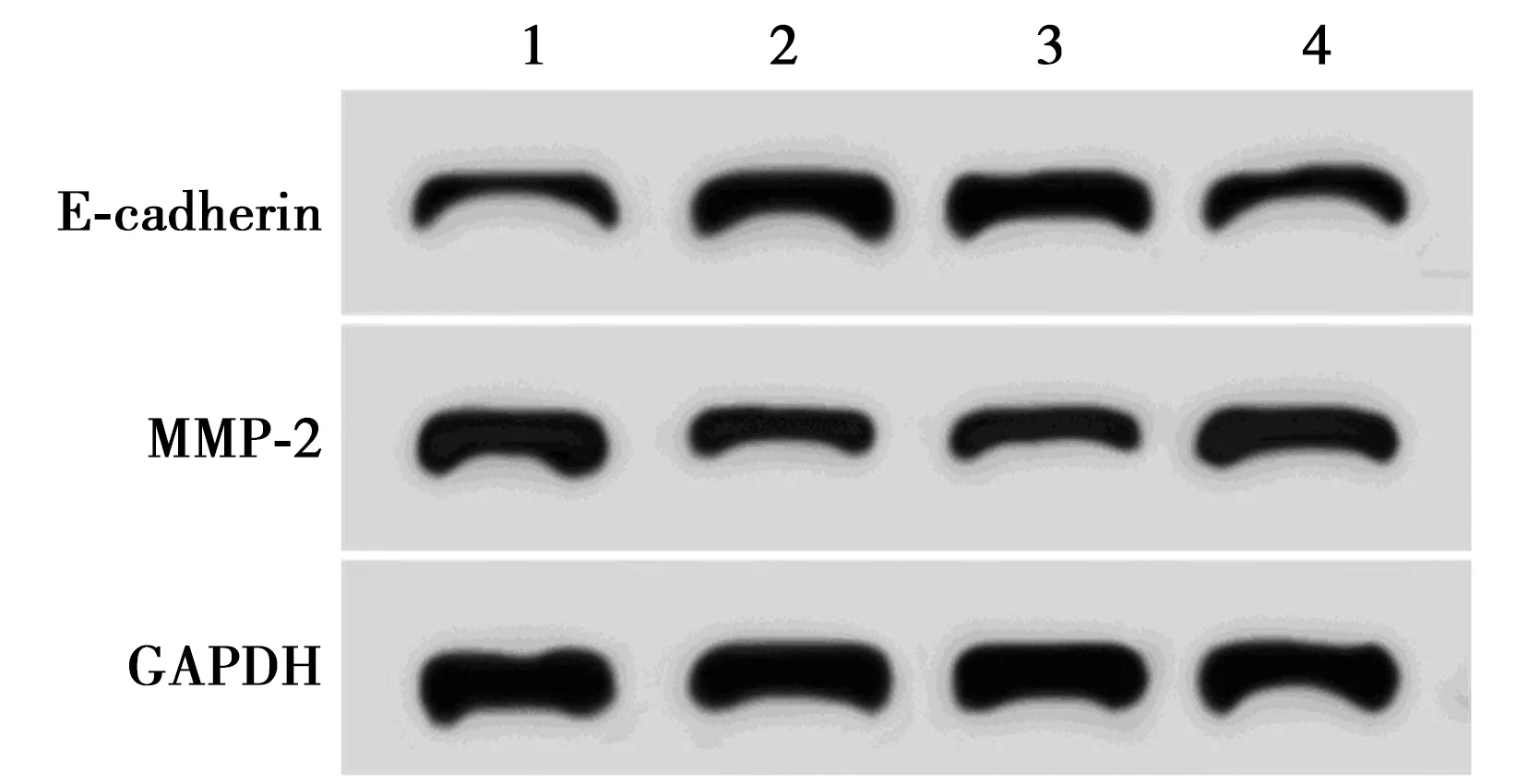
1~4:miR-NC组,miR-126-3p组,miR-126-3p+pcDNA3.1组,miR-126-3p+pcDNA3.1-AKT2组图7 过表达AKT2能逆转miR-126-3p对细胞 MUM2B迁移、侵袭蛋白表达的影响
表5 过表达AKT2能逆转miR-126-3p对MUM2B细胞迁移、侵袭的影响
3 讨 论
研究表明,在甲状腺癌组织及细胞中miR-126-3p表达被下调,miR-126-3p上调对甲状腺癌细胞增殖、迁移及侵袭有明显抑制,凋亡则明显促进〔8〕。miR-126-3p通过靶向PLXNB2而抑制卵巢癌细胞增殖及侵袭〔9〕。miR-126-3p通过靶向CCR1抑制非小细胞肺癌的生长、迁移及侵袭〔10〕。相关报道指出miR-126-3p可抑制甲状腺癌细胞生长和转移〔11〕。本研究发现,在葡萄膜黑色素瘤组织中miR-126-3p表达下调,过表达miR-126-3p可降低葡萄膜黑色素瘤细胞存活率、迁移及侵袭细胞数,提示miR-126-3p可抑制葡萄膜黑色素瘤细胞增殖、迁移及侵袭。CyclinD1通过细胞周期依赖蛋白激酶结合,促进细胞周期在G1期停滞,从而抑制细胞生长〔12,13〕。MMP-2一方面促进肿瘤细胞转移,另一方面还能降解细胞外基质;E-cadherin下调能增强上皮-间质转化从而促进细胞转移能力〔14〕。本研究发现,miR-126-3p过表达下调葡萄膜黑色素瘤细胞中CyclinD1、MMP-2蛋白表达,上调P21、E-cadherin蛋白表达水平,提示miR-126-3p可能通过上调P21、E-cadherin及下调CyclinD1、MMP-2从而降低葡萄膜黑色素瘤细胞增殖、迁移及侵袭能力。
AKT2在胃癌细胞中的表达上调,研究表明miR-98-5p可通过下调AKT2表达而抑制胃癌细胞增殖〔15〕。miR-296还能通过靶向AKT2而抑制胰腺癌细胞增殖〔16〕。相关报道指出miR-503在宫颈癌中表达下调,并通过靶向抑制AKT2表达而抑制肿瘤的生长〔17〕。提示AKT2在肿瘤中可能发挥癌基因作用。本研究显示,抑制AKT2可抑制细胞增殖、迁移及侵袭。miR-126-3p可负向调控AKT2表达,进一步实验显示,miR-126-3p过表达可通过下调AKT2抑制葡萄膜黑色素瘤细胞恶性生物学行为。
综上,过表达miR-126-3p抑制葡萄膜黑色素瘤细胞增殖、迁移及侵袭,可能与抑制靶基因AKT2的表达有关,为探究葡萄膜黑色素瘤发病的分子机制奠定理论基础。但本研究存在不足之处,本研究仅采用一种葡萄膜黑色素瘤细胞株进行研究,关于其在葡萄膜黑色素瘤其他细胞株中的研究尚未可知,同时本研究结果仍需进行体内实验进一步验证。

