干扰长链非编码RNA MALAT1对结肠癌SW480细胞生长、侵袭和裸鼠成瘤的影响
裴正浩,王耿泽,夏西超,张虎,王钧,郝阳
(1.南阳市中心医院胃肠外科,河南 南阳 473000;2.平顶山学院医学院,河南 平顶山 467000)
结肠癌是全球癌症死亡的主要原因之一,尽管其临床诊疗已经取得了长足进展,但对于复发转移性结肠癌仍缺乏有效的治疗手段,患者一般预后较差[1-2]。最近研究表明,长链非编码RNA(long non-coding RNA,lncRNA)在包括结肠癌在内的多种肿瘤的发生发展中发挥重要作用[3-4]。肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)是长度约8 000核苷酸的lncRNA,MALAT1被发现在多种肿瘤组织中表达上调。在人类结肠癌中MALAT1表达升高,其高表达与结肠癌患者不良预后密切相关[5],但其在结肠癌发生、发展中的作用及相关机制尚不完全清楚。因此本研究通过使用短发夹RNA(short hairpin RNA,shRNA)敲低结肠癌SW480细胞的MALAT1基因表达,并观察其对细胞增殖、侵袭等生物学特性以及裸鼠体内成瘤能力的影响,旨在了解MALAT1基因在结肠癌发生、发展中的作用及机制。
1 材料与方法
1.1 材料
1.1.1 细胞及实验动物结肠癌SW480细胞株(武汉普诺赛生命科技有限公司);雄/雌BALB/c-nu品系裸鼠10只(北京维通利华实验动物技术有限公司),SPF级,体质量15~20 g,动物生产许可证号SCXK(京)2019-0009;本研究根据实验动物管理与保护的有关规定饲养动物并进行实验。
1.1.2 主要试剂及仪器MALAT1-shRNA、shRNANC真核质粒载体(上海吉玛制药技术有限公司);miR-145 mimic、miR-145 inhibitor(美国Invitrogen公司);Western blot检测一抗(Abcam公司);HRP标记的IgG二抗(美国Jackson公司);PrimeScript RT reagent Kit试剂盒(宝生物工程有限公司);SYBR Green PCR Master Mix试剂盒(赛默飞世尔科技公司);双荧光素酶报告基因检测试剂盒(美国Promega公司);Matrigel基质胶(美国BD公司);脂质体转染试剂Lipofectamine 2000(美国Invitrogen公司);Transwell小室(美国Corning公司);7500RTPCR系统(美国Applied Biosystems)。
1.2 方法
1.2.1 细胞培养与转染取SW480细胞接种于含10%(φ)胎牛血清的DMEM培养基中,置于37℃,5%(φ)CO2培养箱中培养,待细胞生长汇合率达85%以上传代培养。取生长良好的细胞用于转染和后续试验。采用脂质体转染试剂分别将miR-369-3 pmimic、mimic-NC、pcDNA、pc-RAB10重组质粒、mimic+pc-RAB10重组质粒转染A549、H1299细胞,分别记为mimic组、mimic-NC组、pcDNA组、pc-RAB10组及pc-RAB10+mimic组。
1.2.2 实时荧光定量聚合酶链式反应(qRT-PCR)分析使用Trizol试剂从收集的组织和细胞株提取总RNA,测定RNA浓度和纯度后,用反转录试剂盒合成cDNA,用PCR仪进行扩增,以GAPDH为内参,按照试剂盒操作方法检测目标mRNA表达水平,采用2-ΔΔCt法计算目标mRNA相对表达量。
1.2.3 靶基因预测及双荧光素酶报告基因实验采用TargetScan软件预测MALAT1与miR-145的靶向关系;根据靶基因预测软件预测的可能结合位点体外合成该位点的DNA片段(MALAT1 wt)以及包含该位点突变体的DNA片段(MALAT1 mut),退火后克隆到双荧光素酶启动子载体Pgl3。将该质粒和miR-145 mimic共转染SW480细胞,培养48 h后,用双荧光素酶报告基因检测试剂盒测定荧光素酶活性变化。
1.2.4 Brdu法检测细胞增殖于24孔板中置入盖玻片,SW480细胞消化后以2×104个/孔接种于24孔板中,培养24 h后加入10 μmol/L Brdu继续培养4 h;取出细胞爬片以4%多聚甲醛固定20 min,PBS洗3次,然后以0.2% Triton X-100通透10 min,PBS洗3次,3%BSA室温封闭1 h后,PBS洗3次;滴加Brdu一抗4℃过夜后,采用预温的PBS轻轻清洗细胞,然后加入3%BSA稀释的二抗,室温避光孵育1 h后PBS洗3次,加入1 μg/mL DAPI室温避光染色20 min;中性树胶封片,荧光显微镜下取5个视野,统计Brdu阳性细胞数。
1.2.5 Transwell实验检测细胞侵袭Matrigel基质胶以无血清培养基稀释(体积比1∶6)后,取100 μL至Transwell小室上室,37℃孵育至基质胶为固态。待转染后各组细胞培养至对数生长期,常规消化细胞,无血清培养基调节细胞密度为1×105个/mL。取200 μL细胞悬液加入上室,下室加入500 μL含10%胎牛血清的培养基。培养48 h后用无菌棉签擦去小室内细胞,用结晶紫对侵袭至小室下层的细胞进行染色,每孔随机选取5个视野进行计数统计,每组设置3个复孔。
1.2.6 Western blot检测蛋白表达收集的各组细胞以PBS冲洗后使用细胞裂解液冰上充分裂解提取总蛋白。BCA法定量蛋白样品后,加入适量上样缓冲液,取40 μg蛋白经SDS-PAGE电泳转印至PVDF膜,5%脱脂牛奶室温封闭2 h,以GAPDH为内参,分别加入JAK2,STAT3、p-STAT3、E-cadherin、N-cadherin、Vimentin一抗4℃孵育过夜,TBST洗膜3次;最后加二抗室温下孵育2 h,ECL法显色,采用Image J软件分析蛋白条带灰度值。
1.2.7 免疫荧光检测Vimentin蛋白表达于24孔板中置入盖玻片,SW480细胞消化后以2×104个/孔接种于24孔板中,培养24~48 h后取出细胞爬片,参照“1.2.4”方法进行固定、染色,滴加抗体为Vimentin抗体。中性树胶封片后,荧光显微镜下取5个视野,统计Vimentin阳性细胞数。
1.2.8 裸鼠皮下成瘤实验10只裸鼠分为Control组和shRNA-MALAT1组各5只,取对数生长期的SW480细胞,调整细胞密度1×106个/mL,对照组裸鼠于皮下注射未经转染的SW480细胞200 μL,shRNA-MALAT1组于皮下注射转染shRNA-MALAT1的SW480细胞200 μL;每间隔5 d标尺测量肿瘤体积,30 d后处死裸鼠,剥离瘤体,称量移植瘤体积并拍照。取10%(φ)甲醛溶液固定移植瘤组织,洗涤后进行常规的脱水、透明、包埋和4 mm连续切片。
1.2.9 免疫组织化学法检测移植瘤组织中蛋白表达移植瘤组织石蜡切片常规脱蜡后采用3%H2O2孵育5 min后,加入5%山羊血清孵育20 min,甩去多余液体,加入适当稀释的Ki67、VEGF抗体4℃下孵育过夜,PBS冲洗后滴加羊抗兔IgG二抗,37℃下孵育20 min,PBS冲洗后滴加SABC,37℃下孵育30 min。采用DAB显色,控制显色时间,苏木素轻度复染、脱水、透明、封片,显微镜观察染色结果。400倍镜下每张切片随机选取5个视野,利用Motic Images Advanced 3.2图像采集系统分析每个视野阳性细胞百分比。
1.3 统计学方法
使用SPSS 20.0软件统计分析,Graphpad Prism 7作图,计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较使用SNK法。P<0.05为差异有统计学意义。
2 结果
2.1 MALAT1与miR-145靶向关系
TargetScan分析miR-145与MALAT1的结 合位点见图1(A);转染后,与Control组比较,shRNAMALAT1组MALAT1表达水平显著下降(P<0.05);共转染miR-145 mimic和野生型MALAT1报告基因载体后,SW480细胞的荧光素酶活性显著降低(P<0.05)。见图1。
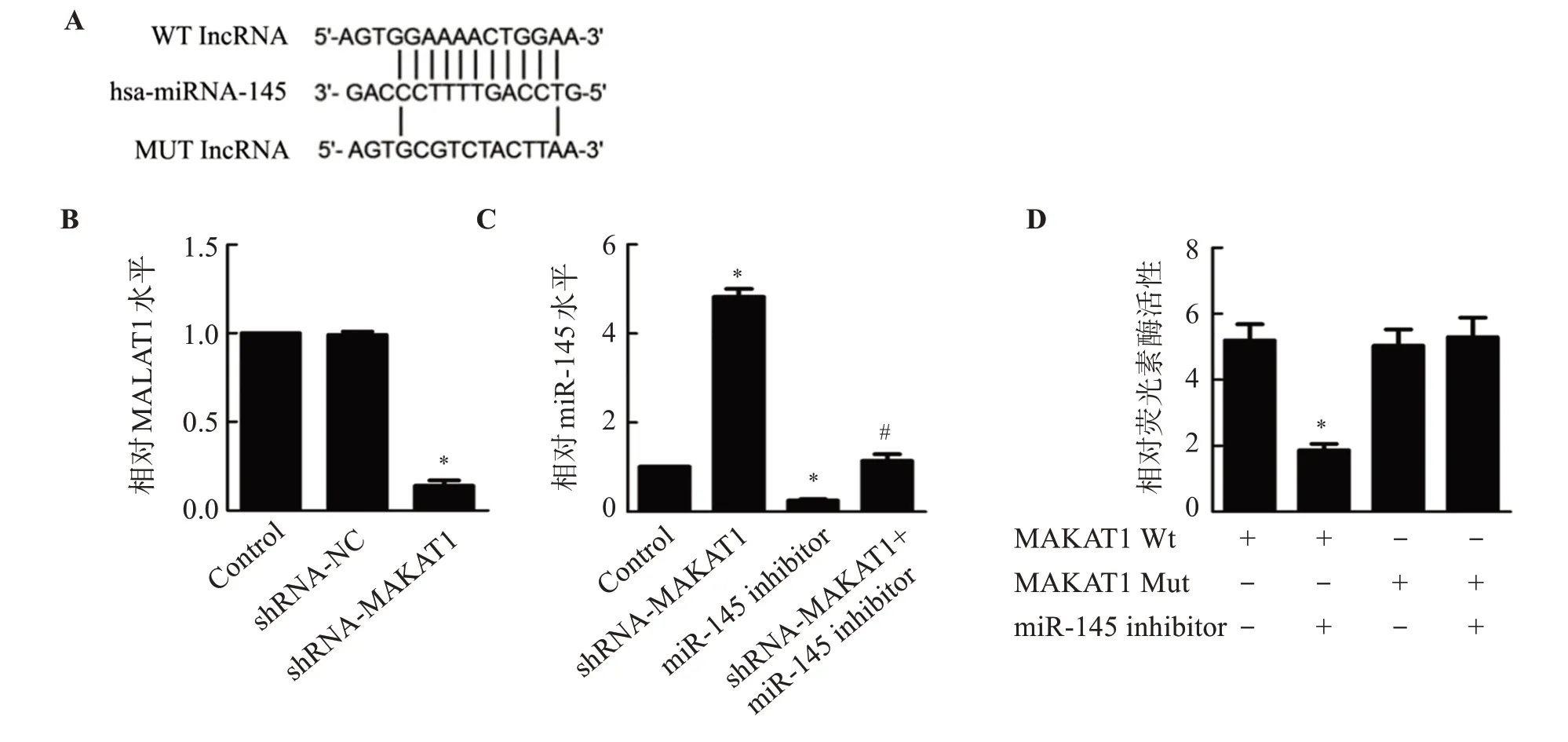
图1 MALAT1与miR-145靶向关系Figure 1 Targeted relationship between MALAT1 and miR-145
2.2 敲低MALAT1对SW480细胞增殖、侵袭的影响
与Control组比较,shRNA-MALAT1组Brdu阳性细胞数及侵袭细胞数显著降低(P<0.05),miR-145 inhibitor组Brdu阳性细胞数及侵袭细胞数显著增加(P<0.05);与miR-145 inhibitor组比较,shRNA-MALAT1+miR-145 inhibitor组Brdu阳 性 细胞数及侵袭细胞数显著降低(P<0.05)。见图2。
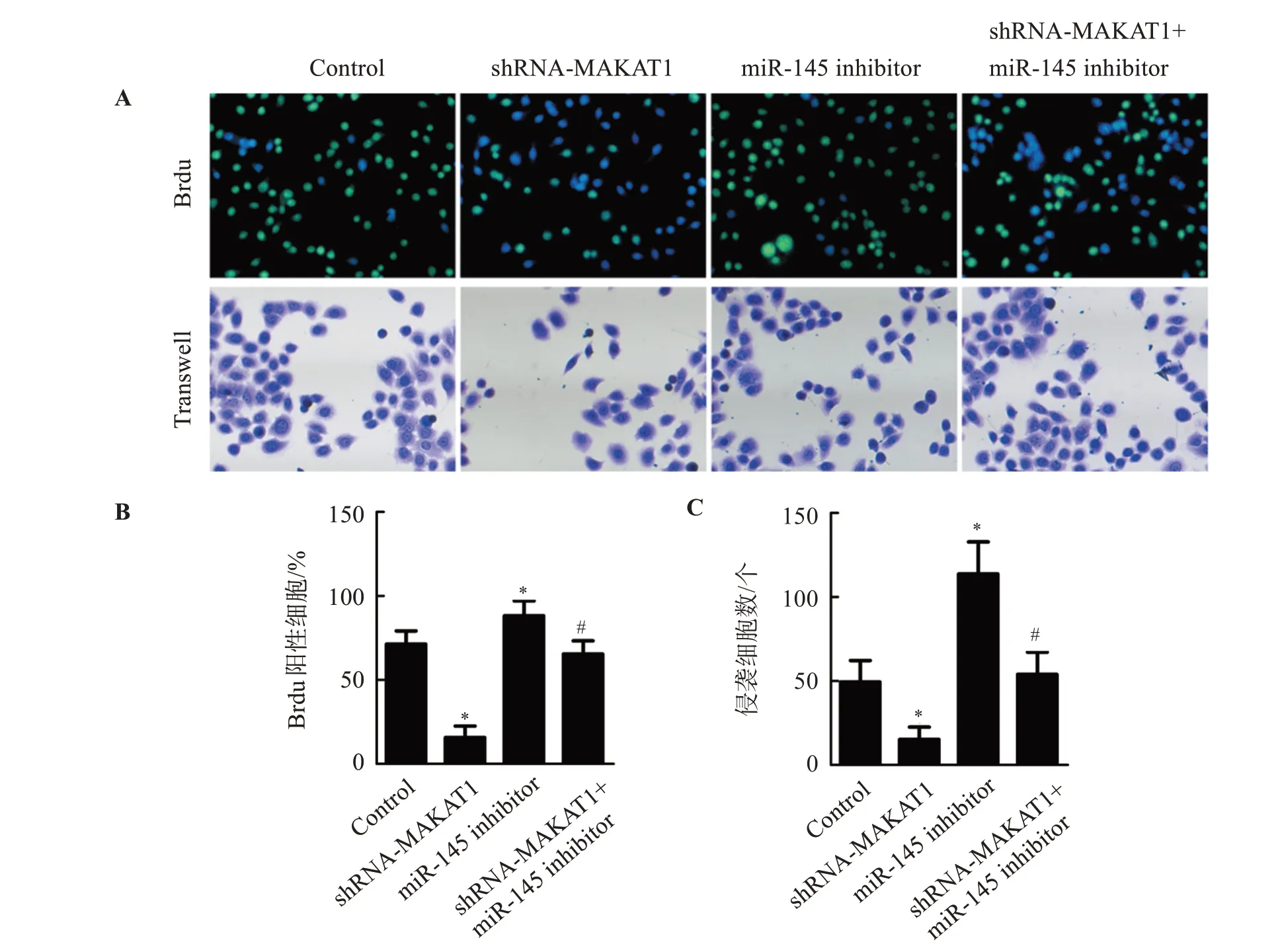
图2 敲低MALAT1通过上调miR-145抑制SW480细胞增殖、侵袭Figure 2 Knockdown of MALAT1 inhibits the proliferation and invasion of SW480 cells by upregulating miR-145
2.3 敲低MALAT1对SW480细胞侵袭相关蛋白表达的影响
与Control组比较,shRNA-MALAT1组E-cadherin蛋白表达显著增加(P<0.05),N-cadherin、Vimentin蛋白表达显著降低(P<0.05);miR-145 inhibitor组N-cadherin、Vimentin蛋白表达显著降低(P<0.05),E-cadherin蛋白表达显著增加(P<0.05)。与miR-145 inhibitor组比较,shRNA-MALAT1+miR-145 inhibitor组E-cadherin蛋白表达显著增加(P<0.05),N-cadherin、Vimentin蛋白表达显著降低(P<0.05)。见图3、图4。
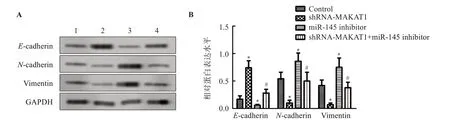
图3 敲低MALAT1对SW480细胞E-cadherin、N-cadherin、Vimentin蛋白表达的影响Figure 3 Effect of MALAT1 knockdown on the expression of E-cadherin,N-cadherin and Vimentin in SW480 cells
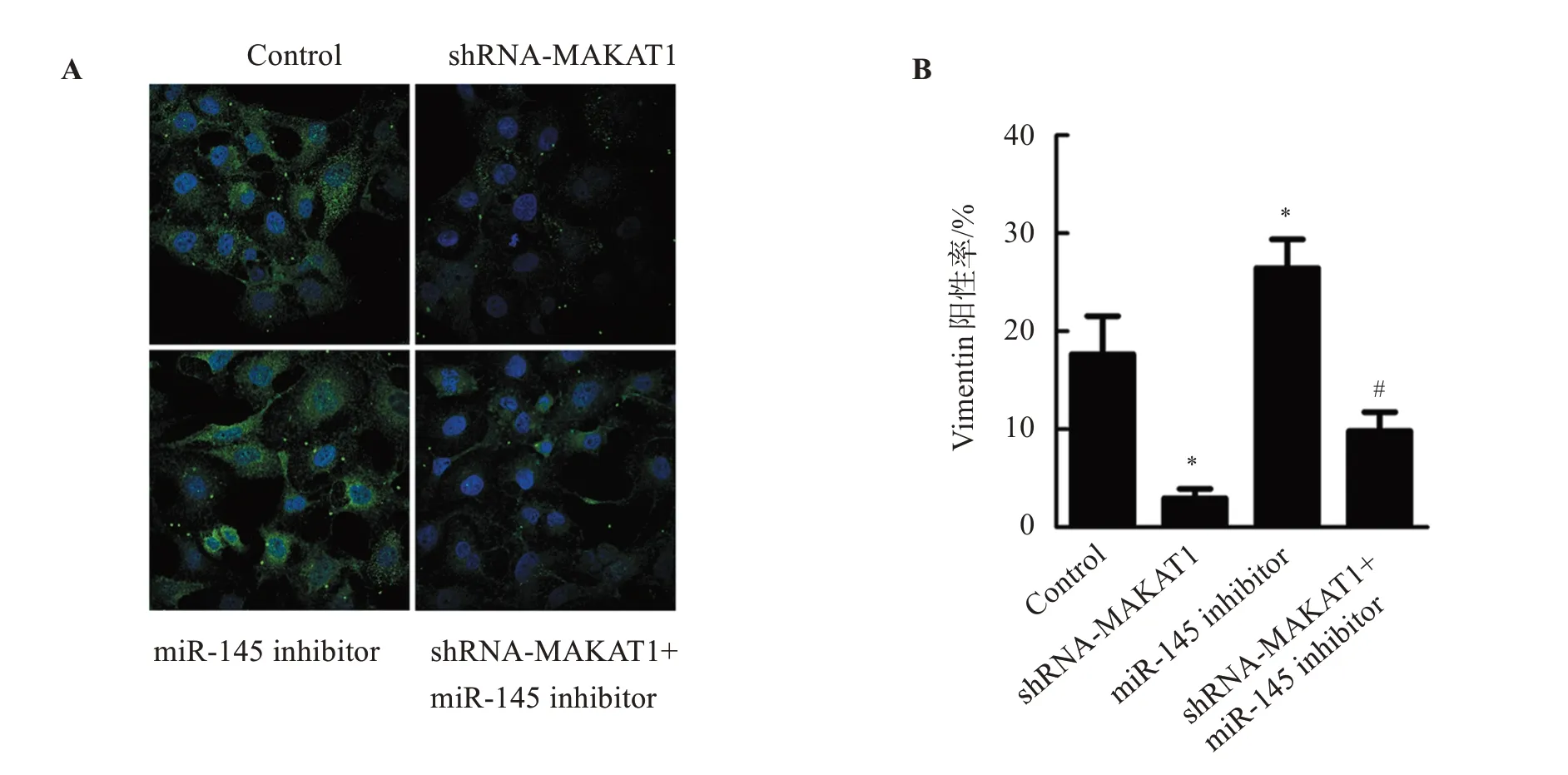
图4 敲低MALAT1对Vimentin蛋白表达的影响Figure 4 Effect of MALAT1 knockdown on the expression of Vimentin in SW480 cells
2.4 敲低MALAT1对SW480细胞JAK2/STAT3信号通路的影响
与Control组 比 较,shRNA-MALAT1组JAK2、p-STAT3/STAT3比值显著降低(P<0.05),提示敲低MALAT1表达抑制JAK2/STAT3信号通路激活。见图5。

图5 敲低MALAT1对SW480细胞JAK2/STAT3信号通路的影响Figure 5 Effect of MALAT1 knockdown on JAK2/STAT3 pathway in SW480 cells
2.5 敲低MALAT1对SW480细胞裸鼠成瘤能力的影响
与Control组比较,shRNA-MALAT1组成瘤体积显著降低(P<0.05);qRT-PCR检测显示,与Control组比较,shRNA-MALAT1组移植瘤组织中MALAT1表达显著降低,miR-145表达显著增加(P<0.05);免疫组化染色显示,shRNA-MALAT1组移植瘤组织中Ki67、VEGF蛋白表达较Control组显著降低(P<0.05),见图6。

图6 敲低MALAT1对SW480细胞裸鼠成瘤能力的影响Figure 6 Effect of MALAT1 knockdown on tumorigenicity of SW480 cells in nude mice
3 讨论
lncRNA作为一类长度大于200 nt的非编码RNA,其异常表达在多种癌症的起始和进展中起重要作用,在诸多研究中显示出其作为肿瘤调控因子和治疗靶标的潜能。在急性单核细胞白血病中,MALAT1上调导致预后不良,影响细胞增殖和凋亡[6];MALAT1上调导致非小细胞肺癌预后较差,可诱发肿瘤生长和迁移[7];MALAT1在人类结肠癌中表达被上调,其高表达与结肠癌侵袭、转移等临床病理特征密切密切相关[5];此外,抑制MALAT1表达能抑制结肠癌进展[8]。本研究发现,沉默MALAT1显著抑制了SW480细胞的生长和侵袭,与本实验结果一致的是,之前的研究[9]亦表明,MALAT1的高表达通过转录和转录后调控与肿瘤生长及转移显著相关。
miRNA是一类短的内源性非编码单链RNA,由18~25个核苷酸组成,能通过与目标RNA互补配对干扰其合成从而达到调控靶基因的目的[10-11]。本研究结果显示,miR-145在结肠癌细胞中则显示出与MALAT1相反的作用,与本研究结果一致的是,相关报道[12]显示,在结直肠癌临床样本中发现了miR-145,并通过体外实验证实miR-145通过靶向ETS相关基因削弱癌细胞的迁移和侵袭能力。通过靶向基因预测软件和双荧光素酶报告基因实验提示miR-145是MALAT1的结合靶点,结合以往研究推测MALAT1可能作为一种竞争性内源RNA结合miR-145并抑制其作用,而在结肠癌进展中发挥重要作用。
向正常组织浸润和侵袭是恶性肿瘤细胞的基本生物学特征,该过程包括肿瘤细胞的脱落、黏附、降解、移动等。随着肿瘤微环境的恶化,肿瘤细胞首先脱离原发部位,侵入到ECM、基底膜和细胞间质中[13-15]。笔者通过Transwell实验发现,敲低MALAT1的SW480细胞表现出的侵袭性明显降低。在肿瘤的侵袭和转移过程中,上皮间质转化(epithelial-mesenchymaltransition,EMT)是重要的始动因素,在EMT过程中,负责上皮细胞黏附连接的蛋白如E-cadherin能被提供更大连接灵活性的蛋白如N-cadherin等取代,从而导致细胞分离和运动性增强,使得肿瘤细胞易于侵入血管,并穿过血管壁外渗形成继发性转移灶。在功能上,本研究发现体外敲低MALAT1能抑制SW480细胞的侵袭和EMT过程。miRNAs通过靶向其下游分子调控癌变,因此预测和确认miR-145的下游作用靶点对于揭示miR-145抑制结肠癌侵袭转移的分子机制具有重要意义。JAK2是蛋白酪氨酸激酶JAK家族成员,在癌变过程中发挥着多种功能。已有研究[16]表明,JAK2在结直肠癌等多种肿瘤中通过调节STAT3的磷酸化发挥致癌基因的作用;JAK2/STAT3通路在结直肠癌细胞转移和EMT中起关键作用。本实验结果显示,MALAT1在SW480细胞中可能通过调控miR-145抑制JAK2/STAT3通路的激活从而调控其下游靶点的表达,包括E-cadherin、N-cadherin和Vimentin,而此三者是人结肠癌细胞中EMT过程中的关键调控因子。然而在进行靶基因预测时,本研究并未发现miR-145与JAK2存在潜在结合靶点,miR-145是否通过与JAK2/STAT3通路的上游因子靶向结合而调节该信号通路从而影响结肠癌细胞的EMT过程和侵袭转移有待于进一步研究。
综上所述,在结肠癌细胞中,MALAT1作为一种竞争性内源RNA负向调节miR-145功能,敲低MALAT1可通过负调控miR-145功能从而抑制结直肠癌SW480细胞的增殖、侵袭及体内成瘤能力。

