时钟基因Rev-erb α在疾病中作用的研究进展
盛明月,陈刚领
(中国药科大学中药学院,江苏 南京 211198)
Rev-erbα,又称为核受体亚家族1组D成员1(nuclear receptor subfamily 1,group D member 1,NR1D1),是生物钟系统的时钟基因之一,于1989年首次被Lazar等[1]从大鼠垂体瘤细胞中分离获得。Rev-erbα编码基因定位于甲状腺激素受体α基因的反向链,其配体结合区(ligand binding domain,LBD)缺乏识别共激活因子的转录激活域2(activation function-2,AF-2)基序[2]。作为转录抑制因子,Rev-erbα可抑制下游基因,如脑和肌肉芳香烃受体核转运样蛋白1(brain and muscle aryl hydrocarbon receptornucleartranslocator-like protein 1,Bmal1)[3]、昼夜节律运动输出周期故障蛋白[4]和腺病毒E4启动子结合蛋白4(E4 promoterbinding protein 4,E4bp4)[5]等的转录。Rev-erbα内源性配体为血红素,人工合成配体包括激动剂GSK4112,SR9009,SR9011和抑制剂SR8278等。
Rev-erbα在机体各组织器官均有分布,其表达呈昼夜节律性[5-7]。研究表明,Rev-erbα可通过调节生物体代谢[8-9]、炎症[10]和细胞增殖[11]等,参与心力衰竭[12]、阿尔茨海默病[13]和癌症[14]等疾病的发生发展。本文就Rev-erbα与心脑血管疾病、神经退行性疾病和肿瘤等发生发展的关系,其配体在疾病防治方面的应用进行综述,同时对Rev-erbα配体药物开发的潜力作简要分析。
1 Rev-erb α结构及其配体
Rev-erbα含有614个氨基酸,由具有不同功能的A/B,C,D和E结构域组成。A/B域是核受体中高度活跃的区域,能接受配体非依赖的顺式激活,并调节核受体与其他家族成员的结合。C域是DNA结合区,属于保守类区域,决定了DNA结合活性及影响伴侣核受体的选择。D域为带有核定位信息的可弯曲的铰链区。E域即LBD,能与配体结合,二聚体化并被激活,发挥转录因子作用,调控下游靶基因转录。LBD主要结构包括典型的配体结合口袋,即由H12组成的AF-2、辅助调节因子结合表面以及二聚化表面。由于Rev-erbα缺少AF-2区域,被认为不能发挥转录激活作用。Rev-erbα可与目标基因启动子和增强子直接结合,并募集核受体共加压子和组蛋白脱乙酰基酶3复合物到Rev-erbα反应元件,从而抑制下游基因的转录。
Rev-erbα曾被认为是孤儿核受体,直至内源性配体血红素被发现[15]。近年来,人工开发合成的配体被用于多种生理和病理模型,以阐释Rev-erbα在相关疾病中的作用。第一代人工合成的小分子Rev-erbα激动剂是以叔胺为母核的GSK4112[16]。SR9009和SR9011是基于GSK4112结构设计的激动剂,其中SR9009具有脂溶性高、体外效力较低、可透过血脑屏障[17]等特点,常被用于Rev-erbα与脑血管疾病关系的研究。而GSK4112较SR9009和SR9011的血浆暴露量低[18],因此较少应用于整体实验。人工合成的Rev-erbα抑制剂迄今只有 SR8278[19]。
2 Rev-erbα在心脑血管疾病中的作用
根据《2019年全球疾病负担报告》的数据,2019年全世界心血管疾病死亡人数高达1860万[20]。心脑血管疾病的诱发因素有多种,包括高脂血症、高血压和动脉粥样硬化等。炎症、氧化应激和血栓形成与心脑血管疾病损伤密切相关。研究表明,Rev-erbα在脂肪细胞、炎症细胞和心肌细胞中的表达均呈现昼夜节律性,可调控糖脂代谢、炎症反应和氧化应激等,与心脑血管疾病的发生发展有关。
2.1 Rev-erbα与糖脂代谢
糖脂代谢紊乱可导致动脉粥样硬化发生,是诱发心脑血管疾病的主要因素。研究表明,Rev-erbα敲除小鼠表现出严重的代谢紊乱,包括血糖水平异常、肥胖、脂肪变性和产热能力增加等[21-22]。Reverbα激动剂SR9009可改变生理状态下肝、骨骼肌和脂肪组织中代谢基因的昼夜节律表达模式[17]。提示Rev-erbα参与了机体的糖脂代谢过程。
磷酸烯醇式丙酮酸羧激酶1(phosphoenolpyruvate carboxykinase 1,PCK1)是调节糖异生过程的限速酶,参与维持血糖水平。Yuan等[9]研究表明,激活Rev-erbα可抑制Hepa-1c1c7和HepG2细胞中PCK1表达,下调血浆中葡萄糖水平,改善小鼠高血糖症。Vieira等[23]研究发现,下调Rev-erbα会抑制胰岛β细胞的增殖和胰岛素分泌。此外,Rev-erbα还可通过与肝细胞核因子6结合影响成纤维细胞生长因子21(fibroblast growth factor-21,Fgf21)的转录[24]。Fgf21是内分泌FGF亚家族的成员,是关键的代谢调节剂,在减轻体重和增加机体胰岛素敏感性中发挥重要作用。
胆固醇是细胞膜重要组成成分,也是激素和胆汁酸生物合成的前体。高胆固醇血症是心脑血管疾病的重要诱发因素。Rev-erbα通过参与胆固醇的合成及分解途径,调节机体胆固醇水平。胆固醇生成限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-coenzyme A reductase,HMGCR)和胆固醇调节元件结合蛋白2(sterolregulatory element binding protein 2,SREBP2)是维持胆固醇稳态的关键调控因子。研究表明,Reverbα可抑制HMGCR和SREBP2的表达[8],从而降低胆固醇水平。Rev-erbα激动剂降低胆固醇水平与他汀类药物的机制不同,前者作用机制与低密度脂蛋白受体无关[8]。Rev-erbα也可促进胆固醇分解,其作用主要通过限速酶细胞色素P450家族成员 7A1(cytochrome P450,family 7,subfamily A,polypeptide 1,CYP7A1)实现。Zhang等[25]研究发现,Rev-erbα激动剂GSK2945促进CYP7A1表达,从而降低小鼠体内总胆固醇水平。
脂肪酸结合蛋白7(fatty-acid binding protein7,FABP7)在海马、下丘脑和纹状体的星形胶质细胞中均有分布,其对长链脂肪酸的摄取、转运及代谢发挥重要调节作用,同时参与神经细胞生长和分化。研究表明,Rev-erbα可直接结合脑区FABP7启动子,降低FABP7的表达[26],可能发挥减轻脑缺血再灌注损伤的作用[27]。此外,Rev-erbα还可通过下调D型细胞周期蛋白和经典细胞分化Wingless型(Wnt)信号效应因子/β联蛋白通路调节前脂肪细胞增殖及活力,减小脂肪组织的体积[28]。
以上研究表明,Rev-erbα及其下游基因的异常激活可调控糖脂代谢,在心脑血管疾病的防控中发挥重要作用。迄今,Rev-erbα表达的昼夜震荡与代谢物水平呈昼夜节律性关系的研究仍处于起步阶段。
2.2 Rev-erbα与炎症
炎症是机体自身对刺激的一种防御性反应。心脑血管疾病的发生会导致免疫细胞的动态失衡,包括辅助性T细胞17(T helper cell 17,TH17)、小胶质细胞和星形胶质细胞等被迅速激活,进而释放相应的炎性物质,导致血脑屏障通透性增加,引起脑水肿、组织坏死和心肌损伤等。TH17细胞是CD4+T辅助细胞的成员,可分泌白细胞介素17A(interleukin-17A,IL-17A)、IL-17F、IL-21和IL-22,在免疫性疾病和机体防御反应发挥重要作用。研究表明,Rev-erbα在TH17细胞中的表达具有昼夜节律性[29]。Rev-erbα可通过调节下游E4bp4表达抑制TH17介导的促炎细胞因子表达[30]。Rev-erbα的配体对多种免疫细胞介导的免疫反应具有抑制作用,激动剂SR9009可作为树突状细胞发育和激活的负调节剂,有效抑制炎症因子IL-2、IL-1β、IL-10、IL-6和趋化因子CXCL10表达[31]。鞘内注射SR9009或GSK4112也可抑制小鼠星形胶质细胞和小胶质细胞的激活[32]。在巨噬细胞中加入GSK4112可浓度依赖性地抑制趋化因子C-C基元配体2(chemokine C-C motif ligand 2,CCL2)表达及其介导的信号通路激活[33]。
Rev-erbα可通过多个途径发挥抑制炎症反应的作用。NLR家族的热蛋白结构域3(nucleotidebinding oligomerization domain-like receptor family pyrin domain-containing 3,NLRP3)炎症小体的活化参与多种疾病的发生发展。Reitz等[34]研究发现,ip给予SR9009可降低小鼠心肌NLRP3炎症小体表达,改善心肌缺血诱导的心力衰竭。深入研究发现,Rev-erbα可特异性与NLRP3炎症小体的启动子区域结合,抑制其转录,同时也可通过NF-κB途径发挥间接抑制作用[35]。Zhao等[36]研究发现,SR9009可通过抑制Toll样受体4(Toll like receptor 4,TLR4)/NF-κB途径减轻LPS诱导的海马炎症反应。Guo等[32]研究发现,用GSK4112预处理可抑制小胶质细胞中NF-κB亚基p65的核转运,从而抑制IL-6和肿瘤坏死因子α(tumor necrosis factorα,TNFα)等促炎细胞因子的表达和分泌。综上,激动Rev-erbα可以改善疾病状态下异常的免疫反应,减少炎症因子的释放,发挥减轻心脑血管疾病损伤的作用。
2.3 Rev-erb α与氧化应激
大量研究证实,氧化应激与心脑血管疾病的发生发展关系密切[37-38]。还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶存在于多种细胞。是机体内活性氧的主要来源之一。本课题组前期研究表明,抑制中性粒细胞的NADPH氧化酶活化可减轻脑缺血损伤[39-40]。其他研究证实,Rev-erbα激动剂SR9009能下调NADPH氧化酶亚基表达水平,减少活性氧的生成,从而有效减轻氧化应激造成的损伤[41]。
2.4 Rev-erb α与血栓形成
内源性生物钟控制的血小板活化及数量变化与心脑血管疾病的发生发展密切相关。研究证实,Rev-erbα可通过RhoA/埃兹蛋白-根蛋白-膜突蛋白(ezrin-radixin-moesin,ERM)途径增强血小板活化[42],导致血栓的形成。此外,Rev-erbα表达与血小板聚集均具有晨峰现象[42-43],有助于阐释血管栓塞性疾病清晨高发的原因。
3 Rev-erb α在神经退行性疾病中的作用
神经退行性疾病是大脑和脊髓中神经元功能或细胞丧失而出现的以神经功能紊乱为特点的疾病,包括癫痫、阿尔茨海默病和帕金森病等。癫痫是伴有神经元死亡的脑部炎症,由大脑神经元过度异常放电引起。Yue等[44]研究发现,在毛果芸香碱诱导的癫痫中,使用SR9009可显著降低癫痫区NLRP3炎症小体激活和炎性因子的生成。此外Rev-erbα在海马区域表达的昼夜节律特征与癫痫发病的昼夜节律特征相一致,通过抑制E4bp4而上调γ-氨基丁酸转运蛋白Slc6a1和Slc6a11的表达,提高脑电发放振幅和频率,进而增强小鼠癫痫的发作程度并导致死亡率增高[5]。
阿尔茨海默病是一种伴有β淀粉样蛋白(amyloid-β,Aβ)斑块和神经原纤维缠结积累的神经退行性疾病。正常生理状态的小胶质细胞能有效吞噬和清除毒性Aβ寡聚体,预防该病的发生。在疾病状态下,过度激活的小胶质细胞会释放大量炎症因子,同时通过补体依赖性途径吞噬突触。有研究表明,Rev-erbα抑制剂SR8278可诱导小胶质细胞向M2型转化,从而增强其对 Aβ的吞噬作用[13,45]。帕金森病是一种以多巴胺能神经元进行性退化为特征的神经退行性疾病。黑质中的Rev-erbα缺乏可加重6-羟基多巴胺诱导的运动障碍,同时加剧中脑黑质和腹侧被盖区的多巴胺能神经元损失[46]。
4 Rev-erb α在肿瘤中的作用
肿瘤的发生是一个复杂、多步骤过程,其主要特征表现在肿瘤细胞形态、结构和功能异常,同时不受机体控制的无限增殖。昼夜节律的破坏会增加患癌风险,Rev-erbα与肿瘤的发生发展关系密切。有研究表明,昼夜节律紊乱的荷瘤模型小鼠的肿瘤恶化速度加快[47]。Wang等[48]研究发现,Reverbα通过调控细胞周期蛋白A2影响细胞周期;Rev-erbα激动剂SR9011可通过抑制癌细胞自噬基因5(autophagy-related gene 5,Atg5)抑制乳腺癌细胞增殖[11,49];SR9009和 SR9011 能特异性杀灭由癌细胞和致癌基因诱导的衰老细胞(包括黑素细胞痣),而对正常细胞活力无影响[14]。研究发现,肿瘤细胞的生长与糖代谢关系密切,控制机体血糖水平可有效减少肿瘤细胞的能量供应[50]。Tao等[51]研究发现,Rev-erbα可通过抑制糖酵解途径中编码限速酶基因的表达,抑制胃癌细胞糖酵解途径。Verlande等[52]研究发现,胰高血糖素可激活结核病小鼠肝蛋白激酶A信号转导,同时调节Rev-erbα表达,从而控制肺癌相关恶性疾病中的肝葡萄糖的生成。综上,靶向调节Rev-erbα表达可影响机体的糖代谢,减少肿瘤细胞的营养供应,并抑制肿瘤细胞的增殖。
5 Rev-erb α在其他疾病中的作用
Rev-erbα在肝纤维化疾病和视网膜退化等疾病防治中发挥重要作用。Lin等[53]研究表明,SR9009可通过抑制髓过氧化物酶及炎症因子表达,显著减轻肝缺血再灌注损伤小鼠的肝损伤。Yu等[54]使用脂多糖(lipopolysaccharides,LPS)诱导的急性肺损伤模型,发现预给药GSK4112可有效减轻模型的损伤程度。此外,SR9009可通过抑制自噬而抑制肝星状细胞激活[55],进而减轻肝星状细胞纤维化水平[56]。Cui等[57]使用 LPS 诱导流产模型,发现Rev-erbα可通过PI3K信号通路抑制巨噬细胞M1极化,从而降低小鼠流产率。Huang等[58]通过视网膜色素上皮老化模型和化学诱导的视网膜兴奋性毒性损伤模型发现,Rev-erbα缺失在损害小鼠RPE吞噬功能的同时,会加剧氧化损伤诱导的体内视网膜毒性,激活Rev-erbα可上调核因子E2相关因子2表达,减轻氧化损伤。
6 Rev-erb α配体药物开发的潜力
Rev-erbα配体能有效调节糖脂代谢、炎症反应和肿瘤细胞的增殖(见表1),在心脑血管疾病、神经退行性疾病、癌症等的发生发展及防治中发挥重要作用。GSK2945可通过下调CYP7A1的表达降低小鼠体内胆固醇水平[25];GSK4112可通过下调CCL2的表达及抑制糖酵解,从而发挥抗炎和抗肿瘤 的 作 用[33,51,54]。SR9009 可 通 过 下 调 PCK1,HMGCR和SREBF2的表达,降低小鼠血糖及胆固醇的水平[8-9];通过下调NLRP3炎症小体和IL-1β、NF-κB等的表达,发挥抗炎的作用[10,34,44,53-54];通过下调NADPH氧化酶亚单位的表达及增强核因子E2相关因子2信号通路,发挥抗氧化应激的作用[41,58]。SR9009和SR9011可抑制细胞自噬及增殖,发挥抗肿瘤作用[11,14,48]。SR8278 可抑制血小板活化及血栓的形成[42],发挥防治血栓栓塞性疾病作用;通过上调E4bp4表达,抑制脑部异常放电,发挥抗癫痫的作用[5];促进小胶质细胞M2型极化,增强对Aβ的吞噬,发挥抗阿尔茨海默病的作用[13]。
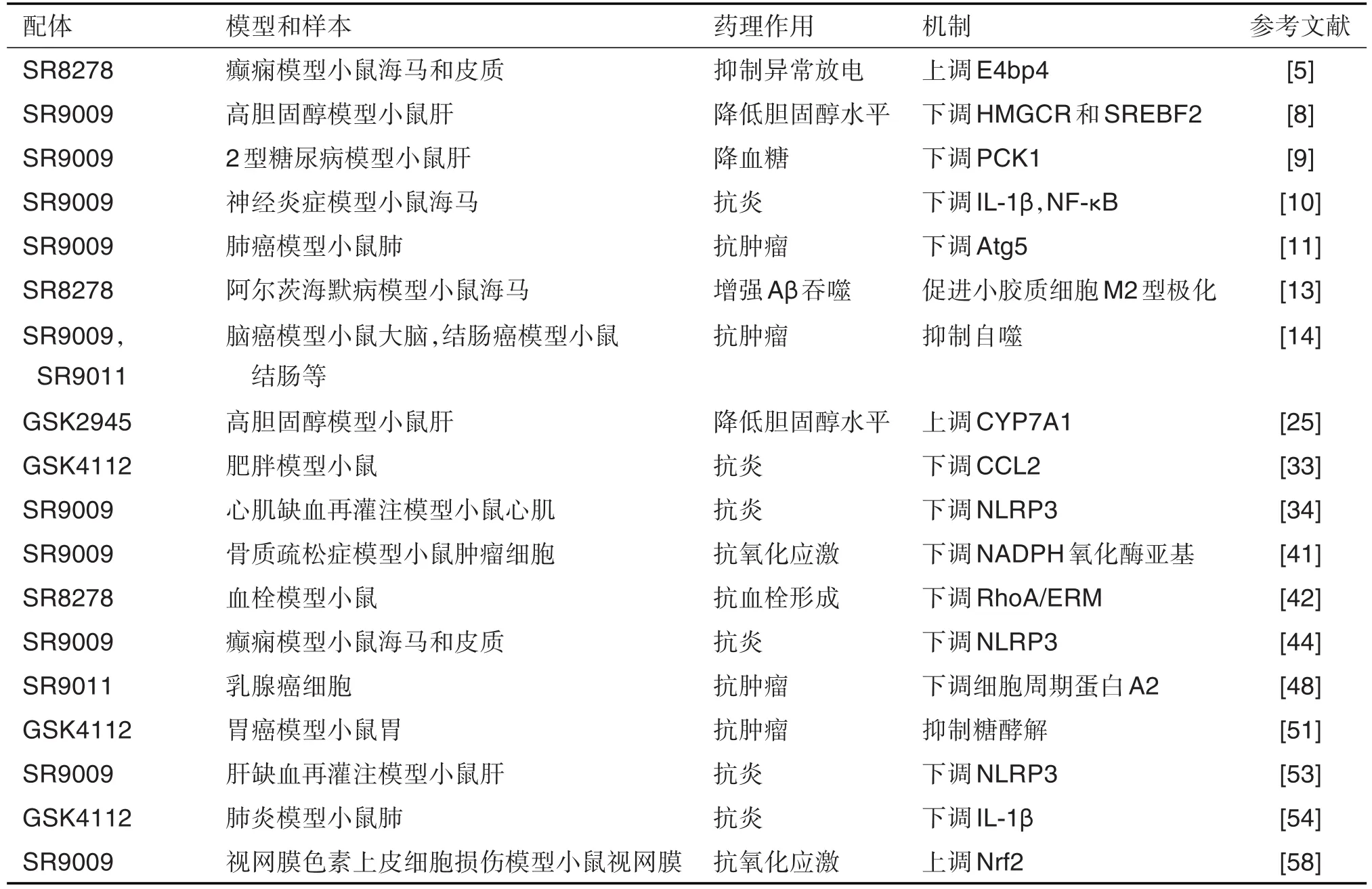
表1 Rev-erb α配体对相关疾病的防治作用及机制
靶向作用于其他核受体的药物,如糖皮质激素、甾体避孕药和贝特类降脂药等,对相关疾病的防治效应确切。但对靶向核受体Rev-erbα的药物研究较少。已有研究证实,葛根素可拮抗Reverbα,减轻小鼠高同型半胱氨酸血症[59]。小檗碱可通过激活Rev-erbα治疗结肠炎[60]。
Rev-erbα配体在啮齿类动物复制的多种疾病模型中显示出确切疗效,但相关配体向新药的转化研究尚未取得明显进展。物种间活动的昼夜节律特征的差异,是否会导致Rev-erbα在人体内的昼夜震荡特征与啮齿类动物不同,进而影响Rev-erbα的配体在临床实验中重复动物模型上的药效尚不清楚。此外,Rev-erbα配体的安全性也需要进一步验证。如靶向激活Rev-erbα治疗心脑血管疾病的同时,存在诱发高同型半胱氨酸血症及血栓的形成的风险[42,59]。
7 结语
Rev-erbα在心脑血管疾病、神经退行性疾病、癌症等的发生、发展和防治中发挥重要作用。配体靶向调节Rev-erbα可能是防治相关疾病的新策略。此外,Rev-erbα的表达呈现24 h昼夜振荡模式,在海马、皮质[5]、肝[6]和结肠[60]等多种组织中表达的峰值时间是授时因子时间(zeitgeber time,ZT)6~10。迄今,已有研究关注Rev-erbα昼夜振荡表达的时间药理学特性。有研究发现,葛根素于ZT10给药相较ZT22给药对治疗小鼠高同型半胱氨酸血症药效更好[59];小檗碱在ZT10给药的药效作用要优于 ZT2给药[60]。Amador等[61]研究发现,在ZT6注射给予SR9009小鼠,诱导小鼠清醒的效应优于ZT12给药。针对Rev-erbα昼夜振荡表达的时辰药理学研究对临床用药有着重要指导意义。总之,Rev-erbα配体药物有望被应用于临床,在相关疾病防治中发挥其优势和特色。

