外源水杨酸诱导香蕉苯丙烷类代谢提高对枯萎病抗性
段雅婕,杨宝明,郭志祥,尹可锁,胡会刚,曾 莉,白亭亭*
外源水杨酸诱导香蕉苯丙烷类代谢提高对枯萎病抗性
段雅婕1,杨宝明2,郭志祥2,尹可锁2,胡会刚1,曾 莉2,白亭亭2*
1. 中国热带农业科学院南亚热带作物研究所/农业农村部热带果树生物学重点实验室/海南省热带园艺产品采后生理与保鲜重点实验室,广东湛江 524091;2. 云南省农业科学院农业环境资源研究所/云南省农业跨境有害生物绿色防控重点实验室,云南昆明 650205
由尖孢镰刀菌古巴专化型热带4号生理小种(f. sp.tropical race 4, TR4)引起的香蕉枯萎病严重阻碍我国香蕉产业的绿色可持续发展。外源水杨酸(SA)处理能诱导香蕉体内SA合成及信号传导途径关键酶基因上调表达,激活香蕉植株内系统获得抗性,增强对各种生物和非生物胁迫的抵抗能力,在此基础上,本研究对香蕉感病品种‘巴西蕉’和抗病品种‘农科1号’进行SA诱导处理,随后接种TR4,结果显示2个品种的病情指数均降低。为了进一步探究水杨酸信号途径下游的苯丙烷类途径在SA诱导的香蕉植株抗病过程中的作用,本研究运用实时荧光定量PCR技术(RT-qPCR),对SA处理的感病品种‘巴西蕉’和抗病品种‘农科1号’中苯丙烷类途径关键基因的表达情况进行分析,结果发现分支途径中常规苯丙烷类途径关键酶基因和、木质素合成途径关键酶基因和、黄酮类物质生物合成途径关键酶基因和,对SA处理和TR4接种均有响应。在仅接种TR4的情况下,‘巴西蕉’相关基因主要表现为显著下调表达,而‘农科1号’相关基因主要表现为上调表达;仅用SA处理时,2个品种的和被诱导上调表达;SA处理并接种TR4,2个品种和依然保持上调表达的趋势,变化幅度在‘农科1号’中偏高;‘巴西蕉’经SA诱导上调表达,但在接种TR4后,相对表达量降低,而‘农科1号’被SA诱导显著上调表达,SA和TR4共同作用下,表达水平亦显著升高;‘巴西蕉’被TR4诱导显著上调表达,在SA处理并接种TR4的‘巴西蕉’植株中也表现为上调表达,‘农科1号’在SA处理或SA、TR4共同作用下表现为强烈上调表达;和在SA处理的2个品种中主要表现为上调表达,SA和TR4双重作用下,依然表现为上调表达。结果表明外源SA处理可诱导感病和耐病香蕉根组织中苯丙烷类途径关键酶基因上调表达,该途径在SA诱导的香蕉抗枯萎病过程中起着重要作用。
香蕉枯萎病;诱导抗病性;苯丙烷类途径;基因表达
香蕉是我国重要的热带经济作物,香蕉产业在推动农业经济中发挥着巨大的作用。目前,我国乃至全球香蕉生产正面临香蕉枯萎病的严重威胁,该病由尖孢镰刀菌古巴专化型热带4号生理小种(f. sp.tropical race 4, TR4)引起,TR4由根部侵染,其厚垣孢子可在土壤中存活长达30年之久[1-2]。在香蕉枯萎病防控方面,国内外学者开展了大量的研究工作,包括对香蕉抗病品种进行选育与评价、基于土壤消毒剂进行化学防治、利用拮抗菌进行生物防治、围绕轮作和土壤改良等措施进行农业防控;针对这些单一防控措施存在的诸多问题,又提出了多种防治措施相结合的综合防控方法,并在盆栽试验或部分蕉园中取得了良好的效果,还初步建立了针对无病区、轻病区和重病区的三大综合防控核心技术体系,在遏制香蕉枯萎病的进一步蔓延和扩展方面发挥着重要的作用[2]。然而,香蕉枯萎病是一种土传的维管束病害,一旦土壤被病原菌污染,仍然存在防治难度大、防控技术复杂的问题。因此,开展香蕉抗病基础研究,将为综合利用防控措施提供理论依据,为从根本上防治香蕉枯萎病、保障香蕉产业的健康和可持续发展奠定基础。
寄主植物在应对外界压力的漫长过程中,进化形成一系列快速有效的防卫体系,即病原相关分子激发的非特异性防卫反应PTI(也称作基础防卫反应)和效应子激发的ETI,防卫反应首先在受侵染部位产生一系列的细胞响应,包括水杨酸(SA)的产生;随后SA作为关键信号分子,激发植株整体对同一病原或其他病原产生系统抗性[3]。研究认为,外源SA能诱导植物体内SA合成途径,其中关键酶苯丙氨酸解氨酶(PAL)亦连接苯丙烷类代谢途径,植物苯丙烷类代谢途径主要包括常规苯丙烷类途径及下游分支途径的木质素合成途径和黄酮类合成途径[4],在抵抗病害方面具有非常重要的作用[5-7],它产生的二级代谢物,如木质素、香豆素、黄酮类物质、植物保卫素是防卫反应的重要组成部分[8],与苯丙烷类代谢紧密相关的木质化作用更是能加固寄主植物细胞壁从而避免病原菌的伤害[9]。外源SA预处理,香蕉植株体内的PAL、过氧化物酶(POD)和多酚氧化酶(PPO)的活性均有所提高[10];预处理2 d后接种TR4,感病香蕉品种SA合成途径关键基因的相对表达量显著上升,对香蕉枯萎病的抗性明显提高[11],推测SA预处理也能提高香蕉耐病品种对TR4的抗病性,其具体的诱导抗病效果需要实验明确,诱导抗病机制有待深入研究。
本课题组前期转录组学研究初步发现香蕉抗病品种受TR4胁迫,其苯丙烷类途径相关基因、、等被诱导显著上调表达[12],与ASCENSAO等[13]研究结果一致,表明苯丙烷类代谢途径中的香蕉植保素的积累和细胞壁加厚是有效抵抗枯萎病侵染的重要机制,但该途径在香蕉耐病品种中参与诱导抗性的情况不明确。为了探究苯丙烷类途径在外源SA诱导的香蕉抗病过程中的响应情况,明确苯丙烷类代谢途径在诱导抗病过程中的作用,进一步解析SA诱导的香蕉抗枯萎病机制,本研究运用荧光定量PCR技术对外源SA处理的香蕉感病和耐病品种中苯丙烷类途径关键基因进行分析,目的是在激发香蕉对枯萎病的抗性机制方面为香蕉的绿色综合防控提供理论依据。
1 材料与方法
1.1 实验设计及样品收集
供试TR4菌株为华南农业大学植物保护学院李敏慧副教授惠赠。香蕉感病品种‘巴西蕉’(L. AAA group, ‘Brazilian’)和耐病品种‘农科1号’(L. AAA group, ‘Nongke No.1’)组培苗购于中国科学院华南植物研究所香蕉组培中心,将上述组培苗栽种于盛有无菌泥炭土和椰糠(比例为1∶1)的直径10 cm的盆钵内,置于温室中培养约80 d,选择6~7片叶且长势一致的香蕉幼苗用于SA处理,实验期间温室气温为25~37℃,每月施用1次复合肥,保障香蕉生长所需的营养。称取SA(酷来搏CS9641-10g)溶于甲醇配成300 mmol/L母液,再将母液溶于单蒸水中配成300 μmol/L的工作液。对‘巴西蕉’和‘农科1号’香蕉幼苗采用300 μmol/L SA进行灌根处理,每株浇灌50 mL SA溶液,每2 d处理1次,连续处理5次,以浇灌等量清水作对照,连续处理5次后间隔1 d,采用伤根灌根法接种TR4,接种浓度为5×106CFU/mL。
分别在SA处理3次(SA-3)和5次(SA-5)、TR4接种3 d(SA+TR4-3)和5 d(SA+TR4-5)、仅接种TR4后3 d(TR4-3)和5 d(TR4-5)时,采集根组织样品,样品置于–80℃冰箱,保存备用。每个时间点处理与对照设5个生物重复,重复3次。
1.2 病情指数调查
对SA预处理并接种TR4后30 d的香蕉进行病情指数调查,每个处理调查40株苗,病情指数等级及详细调查方法参照徐胜涛等[14]的方法。
1.3 RNA抽提及cDNA合成
根组织中总RNA采用德国QIAGEN公司生产的植物总RNA提取试剂盒(Code No. 74903)提取,用Thermo核酸蛋白测定仪(NanoDrop 2000c)进行RNA浓度和完整度检测,质量合格的RNA用于下一步cDNA合成。以RNA为模板,采用TaKaRa反转录试剂盒(Code No. RR047A)反转录成cDNA链。
1.4 引物设计与基因相对表达量检测
根据本实验室获得的转录组测序结果(SRA accession number SRP026137),获得苯丙烷类途径关键基因,以Primer 5.0软件设计特异性荧光定量引物(表1),实时荧光定量反应中内参基因选用香蕉基因[15]。以扩增效率95%<< 105%、相关性2≥0.99、溶解曲线为单峰曲线为引物筛选标准,引物序列和退火温度见表1。使用荧光定量PCR仪(TaKaRa公司Thermal Cycler Dice Real Time System, TP700)对基因进行定量分析,荧光定量试剂盒为SYBR Premix ExTM(TaKaRa公司)。每个测定样品中的每个基因设置3个技术重复,以2–DDCT法计算各基因的表达量。
1.5 数据处理
使用SPSS 20.0软件单因素方差分析法对不同处理间各基因的相对表达量进行差异显著性分析,使用Excel 2010软件进行制表和制图。
2 结果与分析
2.1 SA预处理增加香蕉对TR4的抗病性
以300 μmol/L浓度的SA,预处理80 d苗龄的感病香蕉品种‘巴西蕉’和耐病品种‘农科1号’,然后接种TR4,1个月后调查香蕉的发病情况。如图1所示,2个香蕉品种的对照与SA处理的植株出现了叶片变黄、球茎变褐等枯萎病症状,但是SA预处理的香蕉,无论是‘巴西蕉’还是‘农科1号’,发病情况明显比对照轻,与WANG等[11]的研究结果一致。调查结果显示,水杨酸预先处理的‘农科1号’病情指数为15.7,低于对照病情指数30.8;‘巴西蕉’用SA处理后,接种TR4,病情指数为32.9,而其对照病情指数为49.2,这些结果表明SA能够诱导香蕉的抗病性,但这种诱导作用并不能赋予香蕉百分百的抗病能力,并且它也不针对特定的感病或耐病的香蕉起作用,这正体现了SA诱导的系统获得抗性具有广谱性。

表1 苯丙烷类途径关键基因引物序列
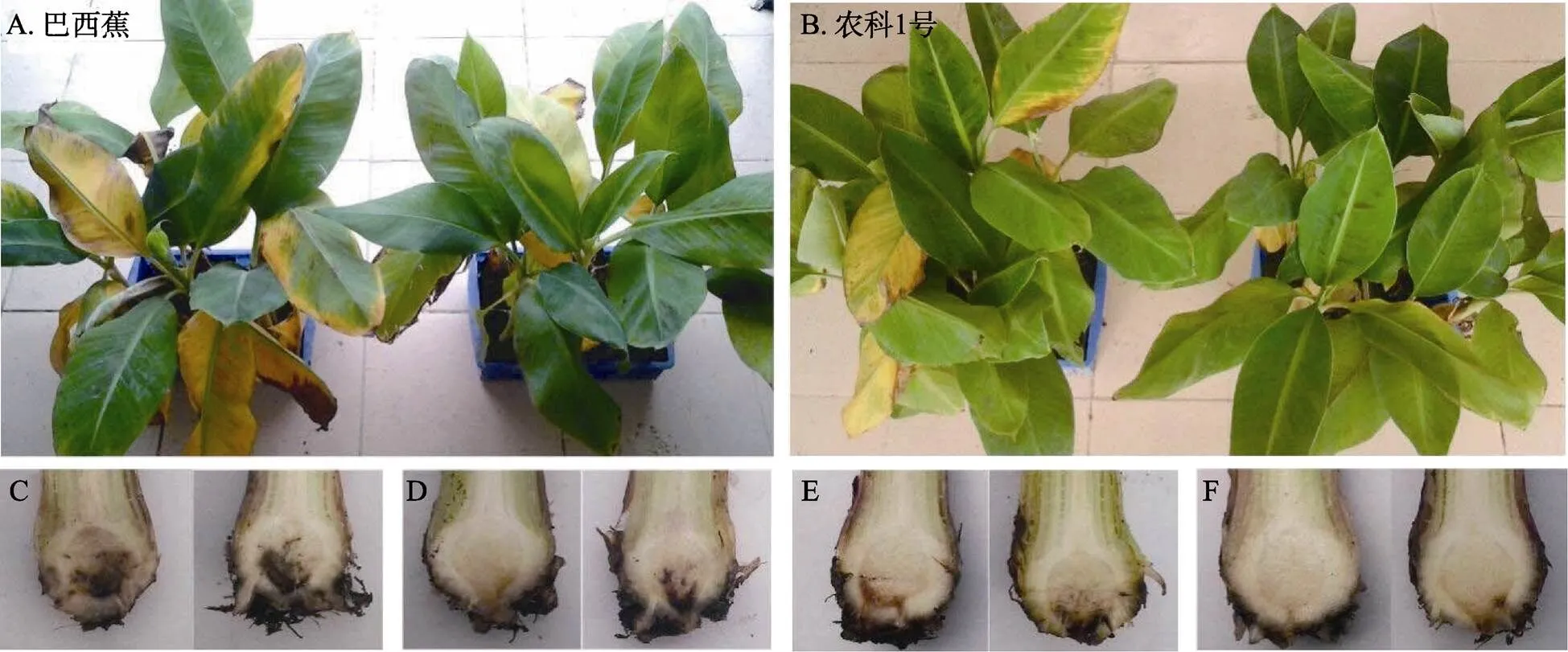
A:TR4侵染的‘巴西蕉’,左图为清水+TR4处理,右图为SA+TR4处理;B:TR4侵染的‘农科1号’,左图为清水+TR4处理,右图为SA+TR4处理;C:清水+TR4处理的‘巴西蕉’球茎;D:SA+TR4处理的‘巴西蕉’球茎;E:清水+TR4处理的‘农科1号’球茎;F:SA+TR4处理的‘农科1号’球茎。
2.2 SA诱导常规苯丙烷类途径关键基因表达变化
苯丙烷类途径的核心酶包括PAL、肉桂酸-4-羟化酶(cinnamate 4-hydroxylase, C4H)和4-香豆素辅酶A连接酶(4-coumarate: coenzyme A ligase, 4CL)[16-17]。PAL作为关键酶在SA合成途径发挥着重要作用,香蕉植株经SA诱导,体内PAL基因显著上调表达[11]。本研究对外源SA处理的抗病和感病品种植株内和基因相对表达量进行测定,RT-qPCR结果如图2所示,未经SA处理的‘巴西蕉’中2个基因被TR4抑制略微下调表达,基因在接种TR4后3 d小幅度下调表达,到接种5 d后又出现轻微上调表达,差异表达的幅度均低于2倍;在SA处理的‘巴西蕉’植株中,能被SA诱导强烈上调表达,上调幅度达到3.5倍,和被SA诱导轻微上调表达;在SA预处理后接种TR4的‘巴西蕉’植株中,3个基因表现出显著上调表达。在仅接种TR4的‘农科1号’香蕉植株中,3个基因均表现为上调表达,并且在SA处理的‘农科1号’植株中也被诱导上调表达,接种TR4后上调表达水平更高(图2)。基因在‘巴西蕉’接种TR4后5 d被显著抑制表达,与对照相比下调3.3倍,‘巴西蕉’中其他基因受TR4影响较小,只表现轻微的上调或下调,这与抗感品种受TR4侵染后的表达谱分析结果一致[12];SA处理的‘巴西蕉’中基因显著上调表达,说明SA能够诱导‘巴西蕉’中基因表达,该基因在接种TR4后依然保持较高的表达量,其中在SA预处理的‘巴西蕉’接种TR4后表达量为对照的6.1倍。在‘农科1号’中,3个受TR4影响上调表达,与对照相比最高上调幅度为4.3倍,1个基因被TR4抑制下调表达;4个基因或直接被SA诱导显著上调表达,或被SA诱导暂时处于潜在激活状态,当TR4侵染时被显著诱导上调表达(图2)。以上结果说明,相比‘巴西蕉’,‘农科1号’植株内和基因较易被诱导上调表达以抵抗TR4的侵染,这与‘农科1号’具有较强的耐病性相一致;另一方面,SA可诱导2个品种中和基因显著上调表达,且在‘农科1号’中的被诱导水平高于‘巴西蕉’。
2.3 SA诱导木质素合成途径关键基因表达变化
肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase, CAD)和咖啡酰辅酶A-O-甲基转移酶(caffeoyl CoA- O-methyltransferase, CCoAOMT)在苯丙烷类途径下游起作用,催化木质素单体形成的最后一步反应[18],结果显示,TR4胁迫下‘巴西蕉’中和基因被显著抑制下调表达,在SA处理的植株中被诱导上调表达,SA处理并接种TR4,2个基因表达水平降低,但仍然比对照高,推测TR4也能抑制已被SA激活的基因的表达,基因表达模式与前2个基因相反,它能被TR4诱导上调表达,但却被SA抑制表达,而且表达水平极低。‘农科1号’中和基因能被TR4和SA诱导上调表达,二者共同作用下表达水平亦比对照高,而被SA和TR4抑制表达,仅在用SA预处理并接种TR4后5 d的植株中出现上调表达,在‘巴西蕉’和‘农科1号’中的表达模式也许表明该基因对木质素的合成起负调控作用(图3)。基因在‘巴西蕉’中可被TR4诱导上调表达,这与抗感品种受TR4侵染后的表达谱分析结果一致[12],在先用SA处理再接种TR4的‘巴西蕉’植株中表现出更显著的上调表达;能被TR4诱导上调表达,表达水平为对照的1.5倍,SA单独作用对其无明显的诱导效果,与仅接种TR4的植株相比,在用SA处理并接种TR4的植株中表达无显著性差异。TR4胁迫下,‘农科1号’中2个基因表达水平上调;SA处理强烈诱导‘农科1号’植株基因上调表达,最高上调6倍,再接种TR4后基因表达水平与对照相比仍处于上调状态(图3)。

CK:未处理的健康植株;SA-3:SA处理3次:SA-5:SA处理5次;TR4-3:接种TR4后3 d;TR4-5:接种TR4后5 d;SA+TR4-3:SA预处理并接种TR4后3 d;SA+TR4-5:SA预处理并接种TR4后5 d。*表示处理与对照间差异显著(P<0.05)。

CK:未处理的健康植株;SA-3:SA处理3次:SA-5:SA处理5次;TR4-3:接种TR4后3 d;TR4-5:接种TR4后5 d;SA+TR4-3:SA预处理并接种TR4后3 d;SA+TR4-5:SA预处理并接种TR4后5 d。*表示处理与对照间差异显著(P<0.05)。
2.4 SA诱导黄酮类物质生物合成关键基因表达变化
查尔酮合成酶(chalcone synthase, CHS)催化苯丙烷类生物合成途径分支黄酮类色素合成的第一步,也是最关键的一步反应[19]。研究结果如图4所示,TR4侵染下,‘巴西蕉’中3个基因表达被抑制,但下调倍数小于2;‘农科1号’接种TR4后,和被诱导上调表达,最高上调7.4倍,被抑制下调表达,下调倍数小于2;SA处理后,‘巴西蕉’和‘农科1号’基因都表现为上调表达;SA处理后接种TR4的‘巴西蕉’中3个基因比对照显著上调表达,比仅接种TR4的植株基因表达水平显著升高;SA处理后接种TR4的‘农科1号’中,表达水平显著高于仅接种TR4的植株(图4)。查尔酮异构酶(chalcone isomerase, CHI)也是黄酮类分子生物合成的关键酶,基因在‘巴西蕉’接种TR4后3 d被抑制下调表达,到接种后5 d又恢复为正常水平,基本不受TR4胁迫影响;2个基因在‘农科1号’接种TR4后主要被诱导上调表达,最高上调表达6.6倍;SA处理‘巴西蕉’诱导其体内基因轻微上调表达,再接种香蕉枯萎病5 d后,表达量上调3.3倍,而SA处理的‘农科1号’中,基因被强烈诱导上调表达,最高上调6.0倍,再接种TR4后依然保持较高的表达水平,但是与仅接种TR4的‘农科1号’相比差异不大;‘农科1号’基因在TR4胁迫下略微上调,但受SA影响不显著(图4)。
3 讨论
当前香蕉主栽品种多为三倍体且高度不育,面对香蕉枯萎病毁灭性病害,生产上没有完全抗病的栽培品种,因此,研究香蕉诱导抗病性及抗病机制在香蕉绿色防控方面具有重要的意义。外源SA能诱导感病香蕉植株中游离态SA积累,促使SA合成及信号传导途径关键酶基因上调表达,提高香蕉感病品种对枯萎病的抗性[11, 20]。位于SA合成及信号传导途径的下游,苯丙烷类途径在植物防卫反应中具有重要作用,病原物诱导的植物防卫反应,包括侵染点周围细胞壁加固、PR蛋白积累、H2O2的产生、细胞过敏性坏死,以及胼胝质、酚类化合物、木质素的积累[21-22],本研究使用外源SA处理香蕉感病品种‘巴西蕉’并接种TR4,结果表明SA可诱导感病品种抗病性;外源SA处理耐病品种‘农科1号’并接种TR4一个月后,植株病情指数和球茎褐化程度明显比仅接种TR4的对照低,表明外源SA处理耐病香蕉品种,也能诱导耐病香蕉提高对土传病害香蕉枯萎病的抗病能力,耐病品种和外源SA诱导抗性对香蕉枯萎病的防控效果达到68.09%。

CK:未处理的健康植株;SA-3:SA处理3次:SA-5:SA处理5次;TR4-3:接种TR4后3 d;TR4-5:接种TR4后5 d;SA+TR4-3:SA预处理并接种TR4后3 d;SA+TR4-5:SA预处理并接种TR4后5 d。*表示处理与对照间差异显著(P<0.05)。
通过RT-qPCR进一步研究外源SA诱导香蕉体内苯丙烷类途径关键酶基因表达变化情况,解析外源SA诱导的抗病机制。苯丙烷类途径包含常规苯丙烷类途径、木质素合成途径、黄酮类物质生物合成途径,分别对应的关键酶基因为、和,和,和[4]。PAL是SA合成及信号传导途径的关键酶,亦是苯丙烷类途径的关键酶和限速酶[6, 23]。PAL催化苯丙氨酸去氨基形成肉桂酸,再由C4H氧化形成香豆酸,香豆酸在4CL硫酯化作用下形成香豆酰-CoA,其后的2个分支途径可产生木质素和黄酮类物质;CAD和CCoAOMT参与木质素单体形成的最后一步[18],CHS作用于苯丙烷类途径黄酮类分子形成分支途径的第一步,催化查儿酮的形成,CHI催化查儿酮环化形成黄酮类分子[16, 24]。本研究结果显示,仅接种TR4,‘巴西蕉’苯丙烷类途径关键酶基因表达水平无显著差异或呈显著下调趋势,表明感病品种‘巴西蕉’中抗病反应被抑制[25],而‘农科1号’相关基因表达水平呈显著上调趋势,说明TR4侵染时耐病品种根系细胞壁木质化作用较强,黄酮类植保素积累较快,因此,耐病香蕉对TR4的抵抗力增强。但是水杨酸诱导的木质化作用和黄酮类合成关键酶基因的表达在耐病品种‘农科1号’和‘巴西蕉’中仍具有差异,大部分基因在‘农科1号’中诱导上调幅度强于‘巴西蕉’,这可能就是SA处理的‘农科1号’对TR4的抵抗能力强于‘巴西蕉’的原因。值得注意的是,SA处理后接种TR4,‘农科1号’和‘巴西蕉’仍有部分植株表现出典型的枯萎病症状,其原因一方面可能是接种的TR4孢子浓度(5×106CFU/mL)过高,高浓度的TR4产生大量的镰刀菌酸,破坏香蕉组织的细胞壁功能[26];另一方面,该现象说明SA诱导的系统获得抗性在TR4侵染的初始阶段延缓了TR4的入侵及在根组织的扩散,而当外源SA补给终止时,SA诱导的系统抗病性减弱甚至消失。
苯丙烷类途径位于SA合成及信号传导途径的下游,外源SA处理诱导感病香蕉品种和耐病香蕉品种根组织中苯丙烷类途径与木质素产生和黄酮类合成的关键酶基因上调表达,提高对TR4的抗病性;水杨酸诱导的大部分木质化作用和黄酮类合成关键酶基因在‘农科1号’中诱导上调幅度强于‘巴西蕉’,因此,SA诱导的耐病品种‘农科1号’对TR4的抵抗能力强于感病品种‘巴西蕉’;SA处理后接种TR4,‘农科1号’和‘巴西蕉’仍有部分植株表现出典型的枯萎病症状,表明高浓度TR4接种条件下,SA诱导的香蕉系统获得抗性并不能赋予香蕉完全的抗病能力,但抗病品种结合SA抗性诱导处理相比感病品种,在降低香蕉枯萎病病情指数以及香蕉病害的防控方面具有显著效果。本研究确定了外源SA对耐病品种的诱导抗病效果,明确了苯丙烷类代谢途径参与SA诱导的香蕉抗病过程,揭示了SA诱导的香蕉抗枯萎病机制。
[1] PLOETZ R C.wilt of banana is caused by several pathogens referred to asf. sp.[J]. Phytopathology, 2006, 96(6): 653-656.
[2] 李华平, 李云锋, 聂燕芳. 香蕉枯萎病的发生及防控研究现状[J]. 华南农业大学学报, 2019, 40(5): 128-136.
LI H P, LI Y F, NIE Y F. Research status of occurrence and control ofwilt of banana[J]. Journal of South China Agricultural University, 2019, 40(5): 128-136. (in Chinese)
[3] 汪 尚, 徐鹭芹, 张亚仙, 曾后清, 杜立群. 水杨酸介导植物抗病的研究进展[J]. 植物生理学报, 2016, 52(5): 581-590.
WANG S, XU L Q, ZHANG Y X, ZENG H Q, DU L Q. Advances in plant disease resistance mediated by salicylic acid[J]. Plant Physiology Journal, 2016, 52(5): 581-590. (in Chinese)
[4] DONG N Q, LIN H X. Contribution of phenylpropanoid metabolism to plant development and plant-environment interactions[J]. Journal of Integrative Plant Biology, 2021, 63(1): 180-209.
[5] 王 星, 罗双霞, 于 萍, 罗 蕾, 赵建军, 王彦华, 申书兴, 陈雪平. 茄科蔬菜苯丙烷类代谢及相关酶基因研究进展[J]. 园艺学报, 2017, 44(9): 1738-1748.
WANG X,LUO S X,YU P,LUO L,ZHAO J J,WANG Y H,SHEN S X,CHEN X P. Advances in phenylaprapanoid metabolism and its enzyme genes in Solanaceae vegetables[J]. Acta Horticulturae Sinica, 2017, 44(9): 1738-1748. (in Chinese)
[6] PORTAL O, IZQUIERDO Y, VLEESSCHAUWER D D, SÁNCHEZ-RODRÍGUEZ A, MENDOZA-RODRíGUEZ M, ACOSTA-SUÁREZ M, OCAÑA B, JIMÉNEZ E, HÖFTE M. Analysis of expressed sequence tags derived from a compatible–banana interaction[J]. Plant Cell Reports, 2011, 30(5): 913-928.
[7] YOU X M, FANG H, WANG R Y, WANG G L, WANG G L, NING Y S. Phenylalanine ammonia lyases mediate broad-spectrum resistance to pathogens and insect pests in plants[J]. Science Bulletin, 2020, 65(17): 1425-1427.
[8] DIXON R A. Natural products and plant disease resistance[J]. Nature, 2001, 411(6839): 843-847.
[9] SONBOL F M, FORNALÉ S, CAPELLADES M, ENCINA A, TOURIÑO S, TORRES J L, ROVIRA P, RUEL K, PUIGDOMÈNECH P, RIGAU J, CAPARRÓS-RUIZ D. The maize Zm Myb42 represses the phenylpropanoid pathway and affects the cell wall structure, composition and degradability in[J]. Plant Molecular Biology, 2009, 70(3): 283-296.
[10] 江新华, 谢江辉, 王 尉, 梁国鲁. 水杨酸诱导香蕉抗枯萎病生理试验[J]. 中国果树, 2006(6): 39-42.
JIANG X H, XIE J H, WANG W, LIANG G L. Physiological experiment on banana resistance induced by salicylic acid againstwilt[J]. China Fruits, 2006(6): 39-42. (in Chinese)
[11] WANG Z, JIA C H, LI J Y, HUANG S Z, XU B Y, JIN Z Q. Activation of salicylic acid metabolism and signal transduction can enhance resistance towilt in banana (L. AAA Group, Cv. Cavendish)[J]. Functional & Integrative Genomics, 2015, 15(1): 47-62.
[12] BAI T T, XIE W B, ZHOU P P, WU Z L, XIAO W C, ZHOU L, SUN J, RUAN X L, LI H P. Transcriptome and expression profile analysis of highly resistant and susceptible banana roots challenged withf. sp.tropical race 4[J]. PLoS One, 2013, 8(9): e73945.
[13] ASCENSAO A R, DUBERY I A. Panama disease: cell wall reinforcement in banana roots in response to elicitors fromf. sp.race four[J]. Phytopathology, 2000, 90(10): 1173-1180.
[14] 徐胜涛, 白亭亭, 张 磊, 番华彩, 杨佩文, 尹可锁, 曾 莉, 李迅东, 郭志祥, 杨宝明, 黄玉玲, 李永平, 郑泗军. 基于表型症状和实时定量PCR鉴定不同香蕉品种对枯萎病的抗病性[J]. 西南农业学报, 2017, 30(9): 1997-2002.
XU S T, BAI T T, ZHANG L, FAN H C, YANG P W, YIN K S, ZENG L, LI X D, GUO Z X, YANG B M, HUANG Y L, LI Y P, ZHENG S J. Evaluation of different banana varieties onwilt TR4 resistance by phenotypic symptom and real-time quantitative PCR[J]. Southwest China Journal of Agricultural Sciences, 2017, 30(9): 1997-2002. (in Chinese)
[15] CHEN L, ZHONG H Y, KUANG J F, LI J G, LU W J, CHEN J Y. Validation of reference genes for RT-qPCR studies of gene expression in banana fruit under different experimental conditions[J]. Planta, 2011, 234(2): 377-390.
[16] HAHLBROCK K, SCHEEL D. Physiology and molecular biology of phenylpropanoid metabolism[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40(1): 347-369.
[17] 李 莉, 赵 越, 马君兰. 苯丙氨酸代谢途径关键酶: PAL、C4H、4CL研究新进展[J]. 生物信息学, 2007, 17(4): 187-189.
LI L, ZHAO Y, MA J L. Recent progress on key enzymes: PAL、C4H、4CL of phenylalanine metabolism pathway[J]. Chinese Journal of Bioinformatics, 2007, 17(4): 187-189. (in Chinese)
[18] BOERJAN W, RALPH J, BAUCHER M. Lignin biosynthesis[J]. Annual Review of Plant Biology, 2003, 54(1): 519-546.
[19] RYDER T B, HEDRICK S A, BELL J N, LIANG X, CLOUSE S D, LAMB C J. Organization and differential activation of a gene family encoding the plant defense enzyme chalcone synthase in[J]. Molecular and General Genetics, 1987, 210(1): 219-233.
[20] 段雅婕, 郭志祥, 曾 莉, 李 舒, 刘立娜, 胡会刚, 李伟明, 白亭亭. 香蕉系统获得抗性相关基因对外源水杨酸的响应分析[J]. 热带作物学报, 2022, 43(1): 9-18.
DUAN Y J, GUO Z X, ZENG L, LI S, LIU L N, HU H G, LI W M, BAI T T. Analysis of expression of systemic acquired resistance-related genes with in banana induced by exogenous salicylic acid[J]. Chinese Journal of Tropical Crops, 2022, 43(1): 9-18. (in Chinese)
[21] BENHAMOU N. Elicitor-induced plant defence pathways[J]. Trends in Plant Science, 1996, 1(7): 233-240.
[22] CHRISTENSEN H T, ZHANG Z G, WEI Y D, COLLINGE D B. Subcellular localization of H2O2in plants. H2O2accumulation in papillae and hypersensitive response during the barley - powdery mildew interaction[J]. The Plant Journal, 1997, 11(6): 1187-1194.
[23] ZHANG H, HUANG Q, YI L, SONG X, LI L, DENG G, LIANG J, CHEN F, YU M, LONG H. PAL-mediated SA biosynthesis pathway contributes to nematode resistance in wheat[J]. The Plant Journal, 2021, 107(3): 698-712.
[24] MUIR S R, COLLINS G J, ROBINSON S, HUGHES S, BOVY A, RIC DE VOS C H, VAN TUNEN A J, VERHOEYEN M E. Overexpression of petunia chalcone isomerase in tomato results in fruit containing increased levels of flavonols[J]. Nature Biotechnology, 2001, 19(5): 470-474.
[25] 王 卓. 香蕉易感枯萎病和水杨酸诱导抗枯萎病的分子机理研究[D]. 海口: 海南大学, 2013.
WANG Z. The molecular mechanism of susceptibility and salicylic acid-induced resistance towilt in banana[J]. Haikou: Hainan University, 2013. (in Chinese)
[26] DONG H H, FAN H Y, LEI Z X, WU C, ZHOU D B, LI H P. Histological and gene expression analyses in banana reveals the pathogenic differences between races 1 and 4 of bananawilt pathogen[J]. Phytopathology, 2019, 109(6): 1029-1042.
Exogenous Salicylic Acid Induced Phenylpropane Metabolism in Banana to Improve the Resistance AgainstWilt
DUAN Yajie1,YANG Baoming2, GUO Zhixiang2, YIN Kesuo2, HU Huigang1, ZENG Li2, BAI Tingting2*
1. South Subtropical Crops Research Institute, Chinese Academy of Tropical Agriculture Sciences / Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture and Rural Affairs / Key Laboratory of Hainan Province for Postharvest Physiology and Technology of Tropical Horticultural Products, Zhanjiang, Guangdong 524091, China; 2. Agricultural Environment and Resources Institute, Yunnan Academy of Agricultural Sciences / Key Laboratory of Green Prevention and Control of Agricultural Transboundary Pests of Yunnan Province, Kunming, Yunnan 650205, China
Bananawilt caused byf. sp.tropical race 4 (TR4) seriously hinders the green and sustainable development of banana industry in China. Exogenous salicylic acid (SA) treatment can induce the key enzyme genes up-regulation in SA synthesis and signaling pathway and further activate systemic resistance in bananas against a variety of biotic and abiotic stresses. In this research, the susceptible banana cultivar ‘Brazilian’ and resistant banana cultivar ‘Nongke No.1’ after treated with SA were inoculated with TR4. The results showed that the disease index of the two cultivars treated with SA decreased when it was compared with the SA-untreated control. In order to explore the role of phenylpropanoid pathway located downstream of SA synthesis and signaling pathway during banana resistance induced by exogenous SA againstwilt, the key genes’ expression of phenylpropanoid pathway in susceptible and resistant banana cultivars treated with SA was analyzed by fluorescence quantitative PCR (RT -qPCR). It was found that the key genesandin general phenylpropanoid pathway were responsive to both SA induction and TR4 inoculation. The same was true forandin lignin biosynthesis pathway andandin flavonoid pathway. When only TR4 was inoculation, the expression of related genes in ‘Brazilian’ mainly showed significant down-regulation, while it was mainly up-regulated in ‘Nongke No.1’. When treated with SA only,andwere up-regulated in the two cultivars. After SA treatment and TR4 inoculation, the expression ofandin the two cultivars’ maintained up-regulated trend. The up-regulation range in ‘Nongke No.1” was higher compared with ‘Brazilian’. The expression ofin ‘Bralizian’ was up-regulated treated with SA, while it decreased when further inoculated with TR4. The expression ofin ‘Nongke No.1’ was also up-regulated treated with SA, and so was it in ‘Nongke No.1’ under the double treatments with SA and TR4.in ‘Brazilian’ was induced by TR4 and showed significant up-regulation. After SA treatment and TR4 inoculation, the expression ofin ‘Brazilian’ still maintained strong up-regulation. The expression ofwas strongly induced up-regulation in ‘Nongke No.1’ treated only with SA or further inoculated with TR4.andshowed significant up-regulation in the two cultivars treated with SA. And it still was up-regulated after SA and TR4 double treatments. Results indicated that exogenous SA could induce the up-regulated expression of key enzyme genes of phenylpropanoid pathway in the roots of susceptible and resistant banana cultivars and phenylpropanoid pathway plays a very important role in the induced resistance against TR4 in banana.
bananawilt; induced resistance; phenylpropanoid pathway; gene expression
S432.2.3
A
10.3969/j.issn.1000-2561.2022.09.015
2022-01-20;
2022-06-06
国家重点研发计划项目(No. 2019YFD1000903);财政部和农业农村部国家现代农业产业技术体系项目(No. CARS-31);广东省自然科学基金项目(No. 2018A030313602)。
段雅婕(1983—),女,博士,助理研究员,研究方向:香蕉枯萎病防治。*通信作者(Corresponding author):白亭亭(BAI Tingting),E-mail:baiting8797@126.com。

