自发气调包装对菜心货架期品质和衰老 相关基因表达的影响
菜心(Brassica campestrisL.ssp.chinensisMakino)又称为菜薹,是一种叶、花、茎同食的蔬菜[1-2],富含维生素C、人体所需氨基酸和一些黄酮类化合物。叶类蔬菜的食用部分大多为鲜嫩的绿叶以及茎秆,但叶是植株新陈代谢速度最高的营养部分,因其表面积大、水分挥发速度快,且表层的保护组织很脆弱或在采摘过程中还没充分发育,所以在采摘后易脱水而枯萎。而且,幼叶蔬菜呼吸功能很强,在贮运过程中会急剧损耗大量营养物质,从而形成大量呼吸热,从而导致蔬菜老化、黄化和腐烂等现象,进而造成蔬菜的新鲜品质急剧下降,因此菜心等叶菜类蔬菜贮藏保鲜难度大[3-4]。因此,通过深入研究探讨造成菜心品质降低的各种因素,对于解决菜心保鲜问题有着重大意义。
气体调节保鲜是利用水果和蔬菜的呼吸作用、环境中的气体成分以及包装膜渗透的动态平衡而建立的储存方法。它是保持水果和蔬菜质量、减少收获和运输过程中损失的有效手段之一[5-6]。薄膜包装能够有效减少青菜的新陈代谢速率,从而降低营养物质的丢失,10 ℃条件下,聚丙烯薄膜包装材料最能够延长青菜的贮藏有效期[7];聚乙烯薄膜保湿性好、透气性好,可有效控制蔬菜失水和无氧呼吸,延缓采后老化进程[8]。本实验通过自发气调包装研究其对采后菜心的保鲜效果影响,包含聚乙烯袋(Polyethylene,PE)、聚丙烯袋(Polypropylene,PP)和双向拉伸聚丙烯袋(Biaxially Oriented Polypropylene,BOPP)等包装,并进一步研究自发气调包装延缓菜心老化的作用机制,从维生素C代谢相关基因表达等方面进行探讨,这对于解决菜心保鲜、增长其货架期及提高其商品附加值具有理论和现实意义。
1 材料与方法
1.1 材料
1.1.1 试材
本实验所采用的主要品种是“四九”型菜心,是在中国广州从化市郊街光联村农场采购,大棚栽培,选用了茎薹丰满,均匀,无病、虫、黄叶、断叶,花蕾未开放的植株为实验试材,按14 cm高度要求用刀整齐采摘,经真空预冷到1 ℃后,租用广州拜尔冷链物流公司的冷藏车运存于4 ℃冷库备用。
自发气调包装袋为低密度聚乙烯薄膜袋(PE)、双向拉伸聚丙烯薄膜袋(BOPP)、聚丙烯薄膜袋(PP),其厚度为0.04 mm,购于广州市海珠广场。
1.1.2 主要仪器设备
DDS-307电导率仪(上海雷磁)、果皮打孔器、VBR20糖度计(杭州汇尔仪器)、RS232C紫外分光光度计(德国Eppendorf公司)、GC-17A气象色谱仪(日本岛津有限公司)、T100 PCR仪(美国BIO-RAD公司)、CFX9600荧光定量PCR仪(美国BIO-RAD公司)和SonyA580相机(日本Sony)等。
1.1.3 主要试剂
荧光引物,由上海生物工程有限公司合成;RNA提取试剂盒,购于天泽生物技术有限公司;RNA反转录试剂盒,购于TAKARA公司;乙醇、丙酮、二甲苯、浓硫酸等试剂购于SIGMA Life Science有限公司。
1.2 实验处理
选好的菜心随机分成4组,放入塑料框架(36 cm×21 cm×13 cm),每框内放置20个菜心,分别用PE、PP和BOPP薄膜包装并密封,以不包装样品作为对照组。每个处理都放在25 ℃条件下贮藏5 d,每个处理重复3次,对贮藏0 d、1 d、2 d、3 d和5 d的菜心的衰老情况进行观测,并采样分析相关生理指标,同时取菜心叶片用液氮迅速冷冻,置于-80 ℃冰箱中待用。
1.3 菜心生理指标的测定方法
1.3.1 叶片黄化指数的测定
菜心叶片的黄化程度分为5个等级:0级,无黄化叶片;1级,叶片黄化面积<25%;2级,叶片黄化面积为25%~50%;3级,叶片黄化面积为50%~75%;4级,叶片黄化面积>75%。取菜心叶片测定黄化指数,重复3次。叶片黄化指数的计算公式为

1.3.2 失重率的测定
使用称重法,每个处理固定颗数,分3个重复,每个重复20根菜心。失重率的计算公式为

1.3.3 叶片相对电导率的测定
参照李秋月等[9]的方法,使用ODDS-11c测量型电导率仪时,用打孔器将菜心叶片打成厚薄均匀、尺寸相同的组织圆片(直径0.5 cm)放入三角锥瓶中,双蒸水洗3次,用滤纸吸干,准确称0.1 g圆片,放进25 mL双蒸水中,在25 ℃下保温2 h,用ODDS-11c型的电导率仪测出R1,加热煮沸5 min后迅速冷却,再测R2。相对电导率的计算公式为

1.3.4 叶绿素荧光Fv/Fm值的测定
把叶片在暗处中放置10 min,通过OS-30P调制式叶绿素荧光仪(Opti-Sciences,USA)来测定叶片的Fv/Fm值。
1.3.5 总叶绿素含量的测定
参照张宪政[10]的方法,准备好丙酮∶乙醇=2∶1的混合液,称取0.1 g叶片切碎,放进50 mL塑料管中加20 mL上述混合液,盖上盖子,在室温暗室下浸泡约24 h,在此期间振摇2~3次,提取其叶绿素。以提取液做对照,在645 nm和663 nm波长测定上清液吸光度,每个处理均重复3次。总叶绿素含量计算公式为
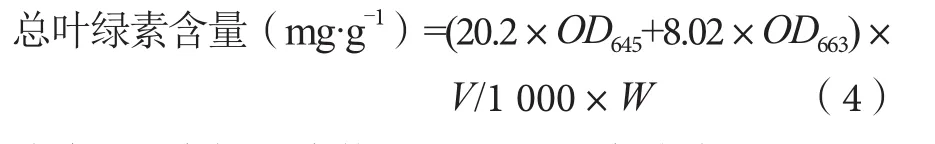
式中:V为提取液体积,mL;W为叶片重量,g。
1.3.6 维生素C含量的测定
采用比色法[11],称取2.0 g鲜样,加2%草酸3 mL磨成匀浆,转到100 mL容量瓶,并用1%草酸冲洗其残渣。加1 mL 30%硫酸锌溶液,摇匀,添加15%亚铁氰化钾溶液1 mL,最后用1%草酸定容至刻度,过滤到一个烧杯中。取提取液4 mL放入具塞大试管中,依次加入2 mL染料,5 mL二甲苯,以二甲苯为空白调零,根据标准曲线方法测量其吸光度,通过回归方程算出所测样品中维生素C含量。
1.4 菜心相关基因表达的方法
1.4.1 样品总RNA提取
参照吴亚[12]的方法,用天泽生物技术有限公司的植物RNA提取试剂盒提取菜心RNA,具体步骤如下。
(1)称取50~100 mg样品,用液氮进行速冻后,将其研磨成粉状,趁液氮还没完全挥发时,将其转移至2.0 mL的离心管中,再迅速加入1 mL细胞裂解液。
(2)把300 µL的去蛋白液和200 μL氯仿一并加入离心管,振荡器振荡30 s,此时溶液呈均匀乳浊液状。
(3)将离心管在室温下12 000 r·min-1离心8 min,两相间就会有5~10 mm厚的细胞破碎物,将上清液转移至另一个干净的2.0 mL离心管中,下层有机相和中间层因为存在蛋白质、DNA和其他杂质,避免触及或吸取杂质对实验造成影响,所以留下100 µL上清液不取。
(4)加相同体积的漂洗液,充分混匀,将其加入一个离心吸附柱中,12 000 r·min-1室温下离心1 min,弃穿透液。
(5)加入 500 µL 洗柱液,12 000 r·min-1室温离心1 min,弃穿透液。加500 µL洗柱液,重复一遍。然后室温12 000 r·min-1离心1 min以便去除残留的液体。
(6)膜上消化DNA。①将6 µL的RNase-free DNase I加入44 µL DNase buffer中混匀均匀,加到离心吸附柱中并于室温放置15~20 min。②直接在离心吸附柱中添加0.5 mL去酶液,盖好,颠倒混匀数次。③室温12 000 r·min-1离心1 min,弃穿透液。④加0.5 mL去酶液,12 000 r·min-1室温离心1 min,弃穿透液。⑤室温 12 000 r·min-1离心 2 min。
(7)转移离心吸附柱至RNase-free收集管中,向里面加入50~100 µL RNA洗脱液,室温放置3~5 min。
(8)12 000 r·min-1室温离心1 min,离心管中溶液为RNA样品,检测后可立即使用或存放在-80 ℃待用。
1.4.2 样品总RNA浓度的测定及完整性检测
用分光光度计测总RNA含量及质量评价。取1 µL总RNA,稀释100倍后测定230 nm、260 nm和280 nm处的光吸收值和OD260/OD280的比值。总RNA样品浓度计算公式为
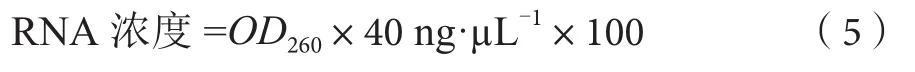
1.4.3 cDNA第一链的合成
以菜心叶片总RNA为模板,采用TaKaRa cDNA合成试剂盒反转录合成第一链cDNA,反转录酶为Reverse Transcription M-mLV(RNase H-)(TaKaRa),引物为Oligod(T)18和Random 9 mers(TaKaRa)。CDNA合成方法如下:菜心RNA 1 µL、Oligod(T)18 0.5 µL和Random 9 mers 0.5 µL混合于0.5 mL离心管中,70 ℃变性10 min,冰浴2 min,依次加入5×M-mLV(200 U·µL-1)0.3 µL,灭菌双蒸水补到 10 µL,轻柔混匀振荡到管底后,30 ℃反应10 min后,转入42 ℃反应1~2 h,反应结束后重复变性和水浴操作。此时的cDNA可做PCR,或-20 ℃存放备用。
1.5 叶片叶绿素降解和中维生素C代谢相关酶基因的表达分析
参考WAN等[13]研究报道,选取BrAct1(ABS70449.1)作为荧光定量的内参基因。选择叶绿素降解关键酶基因BrPAO以及中维生素C合成关键酶基因BrAPX进行表达分析。根据NCBI上登录的序列,设计荧光定量引物。这些引物都是在3'非翻译区设计的,用来确保扩增片段的特异性。引物的长度为18~24 bp,退火温度为55 ℃以上,引物扩增目的片段的长度一般为80~250 bp,为确保更高扩增效率,qRT-PCR引物序列都是由上海生工生物公司合成(引物见表1)。配制qRT-PCR溶液的操作流程见TAKARA SYBR Green I试剂盒说明书。
荧光定量反应程序为:95℃,3 min→(95 ℃,5 s→55 ℃,10 s→72 ℃,30 s)×40。在PCR扩增程序添加溶解程序后形成溶解曲线,程序为:60~95 ℃,以0.5 ℃递增读板,每次读板5 s。
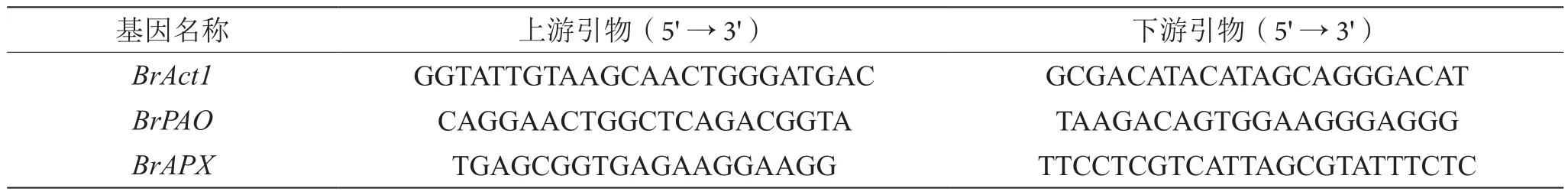
表1 qRT-PCR引物序列表
通过相对定量软件,对qRT-PCR结果的标准曲线和溶解曲线进分析、定量。每个样品3次生物学重复。
1.6 数据统计及分析作图
通过Microsoft公司的Excel 2003和SPSS Inc公司的SPSS Statistics 21.0软件对数据进行整理和统计分析,通过Systat Software Inc公司的Sigmaplot 12.0软件进行作图。各项生理生化指标的测得值以“平均数±标准误”表示,方差分析运用邓肯氏新复级差检验法(Duncan’s Multiple Ranger Test,DMRT)。
2 结果与分析
2.1 气调包装对菜心货架期衰老和品质的影响
2.1.1 货架期间不同气调包装处理菜心叶片相对电导率的变化
菜心采后还要进行生理代谢,随时间推移会逐渐衰老。研究说明,在逆境胁迫或衰老过程中,植物细胞内活性氧的产生与清除平衡会被破坏,引起膜脂过氧化,进而破坏膜系统[14]。由图1可以发现,因货架时间延长,不同包装处理的菜心叶片相对电导率都呈上升趋势,说明菜心叶片因货架时间的延长而不断衰老、变质。而经过PE、PP和BOPP等自发气调包装处理的菜心叶片相对电导率始终低于没有包装的菜心,说明自发气调包装处理降低了菜心叶片细胞膜破坏程度,有效延缓了衰老速度。此外,以PP包装的菜心的叶片相对电导率较低。
2.1.2 货架期间不同气调包装处理菜心叶片黄化指数的变化
由图2可看出,菜心在货架期间,黄化指数逐渐上升。跟未经包装的对照组相比,经过PE、PP和BOPP自发气调包装处理的菜心叶片黄化指数较低,表明气调包装能有效使菜心叶片黄化程度降低,从而保持良好的外观品质。在3种不同气调包装处理中,PP薄膜包装处理的菜心黄化指数低于PE包装和BOPP包装处理,但PP和BOPP之间差异不显著(P>0.05)。

图1 不同自发气调包装的菜心货架期叶片相对电导率的变化图
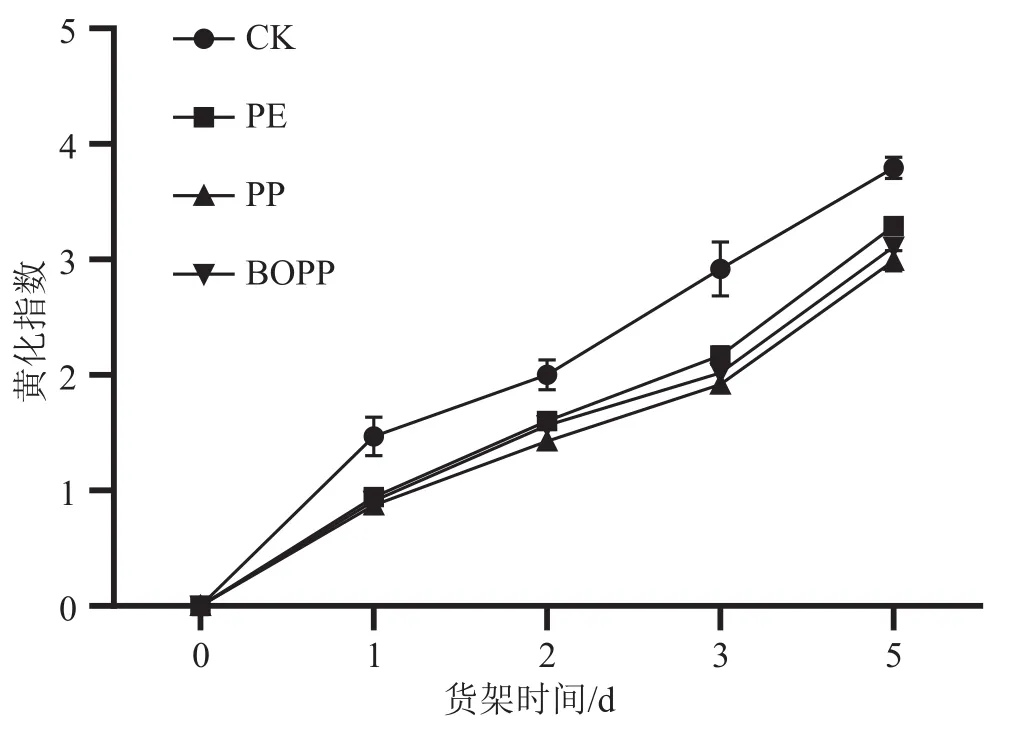
图2 不同自发气调包装的菜心货架期叶片黄化指数的变化图
2.1.3 货架期间不同气调包装处理菜心叶片叶绿素荧光值(Fv/Fm)的变化
在货架期间,对比自发气调包装与不包装菜心叶片的叶绿素荧光值(图3),可以看出PE、PP和BOPP 3种气调包装处理明显延缓了菜心叶片的叶绿素荧光值降低,并且PP包装处理的菜心叶绿素荧光值最高,表明气调包装处理能够延缓菜心叶片叶绿素的降解,尤其以PP包装效果最好。
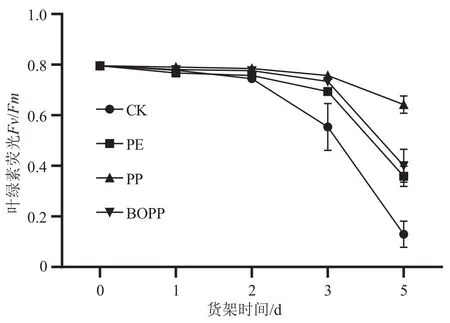
图3 不同自发气调包装的菜心货架期叶片叶绿素荧光值Fv/Fm的变化图
2.1.4 货架期间不同气调包装处理菜心叶片总叶绿素含量的变化
新鲜菜心叶片叶绿素含量为2.29 mg.g-1(图4),未经包装处理的菜心货架期第1 d后,叶绿素含量显著下降,为新鲜菜心叶片的70%。3种自发气调包装可有效延缓叶片叶绿素降解,在前2 d货架期内,以PP包装处理对菜心叶片的护绿效果最好,贮藏2 d后叶绿素含量维持为新鲜菜心叶片的65%;但在第3 d和第5 d,3种自发包装处理之间的菜心叶片叶绿素含量没有明显差异,但仍比未经包装的菜心高。
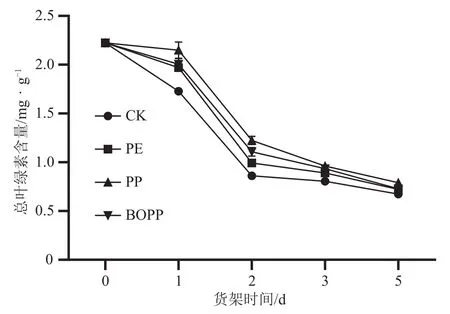
图4 不同自发气调包装的菜心货架期叶片总叶绿素含量的变化图
2.1.5 货架期间不同气调包装处理菜心失重率的变化
由于蒸腾作用及呼吸消耗,菜心产品质量在贮藏过程中逐渐下降,影响其商品性能。由图5可看出,未经包装处理的菜心在货架期间失重率高达56.91%,而气调包装有效缓解菜心质量的损失,保持了水分含量。货架第5 d时,经PE、PP和BOPP气调包装的菜心的失重率分别为0.92%、0.59%和0.71%,并且3种气调包装处理对菜心失重率的影响没有显著性差异(P>0.05)。

图5 不同自发气调包装的菜心货架期失重率的变化图
2.1.6 货架期间不同自发包装的菜心叶片维生素C含量的变化
维生素C是一种营养物质,极容易分解。果蔬在货架期间维生素C含量迅速下降。如图6所示,菜心新鲜叶片维生素C含量为83.87 mg/100 g,未经包装处理的菜心货架期间维生素C含量下降很快,至第5 d,维生素C含量仅为初期新鲜叶片的22.3%。自发气调包装处理能够显著(P<0.05)延缓菜心叶片维生素C含量的下降,以PP包装延缓效果最好。货架期第5 d,PE、PP和BOPP包装处理的菜心叶片中维生素C含量分别为初期新鲜叶片的35%、48%和42%。
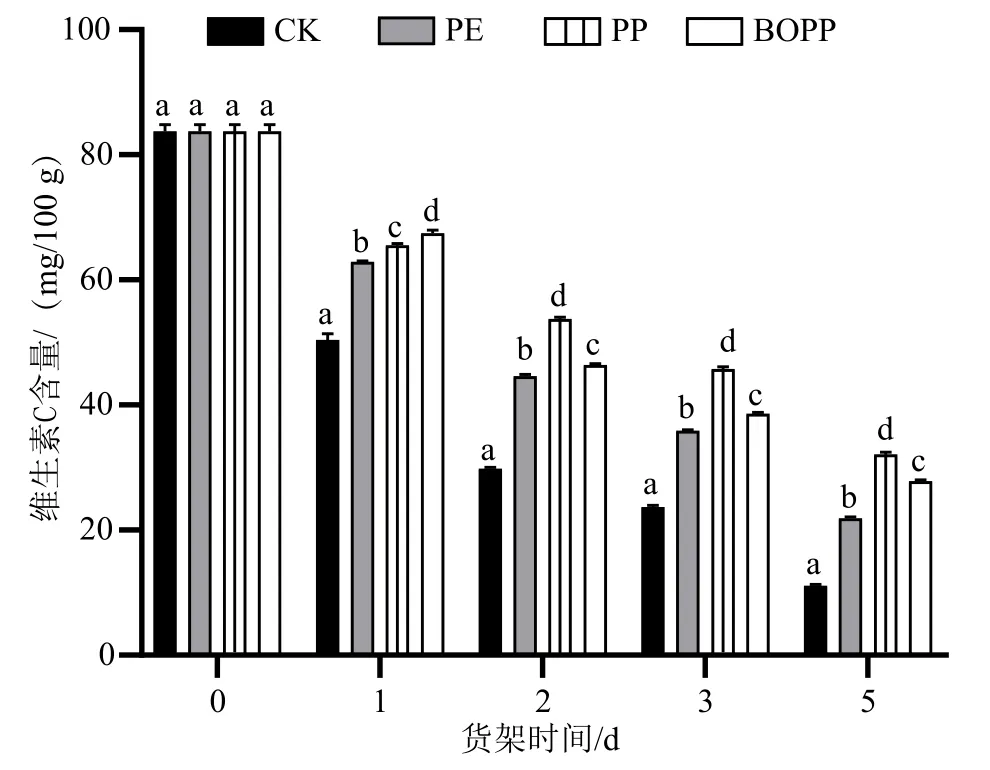
图6 不同自发气调包装的菜心货架期维生素C含量的变化图
2.2 自发气调包装对菜心叶片相关基因表达的影响
2.2.1 菜心叶片总RNA的提取
本实验使用植物RNA提取试剂盒提取菜心叶片总RNA,1.2%琼脂糖凝胶电泳结果如图7所示。
随着时间的延长,没有经过任何包装处理的菜心发生严重的失水、黄化和衰老现象,导致其RNA降解严重,所以本实验只提取了第0 d、1 d、2 d和3 d的RNA。
图7 菜心叶片总RNA电泳图
2.2.2 货架期不同自发气调包装菜心叶片BrPAO和BrAPX基因表达特性
(1)BrPAO和BrAPX基因qRT-PCR引物的筛选。qRT-PCR技术对引物的要求很高,根据NCBI上登录的菜心PAO和APX等2个基因的序列,按荧光定量引物要求,设计了它们的荧光引物。溶解曲线分析显示,引物的溶解曲线峰值单一、峰形聚拢,如图8所示。说明此次所设引物满足荧光定量的实验要求,可用于接下来的表达分析。

图8 BrAct1、BrPAO和BrAPX基因qRT-PCR引物的溶解曲线分析图
(2)货架期不同自发气调包装的菜心叶片BrPAO和BrAPX基因的表达特性。qRT-PCR结果显示,伴随着货架期菜心叶片衰老的发生,叶片BrPAO和BrAPX的表达总体呈上调的趋势(图9)。
未经包装的菜心叶片BrPAO和BrAPX基因表达水平上升最明显,至货架第3 d,BrPAO和BrAPX基因表达水平分别为0 d时的4.18和17.69倍。经过PE、PP和BOPP自发气调包装后,延缓了BrPAO和BrAPX基因表达的增强,至货架第3 d,PE、PP和BOPP自发气调包装的菜心叶片BrPAO分别为对照的45.31%、36.05%和42.35%,BrAPX分别为对照的26.96%、18.89%和17.80%。这些结果说明自发气调包装处理延缓菜心衰老进程,维持菜心品质,可能与其延缓了菜心叶片叶绿素降解基因BrPAO和维生素C代谢基因BrAPX的表达有关。
3 结论与讨论
脱镁叶酸加氧酶(Pheophorbide A Oxygenase,PAO)是叶绿素降解途径之一的关键酶。实时荧光定量PCR分析显示,货架期间菜心叶片BrPAO基因表达因衰老加剧而增强,PE、PP和BOPP等3种自发气调包装均可显著(P<0.05)抑制BrPAO基因表达的增强,说明自发气调包装能够延缓菜心叶片叶绿素的降解。抗坏血酸过氧化物酶(Ascorbate Peroxidase,APX)是维生素C代谢途径的关键酶。货架期间,随叶片衰老的进程,菜心BrAPX的基因表达增强,与不包装相比,PE、PP和BOPP等3种自发气调包装均降低了BrAPX基因表达水平,表明自发气调包装能够抑制菜心叶片维生素C的降解。
在本试验中,PE、PP以及BOPP等自发气调包装处理均能有效地延缓货架期菜心相对电导率、失重率、黄化指数的降低,延缓货架期菜心叶片总叶绿素浓度、叶绿素荧光值、维生素C含量的升高,表明自发气调包装能够有效延缓菜心衰老和品质的劣变。

