香丹注射液中致类过敏反应成分筛选及机制初探
庞 菲,王弯弯,郝瑞瑞,周甜雨,陈世忠*,靳洪涛, 4, 5*
香丹注射液中致类过敏反应成分筛选及机制初探
庞 菲1,王弯弯2,郝瑞瑞1,周甜雨3,陈世忠2*,靳洪涛1, 4, 5*
1. 中国医学科学院,北京协和医学院药物研究所,新药安全评价研究中心,北京 100050 2. 北京大学药学院,北京 100191 3. 陕西中医药大学,陕西 咸阳 712046 4. NMPA创新药物安全性研究与评价重点实验室,北京 102206 5. 北京协和建昊医药技术开发有限责任公司,北京 100176
筛选香丹注射液中可能存在的致类过敏成分并探讨其作用机制。使用Auto Dock Tools Vina软件,以人类Mas相关G蛋白偶联受体X2(Mas-related G protein-coupled receptor X2,MRGPRX2)和小鼠MRGPRb2为目标蛋白,对香丹注射液中的水溶性酚酸类物质进行分子对接,并将香丹注射液及与MRGPRX2和MRGPRb2有较高结合(≤−25.10 kJ/mol)的组成成分丹酚酸A、丹酚酸B、丹酚酸C、迷迭香酸、紫草酸与小鼠肥大细胞瘤P815细胞孵育1 h,检测组胺(histamine,His)和β-氨基己糖苷酶(β-hexosaminidase,β-Hex)释放率,筛选出致类过敏成分,进一步观察丹酚酸B及紫草酸刺激P815细胞胞内Ca2+动员及细胞脱颗粒情况,最后进行小鼠后爪外渗实验验证。P815细胞分别给予香丹注射液(1∶25、1∶250)及丹酚酸B(100 μg/mL)和紫草酸(100 μg/mL)刺激后,His、β-Hex释放均显著升高(<0.01)。P815细胞分别给予丹酚酸B(100 μg/mL)和紫草酸(100 μg/mL)刺激后,胞内Ca2+浓度均显著升高(<0.05),并有脱颗粒现象。丹酚酸B(43.5、21.7 μg/kg)和紫草酸(43.5 μg/kg)均能显著提高小鼠后爪伊文思蓝渗出程度(<0.05、0.01)。香丹注射液诱导的类过敏反应可能与丹酚酸B和紫草酸有关,且丹酚酸B和紫草酸诱导的类过敏反应可能与动员Ca2+内流相关。
香丹注射液;类过敏反应;分子对接;丹酚酸B;紫草酸;P815细胞
中药注射剂(traditional Chinese medicine injections,TCMIs)是由中医药理论指导,采用现代科学技术与方法,从中草药、天然药物中提取有效成分制成可供注入体内(包括肌内、穴位、皮内、皮下、静脉以及其他组织或器官)的无菌溶液以及供临床前配制溶液的无菌粉末或浓缩液[1]。近年来,中药制剂种类越来越多,且在病毒感染性疾病、心脑血管疾病等疾病中疗效显著,随其应用范围逐渐扩大,其用药安全性也备受重视。中药是在药物过敏反应中常见的触发因素,TCMIs复方复杂多样,几乎所有(95.7%)与中药有关的过敏性病例均来自TCMIs[2]。在2014—2019年湖北省基于自发报告系统的TCMIs安全性研究中发现类过敏反应(14.39%)是最常见的不良反应[3],对TCMIs中的潜在致类过敏反应物质进行筛选,对提高临床应用的安全性至关重要。
香丹注射液属于活血化瘀类药物,在临床中广泛应用于心脑血管疾病的治疗,脂溶性的二萜醌类及水溶性的酚酸类物质是该制剂的主要活性物质[4],丹参和降香是香丹注射液的主要组成,Cao等[5]和陈影等[6]测定出香丹注射液中水溶性酚酸类成分包括丹参素、原儿茶酸、原儿茶醛、咖啡酸、丹酚酸A、丹酚酸B、丹酚酸C、紫草酸和迷迭香酸等生物活性成分。香丹注射液疗效显著确切,随着临床对其应用的认知加深,其不良反应也受到广泛重视。药品不良反应信息通报(第45期)指出要警惕香丹注射液的严重不良反应[7],理血剂中活血化瘀药(24.5%)在2021年药品不良反应/事件报告涉及的中药中排第1位[8],在2013年TCMIs严重不良反应/事件报告中香丹注射液排第5位[9]。香丹注射液的不良反应累及皮肤、呼吸等多个组织器官,主要体现在超敏反应上,且集中于给药后30 min内,临床表现复杂多样,严重时出现休克死亡[10]。患有心血管疾病、有过敏史及过敏体质患者更易发生不良反应,当香丹注射液与其他药物联用时,会加重不良反应,增加严重不良反应的发生率[11-12]。对香丹注射液进行致类过敏物质筛选,有利于提高制剂的安全性。本研究利用已建立的成熟致敏物质筛选平台[13-14],寻找香丹注射液引起类过敏反应发生的原因,为提高其临床应用的安全性并为制剂进行质量控制以及工艺优化提供参考。
1 材料
1.1 细胞
小鼠肥大细胞瘤P815细胞购自中国科学院上海生命科学研究院细胞资源中心。
1.2 动物
SPF级雄性ICR小鼠,4~5周龄,体质量18~22 g,购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2016-0006。动物于中国医学科学院药物研究所实验动物中心适应性饲养7 d,温度20~23 ℃,相对湿度40%~70%,12 h昼夜交替循环,动物自由进食饮水。动物实验经中国医学科学院动物福利与伦理委员会批准(批准号0000262)。
1.3 药品与试剂
香丹注射液(批号110401)购自河南同源制药有限公司;对照品丹酚酸A(批号DST201109-008)、丹酚酸B(批号DSTDD000901)、丹酚酸C(批号DST200302-010)、迷迭香酸(批号DSTDM002701)、紫草酸(批号DST201209-028)购自成都德斯特生物技术有限公司,质量分数均≥98%;C48/80(批号088M4120V)、对硝基苯基--乙酰基-β--葡糖酰胺(批号1002575112)购自美国Sigma公司;Triton X-100(批号EZ1609D315)购自BioFroxx公司;CCK-8(批号PN558)购自日本株式会社会同仁化学研究所;RPMI 1640培养基(批号AF29546226)、胎牛血清(fetal bovine serum,FBS,批号DD19099560)购自Hyclone公司;胰酶(批号2114092)、盐酸(批号20140703)购自北京利维宁生物科技有限公司;PBS(批号2126176)购自BI公司;改良台式液(批号20211019)、0.1 mol/L柠檬酸钠缓冲液(批号20200728)购自北京索莱宝科技有限公司;Na2CO3(批号20160616)、NaHCO3(批号20170216)均购自北京化工厂;NaOH(批号20200701)购自天津市大茂化学试剂厂;邻苯二甲醛(批号K2024111)购自上海阿拉丁生化科技有限公司;甲醇(批号100296)购自Honeywell公司;Fluo-8 AM新型钙离子荧光探针检测试剂盒(批号2021A0JC0012)购自北京普利莱基因技术有限公司。
1.4 仪器
LB942S型多功能微孔板检测系统(Berthold公司);SW-CJ-2D型细胞操作超净台(苏州净化设备有限公司);3111型CO2培养箱(美国Thermo Fisher Scientific公司);DHP-9052型电热37 ℃恒温培养箱[中仪国科(北京)科技有限公司];XMTD-6000型三用电热恒温水箱(北京长风仪器仪表公司);3K18型小型台式冷冻离心机(美国Sigma公司);ASV-3023型灭菌蒸气高压锅(Sakura公司);Scepter型手持细胞计数仪、ScepterTMSensors-60 μm细胞计数芯片(美国Millipore公司);Axio Vert A I型半自动倒置研究级显微镜(CARL ZEISS公司)。
2 方法
2.1 分子对接
在Uniport数据库中(https://www.uniprot.org/)下载蛋白质PDB结构。利用ChemDraw 20.0和Chem3D 20.0软件绘制化合物结构并将结构扭转得到化合物mol2结构。利用Auto Dock软件对分子进行去水、加氢后进行分子对接,通过Auto Dock Tools Vina进行分子对接评价靶蛋白和化合物之间的相互作用,并利用Ligplot进行可视化处理。
2.2 细胞毒性实验
P815细胞用含1%青霉素-链霉素、10% FBS的RPMI 1640培养基,于37 ℃、5% CO2的培养箱中进行培养。取处于对数生长期的细胞,以4×104个/孔接种到96孔板中,于培养箱中孵育过夜,另设调零组不接种细胞。香丹注射液临床使用需将原液稀释25倍,以该质量浓度为最高质量浓度,将最高质量浓度以10倍梯度稀释,共稀释8个质量浓度;各给药组分别加入200 μL 8个稀释倍数的香丹注射液以及100、50、12.5、3.125、0.781 25 μg/mL的丹酚酸A、丹酚酸B、丹酚酸C、迷迭香酸、紫草酸,对照组加入200 μL含1%青霉素-链霉素、10% FBS的RPMI 1640培养基,孵育1 h。孵育结束后,弃去药物,每孔加入110 μL CCK-8试剂,37 ℃孵育2 h,采用酶标仪测定490 nm处的吸光度()值,并计算抑制率。
抑制率=1-(给药-调零)/(对照-调零)
2.3 组胺(histamine,His)释放试验
取处于对数生长期的细胞,以4×104个/孔接种到黑色不透光96孔板中,孵育过夜,另设调零组不接种细胞。设置对照组、C48/80组和各给药组,调零组和对照组每孔加入200 μL改良台式液,C48/80组加入200 μL C48/80(30 μg/mL),各给药组分别加入200 μL高、低剂量(1∶25、1∶250)的香丹注射液稀释液及高、低剂量(50、5 μg/mL)的丹酚酸A和高、低剂量(100、10 μg/mL)的丹酚酸B、丹酚酸C、迷迭香酸、紫草酸,孵育1 h。裂解组加入200 μL 1% Triton X-100,每孔取100 μL放入黑色不透光96孔板中,每孔加入20 μL 1 mol/L NaOH,再加入20 μL 1%邻苯二甲醛底物,37 ℃孵育15 min,加入20 μL 1 mol/L盐酸终止反应,立即采用酶标仪m/x=350/460测定各组值,并计算His释放率。
His释放率=(样品上清-调零)/(裂解-调零)
2.4 β-氨基己糖苷酶(β-hexosaminidase,β-Hex)释放试验
按“2.3”项下方法进行分组和给药,孵育1 h,裂解组加入200 μL 1% Triton X-100,取上清液50 μL加到1个新的96孔板,每孔加入50 μL对硝基苯基--乙酰基-β--葡糖酰胺显色底物制剂(1.70 mg/mL),37 ℃孵育1.5 h,每孔加入150 μL Na2CO3/NaHCO3终止液,采用酶标仪测定405 nm处的各组值,并计算β-Hex释放率。
β-Hex释放率=(样品上清-调零)/(裂解-调零)
2.5 小鼠后爪外渗实验验证
丹酚酸B及紫草酸高质量浓度下均可显著刺激P815细胞释放His和β-Hex,因此进行小鼠局部类过敏反应进行验证。雄性ICR小鼠56只随机分为C48/80(13.0 μg/kg)组及丹酚酸B高、中、低剂量(43.5、21.7、10.9 μg/kg)组和紫草酸高、中、低剂量(43.5、21.7、10.9 μg/kg)组,每组8只。小鼠iv 0.4%伊文思蓝盐水(10 mL/kg),5 min后将10 μL生理盐水注射到左爪中作为对照,将10 μL含各质量浓度待测药物的生理盐水注射到右爪中。15 min后,收集爪组织,37 ℃干燥24 h后称定质量,剪碎,置于800 µL丙酮-生理盐水(7∶3)溶液中。65 ℃孵育12 h,5000 r/min离心取上清液,取200 µL移至96孔板中,于620 nm处测定值。
2.6 甲苯胺蓝染色观察细胞形态变化
将细胞爬片放入6孔板中,P815细胞以1.8×106个/孔接种到爬片上,孵育过夜。对照组每孔加入600 μL改良台式液,C48/80组加入30 μg/mL C48/80,丹酚酸B高、中、低剂量(100、50、10 μg/mL)组和紫草酸高、中、低剂量(100、50、10 μg/mL)组每孔加入200 μL待测药物,孵育1 h。取出爬片,于4%多聚甲醛溶液中固定,滴加甲苯胺蓝进行染色,于显微镜下观察并拍照。
2.7 细胞内Ca2+动员实验
取处于对数生长期的细胞,以4×104个/孔接种到黑色不透光96孔板中,孵育过夜,另设调零组不接种细胞。设置对照组、C48/80组和各给药组,调零组和对照组每孔加入200 μL钙离子荧光探针试剂盒内稀释缓冲液,C48/80组加入200 μL C48/80(30 μg/mL),各给药组分别加入200 μL高、中、低剂量(100、25、6.25 μg/mL)的丹酚酸B、紫草酸,孵育1 h。弃去上清液,每孔加入100 μL Fluo-8 AM工作液,37 ℃孵育40 min,用稀释缓冲液洗涤细胞2次,每孔加入200 μL稀释缓冲液,立即采用酶标仪m/x=490/514测定各组值。
2.8 统计学分析
3 结果
3.1 分子对接
配体与受体结合能量越低,配体与受体结合构象越稳定,结合活性越强。当结合能<−29.29 kJ/mol可推测其有强烈的结合活性[15-16]。迷迭香酸与人类Mas相关G蛋白偶联受体X2(Mas-related G protein-coupled receptor X2,MRGPRX2)结合能接近该标准,且与小鼠MRGPRb2结合能<−29.29 kJ/mol,本研究以−25.10 kJ/mol为后续实验筛选标准[17]。如表1所示,丹酚酸A、丹酚酸B、丹酚酸C、紫草酸和迷迭香酸与MRGPRX2和MRGPRb2结合位点的结合能均≤−25.10 kJ/mol。丹酚酸B、紫草酸与MRGPRX2/MRGPRb2分子对接见图1、2。
3.2 细胞毒性实验
如图3所示,丹酚酸A在100 μg/mL对P815 细胞生长抑制率为42.99%,其余药物及组分对P815细胞无明显毒性作用。为确保筛选实验的准确性,减少细胞毒性作用对后续实验的影响,药物对P815细胞的生长抑制率≤20%,故以香丹注射液原液稀释25倍为最高质量浓度(1∶25),丹酚酸A以50 μg/mL为最高质量浓度,丹酚酸B、丹酚酸C、紫草酸、迷迭香酸以100 μg/mL为最高质量浓度。
表1 核心成分与MRGPRX2/MRGPRb2的分子对接
Table 1 Molecular docking of core components with MRGPRX2/MRGPRb2
蛋白化合物结合能/(kJ·mol−1) MRGPRX2丹酚酸B−35.98 紫草酸−35.12 丹酚酸C−32.64 丹酚酸A−29.71 迷迭香酸−28.03 原儿茶醛−23.85 丹参素−22.59 咖啡酸−20.92 原儿茶酸−20.08 MRGPRb2丹酚酸C−35.15 紫草酸−32.64 丹酚酸B−31.80 丹酚酸A−30.54 迷迭香酸−30.12 丹参素−24.27 咖啡酸−23.01 原儿茶酸−20.50 原儿茶醛−20.08
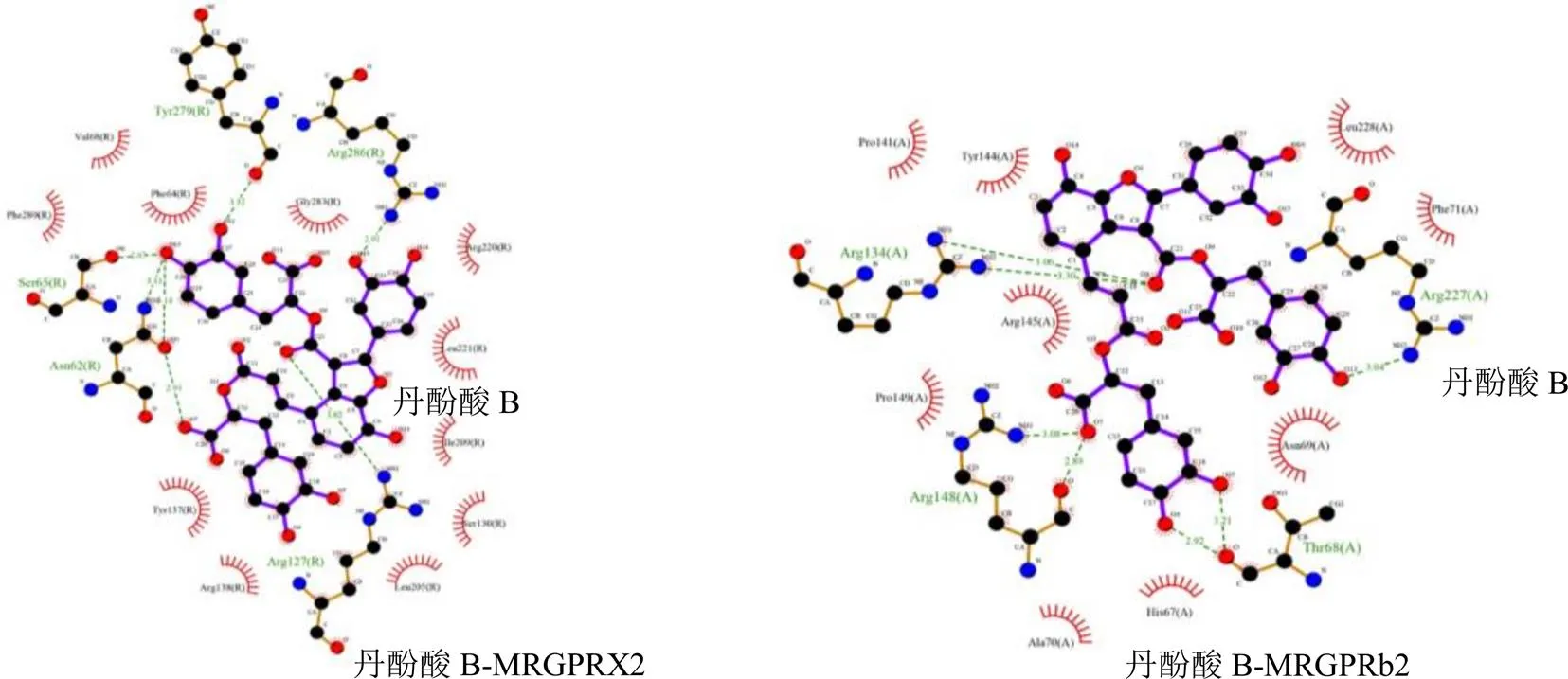
图1 丹酚酸B与MRGPRX2/MRGPRb2分子对接可视化
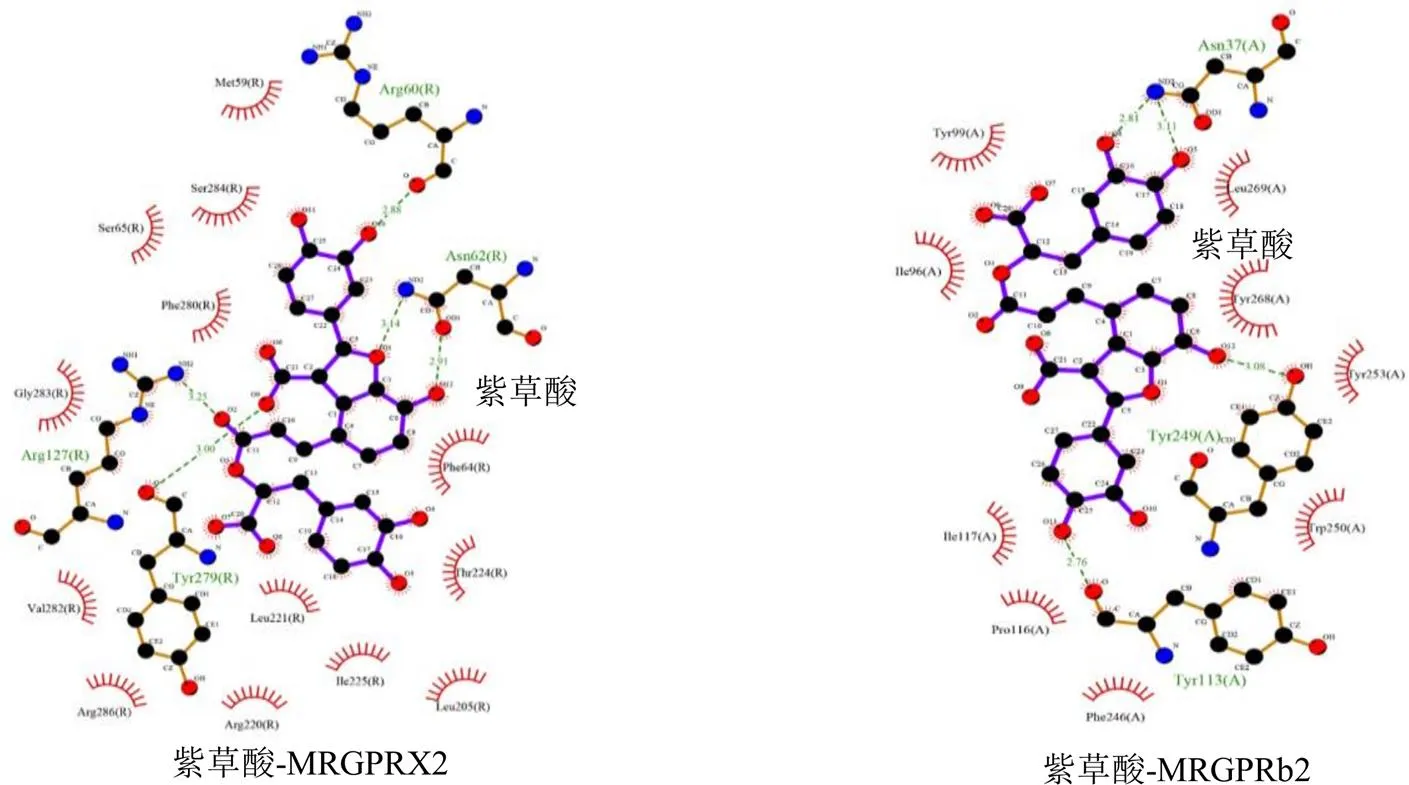
图2 紫草酸与MRGPRX2/MRGPRb2分子对接可视化
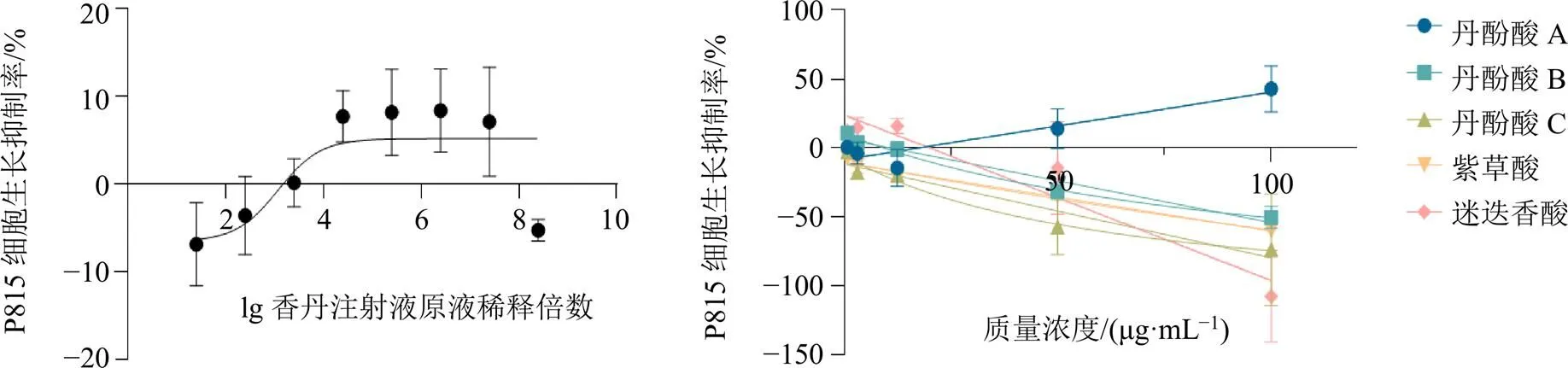
图3 香丹注射液及其各组分对P815细胞毒性测定
3.3 His及β-Hex释放实验
如图4所示,香丹注射液高、低剂量组及丹酚酸B高剂量组和紫草酸高剂量组均能显著刺激P815细胞释放His(<0.01),且呈剂量相关性;而丹酚酸A高、低剂量组能够显著抑制P815细胞释放His(<0.01)。
如图5所示,香丹注射液、丹酚酸B、紫草酸、迷迭香酸的高、低剂量组和丹酚酸C高剂量组均能显著刺激P815细胞释放β-Hex(<0.05、0.01),且呈剂量相关性;丹酚酸A高剂量组显著刺激P815细胞释放β-Hex(<0.01),而丹酚酸A低剂量组抑制P815细胞释放β-Hex(<0.01)。根据His释放率及β-Hex释放率增加倍数对其致敏可疑程度进行排序(表2),丹酚酸B及紫草酸可能是香丹注射液中潜在的致类过敏组分。
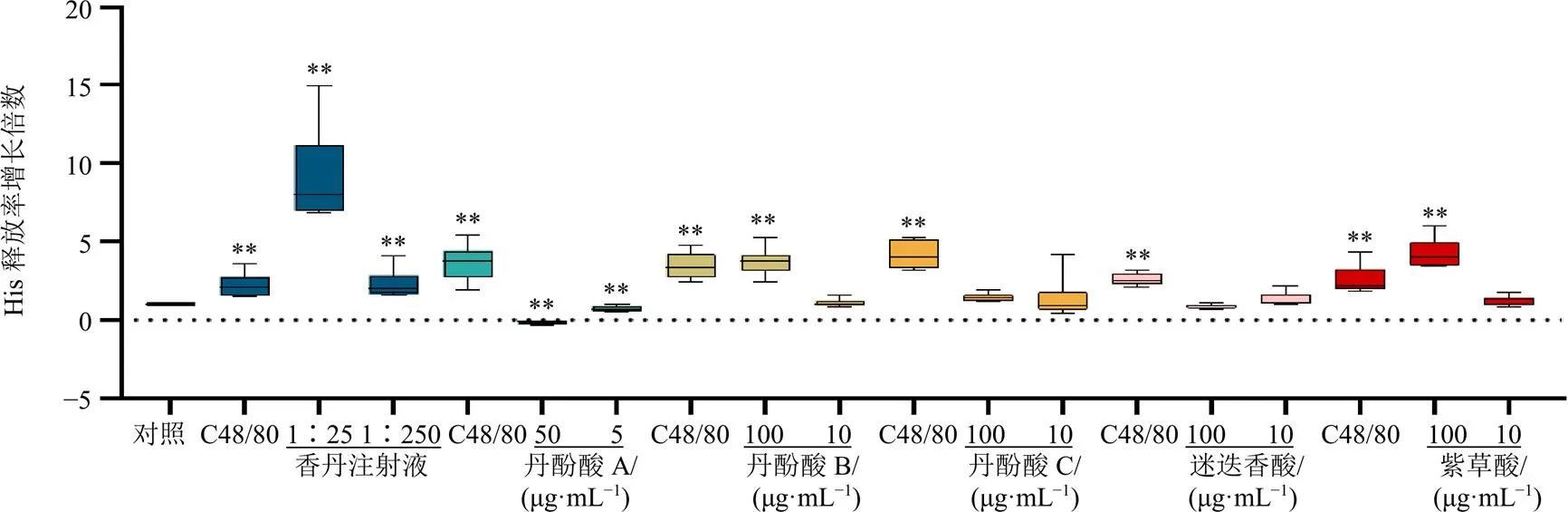
与对照组比较:**P<0.01

与对照组比较:*P<0.05 **P<0.01
3.4 小鼠后爪外渗试验验证及细胞形态变化
如图6所示,观察小鼠后右爪注射C48/80以诱导局部类过敏反应,伊文思蓝渗出增加,右爪相较仅注射生理盐水的左爪蓝色更深,丹酚酸B高、中剂量组和紫草酸高剂量组均能显著提高小鼠后爪伊文思蓝渗出程度(<0.05、0.01)。
如图7所示,对照组细胞完整,边缘光滑,结构致密;C48/80组细胞边缘不整,背景中出现大量的蓝色颗粒样物质;丹酚酸B组和紫草酸组诱导P815细胞脱颗粒呈剂量相关性减弱,表明丹酚酸B和紫草酸可能是致类过敏物质。
表2 致类过敏可疑程度
Table 2 Suspicious degree of induction of anaphylactic reaction
组别剂量刺激His释放刺激β-Hex释放 香丹注射液1∶25+++ 1∶250+- 丹酚酸A50 μg·mL−1-- 5 μg·mL−1-- 丹酚酸B100 μg·mL−1+++ 10 μg·mL−1-+ 丹酚酸C100 μg·mL−1-+ 10 μg·mL−1-- 紫草酸100 μg·mL−1+++ 10 μg·mL−1-- 迷迭香酸100 μg·mL−1-- 10 μg·mL−1--
-:与对照组比较,His释放率增长倍数()≤2,β-Hex释放率增长倍数()≤5;+:2<≤5,5<≤20;++:>5,>20
-: His release rate increased multiple ()≤ 2control group,β-Hex release rate increased multiple () ≤ 5control group; +: 2<≤ 5, 5<≤ 20;++:>5,>20
3.5 细胞内Ca2+动员试验结果
如图8所示,丹酚酸B高剂量组和紫草酸高剂量组刺激P815细胞后胞内Ca2+浓度显著升高(<0.05),表明丹酚酸B和紫草酸诱导的类过敏反应可能与动员Ca2+内流相关。
4 讨论
类过敏反应与I型超敏反应临床表症相似,但不会引起抗原特异性免疫反应。类过敏反应可以通过直接刺激或激活补体系统间接刺激肥大细胞和嗜碱性粒细胞释放活性介质而被诱导,还可通过激活Ca2+相关信号通路释放活性介质而被诱导[18-19]。MRGPRX2/MRGPRb2是一种在肥大细胞上表达的A类G蛋白偶联受体,可以活化非IgE介导的肥大细胞,研究已证明罗库溴铵等几种FDA批准的阳离子药物的类过敏反应与其相关,MRGPRX2/ MRGPRb2是类过敏反应的关键靶标,并可在体外通过MRGPRX2对体内假过敏反应的发生进行预测[20-23]。将酚酸类物质与MRGPRX2/MRGPRb2进行分子对接评估,发现丹酚酸A、丹酚酸B、丹酚酸C、紫草酸和迷迭香酸与MRGPRX2/MRGPRb2结合位点的结合力较高,其中丹酚酸B、紫草酸和丹酚酸C的结合排于前3,故选择丹酚酸A、丹酚酸B、丹酚酸C、紫草酸和迷迭香酸这5个单体进行类过敏反应物质筛选。
本研究使用P815细胞,因其表面没有高亲和性的IgE Fc段受体,更适合作为类过敏反应肥大细胞脱颗粒检测模型[24]。C48/80是常用的诱导细胞脱颗粒的药物,能够通过MRGPRX2诱导肥大细胞活化。MRGPRX2可以通过激活磷脂酶C信号通路诱导Ca2+动员,激活G蛋白,促使肥大细胞胞吐,合成磷脂酰肌醇3-激酶,并形成花生四烯酸代谢物,激活Ca2+通道和蛋白激酶C,胞内Ca2+水平升高,发生脱颗粒现象并释放介质,此外补体系统激活产生C3a和C5a,C3a和C5a在动员Ca2+方面具有高活性[25]。本研究结果显示,香丹注射液在一定剂量下可以诱导P815细胞释放His、β-Hex介质,且在香丹注射液中筛选出其单体成分丹酚酸B及紫草酸可以诱导P815细胞脱颗粒,并释放His、β-Hex介质。本研究中丹酚酸A低剂量组可显著抑制P815细胞释放His和β-Hex,Jeon等[26]发现丹酚酸A可以降低二硝基氯苯诱导的BALB/c小鼠血清中IgE水平,可能具有抗过敏作用,本研究结果与文献报道较一致。在小鼠后爪外渗验证实验中,当小鼠发生类过敏反应时,其皮肤血管壁通透性升高,伊文思蓝可与血浆蛋白结合,渗出血管外,表现出组织蓝染,丹酚酸B高、中剂量组和紫草酸高剂量组均可导致小鼠后爪血管通透性增加,类过敏反应发生,这一结果与分子对接结果相互对应。Ca2+内流对His释放和肥大细胞脱颗粒有显著影响[27],丹酚酸B和紫草酸高剂量组刺激P815细胞后,胞内Ca2+浓度显著升高,香丹注射液诱导的类过敏反应可能与丹酚酸B和紫草酸有关。
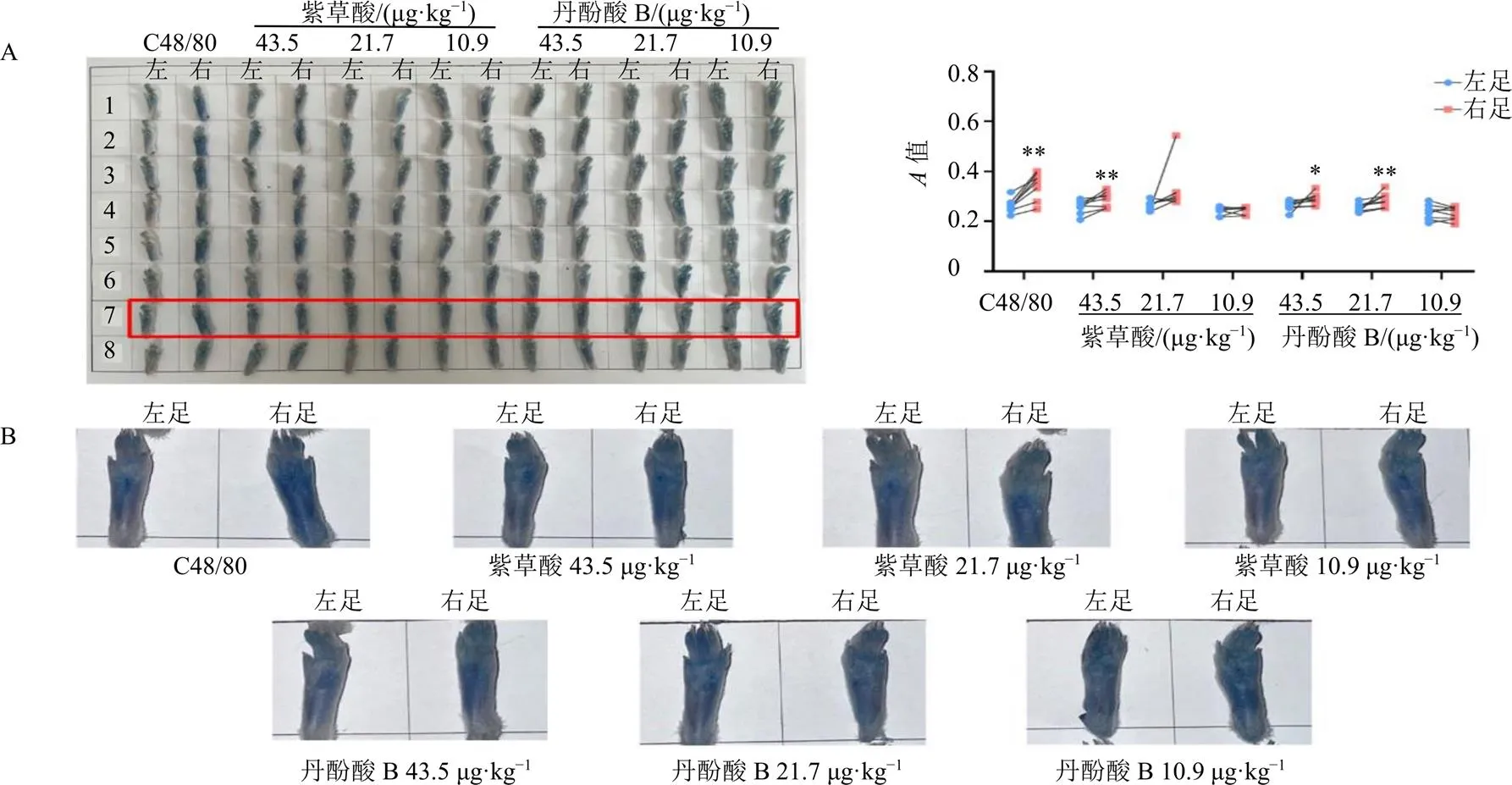
图B为图A红色框内各组局部放大图,与左足比较:*P<0.05 **P<0.01
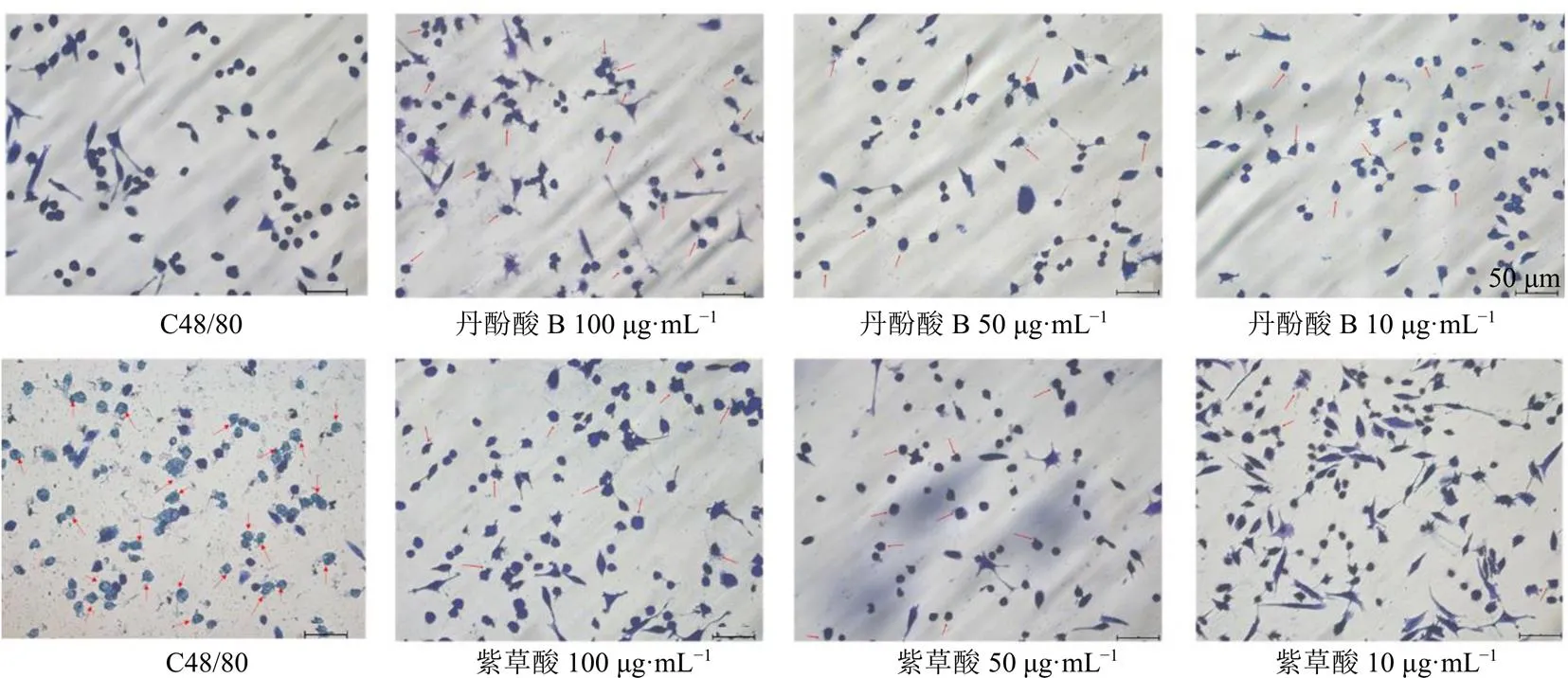
图7 丹酚酸B及紫草酸刺激P815细胞脱颗粒变化
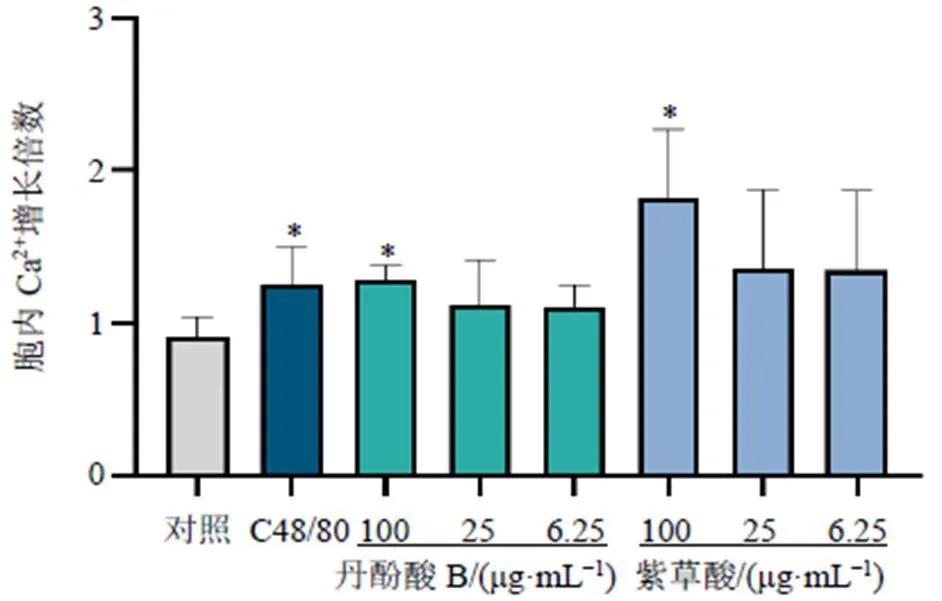
与对照组比较:*P<0.05
紫草酸是一种具有神经保护、肝保护、心脏保护等多种生物活性的天然产物[28]。丹酚酸B是丹参中丹酚酸类里含量最丰富、最具生物活性的成分之一,富含丹酚酸B的相关药物广泛用于各种心血管疾病的临床治疗,丹酚酸B还可通过抑制过敏诱导的气道黏蛋白MUC5AC过表达来改善气道高反应性[29-30]。在丹参水提液中,丹参酚酸类成分不稳定,易发生降解和相互转化。丹酚酸B是水溶性酚酸中含量最高的成分,在不同温度(80~210 ℃)下,其呋喃环相连酯键发生水解反应,生成紫草酸和丹参素,且随温度升高水解反应程度增加[31]。在高温高压处理丹酚酸B水溶液时,紫草酸含量会先升高再降低,可能与丹酚酸B和紫草酸之间存在可逆反应有关,且紫草酸也会发生降解反应,形成丹参素、丹酚酸A、原儿茶醛[31-32]。目前尚无有关丹酚酸B和紫草酸单体致超敏反应的报道,其具体机制仍需进一步研究,同时本研究发现丹酚酸A具有一定的抗类过敏作用,当丹酚酸B、紫草酸与丹酚酸A同时存在的致敏作用或者抗过敏作用也值得进一步深入探索。
随着香丹注射液广泛应用,其不良反应备受临床重视。香丹注射液致敏反应受多种因素影响[33-34]:①鞣质是结构复杂的多元酚类化合物,含有大量的酚羟基或羧基,因其结构与香丹注射液中活性成分相似,不易完全分离,生产过程中产生的鞣质可作为半抗原在体内与大分子蛋白结合形成复合物引起过敏反应,或者通过共激活激肽释放酶-激肽系统、凝血、补体途径诱导类过敏反应;②辅料聚山梨酯80可诱导类过敏反应;③选择生理盐水作为溶媒可能会产生不溶性颗粒;④联合用药可诱导超敏反应发生率增加;⑤其活性成分可能作为半抗原诱导过敏反应或直接诱导类过敏反应。在卫生部颁药品标准中药成方制剂(WS3-B-3289-98)中仅要求对香丹注射液中原儿茶醛含量进行定量分析[35]。丹酚酸B和紫草酸诱导的P815细胞脱颗粒释放介质具有剂量相关性,为提高香丹注射液临床使用的安全性,在确保制剂有效性的前提下有必要对其潜在的致敏物质进行限量标准研究,重视各酚酸类的相互转化,改善制剂工艺,以进一步提高香丹注射液的安全性。
利益冲突 所有作者均声明不存在利益冲突
[1] 文雯, 梁慧慧, 余格, 等. 中药注射剂类过敏反应研究进展 [J]. 湖南中医药大学学报, 2020, 40(1): 117-122.
[2] Zhao Y, Sun S S, Li X T,. Drug-induced anaphylaxis in China: A 10 year retrospective analysis of the Beijing Pharmacovigilance Database [J]., 2018, 40(5): 1349-1358.
[3] Huang R, Cai Y X, Yang L H,. Safety of traditional Chinese medicine injection based on spontaneous reporting system from 2014 to 2019 in Hubei Province, China [J]., 2021, 11(1): 8875.
[4] 徐曼, 刘爱华, 崔亚君, 等. 不同厂家生产的香丹注射液中丹参色谱指纹图谱的比对研究 [J]. 中国天然药物, 2007, 5(2): 120-126.
[5] Cao J, Wei Y J, Qi L W,. Determination of fifteen bioactive components inetby high-performance liquid chromatography with ultraviolet and mass spectrometric detection [J]., 2008, 22(2): 164-172.
[6] 陈影, 吴婷, 姜超, 等. 一测多评法同时测定4种中药注射液中9种丹参酚酸 [J]. 中成药, 2021, 43(3): 590-595.
[7] 国家药品监督管理局. 药品不良反应信息通报(第45期) 警惕香丹注射液的严重不良反应 [EB/OL]. [2012-03-23]. https://www.nmpa.gov.cn/xxgk/yjjsh/ypblfytb/ 20120323162201191.html.
[8] 国家药品监督管理局. 国家药品不良反应监测年度报告(2021年) [EB/OL]. [2022-03-30]. https://www.nmpa. gov.cn/xxgk/yjjsh/ypblfytb/20220329161925106.html.
[9] 国家药品监督管理局. 国家药品不良反应监测年度报告(2013年) [EB/OL]. [2014-05-14]. https://www.nmpa. gov.cn/directory/web/nmpa/xxgk/yjjsh/ypblfytb/20140514161301843.html.
[10] 徐春丽, 丁丽萍, 郑志昌, 等. 复方丹参注射液致不良反应119例文献分析 [J]. 中国医院药学杂志, 2005, 25(9): 896-897.
[11] 柴丽娟, 蔺新英. 静脉滴注香丹注射液致严重过敏反应4例临床分析 [J]. 齐鲁护理杂志, 2015, 21(21): 122-124.
[12] 徐春丽, 孙怡, 丁丽萍, 等. 复方丹参与低分子右旋糖酐混合静脉滴注致严重ADR分析 [J]. 中国药物滥用防治杂志, 2008, 14(6): 361-365.
[13] Li E C, Lin N, Hao R R,. 5-HMF induces anaphylactoid reactionsand[J]., 2020, 7: 1402-1411.
[14] 李恩灿, 范潇予, 林琳, 等. 5-羟甲基糠醛及其二聚体OMBF引发I型超敏反应毒性评价与机制初探 [J]. 中国比较医学杂志, 2020, 30(2): 1-8.
[15] Trott O, Olson A J. AutoDock Vina: Improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading [J]., 2010, 31(2): 455-461.
[16] 李洵珣, 金晨, 陈康, 等. 基于网络药理学和分子对接分析丰城鸡血藤治疗乳腺癌的分子靶点和机制 [J]. 中国药理学通报, 2022, 38(5): 767-775.
[17] 亓伟钰, 李鑫, 满荣勇, 等. 基于网络药理学及分子对接技术分析蠲痹汤加减治疗类风湿关节炎的作用机制 [J]. 中医药导报, 2022, 28(4): 105-111.
[18] Zhang B, Li Q, Shi C Y,. Drug-induced pseudoallergy: A review of the causes and mechanisms [J]., 2018, 101(1/2): 104-110.
[19] Meng F J, Jiao S M, Yu B. Picroside II protects cardiomyocytes from hypoxia/reoxygenation-induced apoptosis by activating the PI3K/Akt and CREB pathways [J]., 2012, 30(2): 263-270.
[20] Kumar M, Duraisamy K, Chow B K. Unlocking the non-IgE-mediated pseudo-allergic reaction puzzle with mas-related G-protein coupled receptor member X2 (MRGPRX2) [J]., 2021, 10(5): 1033.
[21] Occhiuto C J, Kammala A K, Yang C C,. Store-operated calcium entry via STIM1 contributes to MRGPRX2 induced mast cell functions [J]., 2020, 10: 3143.
[22] John L M, Dalsgaard C M, Jeppesen C B,.prediction ofpseudo-allergenic response via MRGPRX2 [J]., 2021, 18(1): 30-36.
[23] McNeil B D. MRGPRX2 and adverse drug reactions [J]., 2021, 12: 676354.
[24] Miller L, Alber G, Varin-Blank N,. Transmembrane signaling in P815 mastocytoma cells by transfected IgE receptors [J]., 1990, 265(21): 12444-12453.
[25] Ding Y Y, Che D L, Li C M,. Quercetin inhibits Mrgprx2-induced pseudo-allergic reaction via PLCγ-IP3R related Ca2+fluctuations [J]., 2019, 66: 185-197.
[26] Jeon W J, Lee J H, Lee J E,. Salvianolic acid A suppresses DNCB-induced atopic dermatitis-like symptoms in BALB/c mice [J]., 2021, 2021: 7902592.
[27] Che D L, Wang J, Ding Y Y,. Mivacurium induce mast cell activation and pseudo-allergic reactions via MAS-related G protein coupled receptor-X2 [J]., 2018, 332: 121-128.
[28] Zhang M, Wei L, Xie S Y,. Activation of Nrf2 by lithospermic acid ameliorates myocardial ischemia and reperfusion injury by promoting phosphorylation of AMP-activated protein kinase α (AMPKα) [J]., 2021, 12: 794982.
[29] Cao W, Guo X W, Zheng H Z,. Current progress of research on pharmacologic actions of salvianolic acid B [J]., 2012, 18(4): 316-320.
[30] Guan Y, Zhu J P, Shen J,. Salvianolic acid B improves airway hyperresponsiveness by inhibiting MUC5AC overproduction associated with Erk1/2/P38 signaling [J]., 2018, 824: 30-39.
[31] 李思谦, 章顺楠, 周立红, 等. 丹参中酚酸类成分及在水溶液中降解转化研究进展 [J]. 辽宁中医药大学学报, 2020, 22(4): 109-117.
[32] Pan J Y, Gong X C, Qu H B. Quantitative1H NMR method for hydrolytic kinetic investigation of salvianolic acid B [J]., 2013, 85: 28-32.
[33] 潘恩. 香丹注射液的安全性评价与临床合理使用 [J]. 中西医结合心血管病电子杂志, 2020, 8(17): 165-166.
[34] Xu Y B, Liu C Y, Dou D Q,. Evaluation of anaphylactoid constituentsand[J]., 2017, 43: 79-84.
[35] 穆象山, 张强, 房信胜, 等. HPLC-DAD同时测定香丹注射液中7种丹参酚酸类成分 [J]. 中国中医药信息杂志, 2012, 19(12): 56-58.
Screening and preliminary mechanism of inducer of anaphylactic reaction in Xiangdan Injection
PANG Fei1, WANG Wan-wan2, HAO Rui-rui1, ZHOU Tian-yu3, CHEN Shi-zhong2, JING Hong-tao1, 4, 5
1. New Drug Safety Evaluation Center, Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China 2. School of Pharmaceutical Sciences, Peking University, Beijing 100191, China 3. Shaanxi University of Chinese Medicine, Xianyang 712046, China 4. NMPA Key Laboratory for Safety Research and Evaluation of Innovative Drug, Beijing 102206, China 5. Beijing Union-Genius Pharmaceutical Technology Development Co., Ltd., Beijing 100176, China
To screen the components induced the anaphylactic reaction in Xiangdan Injection (香丹注射液) and explore the mechanism.With human Mas-related G protein-coupled receptor X2 (MRGPRX2) and mouse MRGPRb2 as target proteins, water-soluble phenolic acids in Xiangdan Injection were docked with target protein by Auto Dock Tools Vina. P815 cells were incubated with Xiangdan Injection and its constituents of salvianolic acid A, salvianolic acid B, salvianolic acid C, rosmarinic acid and lithospermic acid for 1 h, which had high binding energy (≤ −25.10 kJ/mol) to MRGPRX2 and MRGPRb2. According to histamine (His) and β-hexosaminidase (β-Hex) release rate, possible components that may induce the anaphylactic reaction were screened out. The intracellular Ca2+mobilization and cell degranulation stimulated by salvianolic acid B and lithospermic acid were further observed. Finally, the mouse hind paw extravasation experiment was observed for verification.After P815 cells were stimulated with Xiangdan Injection (1∶25, 1∶250), salvianolic acid B (100 μg/mL) and lithospermic acid (100 μg/mL), the release of His and β-Hex were significantly increased (< 0.01). After P815 cells were stimulated with salvianolic acid B (100 μg/mL) and lithospermic acid (100 μg/mL), the intracellular Ca2+concentration was significantly increased (< 0.05), and degranulation was observed. Salvianolic acid B (43.5, 21.7 μg/kg) and lithospermic acid (43.5 μg/kg) could significantly increase the degree of Evans blue exudation in hind paw of mice (< 0.05, 0.01).The anaphylactoid reaction induced by Xiangdan Injection may be related to salvianolic acid B and lithospermic acid, and the anaphylactoid reaction induced by salvianolic acid B and shikonic acid may be related to the mobilization of Ca2+influx.
Xiangdan Injection; anaphylactic reaction; molecular docking; salvianolic acid B; lithospermic acid; P815 cells
R285.5
A
0253 - 2670(2022)20 - 6500 - 09
10.7501/j.issn.0253-2670.2022.20.022
2022-06-30
国家自然科学基金资助项目(81773996);中国毒理学会临床毒理专项资助课题(CST2021CT101)
庞 菲,硕士研究生,研究方向为药物免疫毒理学。E-mail: pangfei@imm.ac.cn
靳洪涛,博士生导师,从事药物毒理学研究。E-mail: jinhongtao@imm.ac.cn
陈世忠,博士生导师,主要从事天然药物化学研究。E-mail: chenshizhong66@163.com
[责任编辑 李亚楠]