严重急性呼吸综合征冠状病毒2变异体对全球疫情防控的影响分析*
胡尔雅 周 敏 曾雯辉 罗 燕 严紫东 马 健**
(1)中南大学肿瘤研究所,长沙 410078;2)国家卫生健康委癌变原理重点实验室,长沙 410078;3)教育部癌变与侵袭原理重点实验室,长沙 410078)
编者按由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的新型冠状病毒肺炎(COVID-19,简称新冠肺炎)流行已近3年,该病毒传染性强、传播速度快,在全球范围内对人类的身体健康和生命安全造成了严重威胁。它是目前已知的第7种可以感染人的冠状病毒,其余6种分别是HCoV-229E、HCoV-OC43、HCoV-NL63、HCoV-HKU1、SARS-CoV(引发严重急性呼吸综合征)和MERS-CoV(引发中东呼吸综合征)。当前,COVID-19疫情仍在世界范围内持续流行,奥密克戎(Omicron)毒株已取代德尔塔(Delta)毒株成为主要流行株,COVID-19患者临床表现呈现出新的特点,且针对治疗的新药物也已相继上市,治疗经验和手段得到进一步丰富。本期《生物化学与生物物理进展》刊出了5篇COVID-19研究领域论文,分别从SARS-CoV-2变异体对全球疫情防控的影响、蛋白质组学技术在COVID-19精准诊断和治疗中的发展、SARS-CoV-2膜蛋白对宿主细胞pre-mRNA 3'UTR加工的影响、基于感染力与免疫作用的新冠疫情传播模型的建立、基于处方挖掘与分子动力学模拟的SARS-CoV-2潜在抑制剂分子的筛选几个方向,评述了相关领域的研究进展或报道了作者的新近研究成果,为推进COVID-19精准防控和诊疗,及加快SARS-CoV-2特异性抗病毒药物的研发提供进一步的理论支持。特集结为《新型冠状病毒肺炎研究专题》,以飨读者。
《生物化学与生物物理进展》编辑部
2022年10 月
在首例新型冠状病毒肺炎(COVID-19,简称新冠肺炎)病例报道后的第一年,武汉野生型病毒株(Wuhan-Hu-1)在全球的流行中占主导地位。然而,自2020年末,严重急性呼吸综合征冠状病毒2(SARS-CoV-2)变异体开始涌现。至今,世界卫生组织已经定义了5种全球受关注的变异体(variants of concern,VOCs),分别命名为Alpha、Beta、Gamma、Delta和Omicron,VOCs是指能导致传染性增加、疾病更严重(例如住院或死亡人数增加)、先前感染或疫苗接种期间产生的抗体的中和作用显著降低、治疗或疫苗有效性降低或诊断检测失败的变异体。VOCs逐渐成为了优势病毒株,并给全球的COVID-19疫情防控提出了挑战。为应对重大挑战,需要深入了解SARS-CoV-2基因组的突变来自何处,要走向何方,也需要总结经验提出应对策略。
1 突变概况
病毒突变(或变异)受到多因素的驱动,突变率在3个水平上受到调节:a.病毒自身性质,包括基因组序列背景、模板二级结构、复制机制、校对和修复机制等;b.宿主-病毒相互作用;c.自然选择。自然选择是SARS-CoV-2中一些流行广泛突变的产生机制,这使病毒在进化中具有适应性[1]。在西班牙COVID-19流行早期,创始人效应被认为在19B进化枝的流行上起到重要作用[2]。300 000多个SARS-CoV-2变异体的基因组序列分析结果表明,SARS-CoV-2的进化中,纯化选择占据主导地位,也存在一部分的正选择[3]。自然选择在病毒进化过程中至关重要,其如何影响受关注的变异体出现和持久性需要进一步的研究。
RNA病毒较DNA病毒容易发生突变,RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRp)缺乏DNA聚合酶拥有的校对功能是一大原因。SARS-CoV-2以每月累计两个替换的速度进化[4],变异以3种形式出现:点突变、基因重组和表观遗传学修饰。其中,点突变最常见。来源于351 525个完整病毒基因组序列的SARS-CoV-2的突变谱显示,C>U的发生率远高于U>C的替换,G>U的发生率也高于U>G的替换,这种不对称的突变谱相对罕见[5]。其形成可能与宿主的载脂蛋白B编辑复合物、作用于RNA的腺苷脱氨酶等相关[6]。此外,活性氧通过将鸟嘌呤氧化成8-氧鸟嘌呤介导了G>U的替换[7]。但是,随着选择的进行,C对U和G对U取代的比例趋于降低,因为SARS-CoV-2的替代谱是由多种因素相互作用决定的,包括复制过程的内在偏差、避免CpG二核苷酸等因素[8]。此外,重组是冠状病毒重要的进化机制,且冠状病毒基因组大,这使得重组事件发生频率更高[9]。重组常发生在同一宿主细胞同时被具有遗传异质性即来源于不同谱系的病毒侵入时,由于病毒复制过程中模板链发生改变而形成杂交RNA[10]。SARS-CoV-2的重组现象已经在多个证据中得到了证实。有研究表明,SARS-CoV-2的整个受体结合基序(receptor binding motif,RBM)是通过与穿山甲的冠状病毒重组引入的[11],一个重组和适应性进化分析新框架也识别到SARS-CoV-2在转移到人类之前发生的几次重组事件[12]。在马来西亚1例COVID-19患者体内分离出了新型犬冠状病毒,而且刺突基因是猫和狗冠状病毒重组产物[13]。需要警惕现有的VOCs发生重组,造成更严重的后果。此外,重组RNA修饰是常见的,不同的生存环境下,抗病毒活性以及RNA修饰活性存在不同,即选择性压力揭示病毒进化场所,例如,SARS-CoV-2基因组的CpG二核苷酸分布很大程度提示了病毒重组[14]、CpG岛含量与进化相关[11],SARS-CoV-2 CpG岛缺乏严重表明其可能已经在抗病毒CpG检测蛋白[15]锌指抗病毒蛋白(zinc finger antiviral protein,ZAP)高表达的宿主中进化过[16]。另外,研究人员发现,SARS-CoV-2转录本存在潜在的表观遗传学修饰位点,尤其是“AAGAA”基序,且修饰位点的增多可以使得转录本的poly(A)尾缩短,这意味着转录本的稳定性将会下降,可能是病毒逃避宿主免疫应答的机制之一,并且报道了多种融合转录本的出现[17]。蛋白质的翻译后修饰也同样存在可能,比如刺突蛋白(spike protein,S蛋白)Ser-816位点由于其暴露程度是可能的修饰位点[18]。
宿主和病毒间的相互作用是病毒变异方向的重要影响因素,SARS-CoV-2在同一宿主不同细胞内的进化有着多样性[19],在种群瓶颈事件驱动下,不同器官间的病毒种群也存在着遗传多样性[20]。宿主免疫反应是病毒进化的驱动因素,免疫抑制患者感染SARS-CoV-2后,病毒可能长期存在于患者体内并累积突变,更有可能产生潜在有害的SARS-CoV-2变异体[21]。现已发现,人类免疫缺陷病毒感染的患者感染SARS-CoV-2后可以产生多种已知变异体上存在的突变,并且产生对疫苗和中和抗体(neutralizing antibodies,nAbs)的耐性[22]。因而,免疫抑制人群可能是潜在有害变异体的来源。但值得注意的是,对来自英国的1 313个临床样本进行深度测序发现,一致且可重复的宿主SARS-CoV-2多样性模式,病毒载量高时宿主内多样性反而低,因此,尽管SARS-CoV-2在宿主内的突变已经得到证实,也很可能无法传播[23]。所以,广泛流行的变异体来源于宿主还是环境仍不清楚。
早期SARS-CoV-2突变的功能分析表明,其进化是朝着增强传染性和降低毒力的方向发展的[24]。Wang等[25]通过追踪220万个SARS-CoV-2基因组突变情况和欧美的疫苗接种率,提出新的病毒进化机制——疫苗突破或抗体抗性突变,在群体免疫的背景之下这趋向于成为SARS-CoV-2进化的主要机制。Beta和Delta携带某些突变位于具有免疫原性的抗原位点,可能主要是由于抗体介导的抗体抗性突变[26]。Omicron S蛋白的“关闭”状态可能通过封闭高免疫原性位点来进行免疫逃避[27]。感染Delta的患者在接受Sotrovimab治疗后发现其体内与Sotrovimab耐药相关的病毒尖峰基因迅速增加[28]。应当注意这些患者接受治疗后是否体内存在携带潜在有害突变的变异体,并在不知情的情况下发生传播。因而,这给全球的疫情防控提出了挑战。但是,免疫水平的提高可能会加速抗原进化的速度,从而增加再感染的风险,并可能增加再感染的疾病严重程度[29]。具体来说,VOCs的稳定性、传播能力和适应性、致病性的进化方向总结如下。
SARS-CoV-2变异体把增加开放S蛋白构象的动力学稳定性作为一种进化策略[30]。Alpha S蛋白的P681H产生了一个弗林蛋白酶(furin)切割位点,几乎完全切割的Alpha S蛋白比武汉野生型病毒株以及Beta S蛋白更稳定,从而产生更稳定的S蛋白/血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)复合物,Omicron也有P681H突 变[31]。Beta S蛋 白 稳 定 性 与G614相 似[32],Delta的L452R突变增加了S蛋白稳定性[33]。
Li等[34]介绍了一种评价RNA病毒的人类适应性手段,预测Alpha具有低传播性高致病性的I型适应特征,Beta、Gamma和Omicron具有高传播性低致病性的II型适应特征。Alpha在人类支气管上皮较G614的复制能力更强[35],Alpha气溶胶传播能力较SARS-CoV-2 A谱系强[36],且传播率随年龄和病毒载量而增加[37]。在叙利亚仓鼠竞争和传播实验中,Alpha的适应性与G614无明显差异[32]。Beta在竞争实验中被Alpha和G614竞争,二者复制动力学类似,因此Beta的适应度较G614、Alpha低[38-39]。巴西马瑙斯地区的Gamma可传播性可能比之前变异体高1.7~2.4倍[40]。与野生型受体结合域(receptor binding domain,RBD)相比,Delta具有更高的传播性[41],通过数据拟合数学传播模型,研究者发现Delta在家庭中的传播速度比Alpha更快,这可归因于家庭中易感个体的消耗更快以及内在生成时间可能减少[42]。中国大陆首次局部感染Delta展现出较之前的变异体更高的病毒复制效率和体内病毒载量[43]。通过测量临床样本中传染性病毒滴度和病毒RNA水平,Delta的传染性都显著高于Alpha[44]。在复制竞争试验中,Delta气道类器官和人类气道上皮中胜过Alpha[45]。概括来说,增强的ACE2亲和力、增强S蛋白以及S蛋白/ACE2复合物的稳定性、增加RBD倾向“向上”构象、增强的S蛋白切割能力都可能增加感染能力和适应性。
Alpha[46]、Gamma[47]与ACE2的亲和力较野生型更高,与RBD和ACE2的适配更高相关,但是Alpha的S蛋白更倾向于维持“关闭”的构象,不 利 于 受 体 结 合 和 细 胞 进 入[46]。而Beta[46]、Delta[41]、Omicron[26]与ACE2亲和力与野生型类似,可能因为不同的突变在改变与ACE2亲和力上的作用相互抵消,Omicron RBD的突变R493、S496和R498与ACE2形成的新盐桥和氢键增强了亲和力[48],S477N和N501Y也增加了亲和力,而K417N、G446S、E484A、G496S和Y505H取代降低了亲和力[41]。同时,可能免疫压力在突变选择中起到主要作用,比如Beta同时改变了S三聚体上的两个主要中和位点,与ACE2亲和力变化不显著[46]。Beta S蛋白的冷冻电镜揭示其所有三聚体均采用开放构象,而野生型83%呈封闭形式,K417N是可能的驱动因素[31]。Delta中的T478K替代可以通过在该环内与N487形成新的氢键,来稳定和重塑RBM环,并使得RBM环带更多的正电,有利于与带负电的ACE2结合,这样一来,结合亲和力增加以及“向上”构象的倾向增加使得Delta传播性增加[49]。也可能与其偏质子化的S蛋白有利于摆脱在肺泡巨噬细胞M2内体中的长期停留相关[50]。在仓鼠感染模型中,Gamma和Omicron S蛋白H655Y突变增强了病毒复制、S蛋白切割[51],Delta L452R[33]、P681R[52]均有利于S蛋白的切割,L452R突变是唯一Delta有而Omicron没有的RBD突变,发现Omicron L452R通过增强S蛋白的切割来增强融合性,并促进细胞进入以增强感染性[53]。
Delta的致病性是VOCs中最高的,而Omicron的致病性最低。在恒河猴模型中,Alpha导致的临床表现与D614G相似,较Beta导致的临床表现重[54]。一项英格兰队列纳入839 278个病例研究显示,与野生型病毒株相比,感染Alpha的患者住院风险更高[49]。而在K18-hACE2转基因小鼠中,Beta感染后的致 死 率 较614D高100倍[55]。一 项43 338名英国队列研究显示,与Alpha相比,感染Delta的COVID-19患者的住院或急诊就诊风险更高[56]。Delta增 强 的 致 病 性 与P681R有 关[57]。Omicron主导流行期间南非住院患临床特征和结局与之前变异株流行期间相比,严重程度和死亡率降低[58]。一项来自英格兰的队列研究也报告Omicron感染后出现严重后果的风险大大低于Delta[59]。
实际上,谱系替换与多种因素相关,包括传播性、免疫逃避、非药物干预、先前感染和区域间流动性等。通过总结突变概况(图1),对突变驱动因素、表现形式和方向有了初步的了解。
2 受关注的变异体——Omicron
2021年11月11 日,博茨瓦纳报告了首例Omicron(B.1.1.529)测序病例。现已取代其他受关注的VOCs成为优势病毒株(图2)。Omicron是全球第5个受关注的VOCs,是迄今变异最多的VOCs,现有3个谱系(BA.1、BA.2、BA.3),BA.1谱系基因组相对于Wuhan-Hu-1参考毒株即野生型累积了53个突变,包括了A67V、Δ69-70、T95I、G142D、Δ143-145、Δ211、L212I、插 入214EPE、G339D、S371L、S373P、S375F、K417N、N440K、G446S、S477N、T478K、E484A、Q493R、G496S、Q498R、N501Y、Y505H、T547K、D614G、H655Y、N679K、P681H、N764K、D796Y、N856K、Q954H、N969K和L981F,在Omicron刺突基因的30~37个非同义核苷酸替换中,有13个在其他SARS-CoV-2序列中很少见[60],有15个氨基酸变化位于RBD,与野生型相比,Omicron变异体与人ACE2具有相当的结合亲和力,但比Delta变异体的结合亲和力弱 得 多[61]。N端 结 构 域(N-terminal domain,NTD)的变化尤其显著,这导致了其抗原性发生了重大的改变。除了抗原结构的改变,S蛋白RBD的更封闭稳定也是导致传播性增强的因素[62],Omicron的P681H突变产生furin切割位点可以促进S蛋白的切割,除了P681H,野生型病毒株Asn856变成了Omicron S蛋白中的Lys853,Asn764和Thr547分 别 变 成Omicron S蛋 白 中 的Lys761和Lys544,引入了新的域间和亚基间相互作用,也使得Omicron开放的S蛋白比野生型病毒株更紧[63]。Omicron的冷冻电镜结果也表明其稳定性较其他变异体增加,在环境中存在更持久,可以解释更高的家庭传播风险,稳定性的增加同时提高了受体识别效率,然而也会导致病毒膜融合效率下降[64]。虽有P681H突变,Omicron的融合性明显弱于其他变异[61],可能与S蛋白的RBD有关。但总的来说,Omicron的进入能力较其他变异体更强[65]。类似的,对于Omicron的传播性增强可能使得物理干预措施有效性下降。
COVID-19尸检的肺组织中来源于肺细胞的合胞体很常见[66],与淋巴细胞的减少相关,合胞体可能增加临床表现严重程度[67]。根据一项观察性研究,Omicron感染者临床严重程度似乎比其他变异体更轻[58,68]。病毒本身性质和先前存在的免疫力均是Omicron致病性表现的影响因素[69]。一方面,Omicron与Delta和其他变异体相比,更倾向于组织蛋白酶B和L依赖性的内吞途径介导,因此其感染过程受跨膜蛋白酶丝氨酸2(transmembrane protease serines 2,TMPRSS2)影响小[70],然而合胞体形成需要TMPRSS2[71],因而Omicron感染后促进细胞间融合形成合胞体的能力下降,破坏了受损细胞间的病毒扩散,导致临床表现较轻[72],但同时也表明了Omicron可以感染更多类型的细胞。将TMPRSS样和组织蛋白酶抑制剂组合是所有SARS-CoV-2变异体潜在的治疗方法[61]。另一方面,Omicron对现行多种抗体、疫苗诱导的抗体[73]具有耐药性,但是没有逃避记忆T细胞免疫,T细胞表位在Omicron中相当保守,由疫苗接种或自然感染引发的大部分记忆T细胞对Omicron S蛋白有反应[74]。有证据表明COVID-19疫苗接种诱导的记忆T细胞能够交叉识别Alpha到Omicron的变异体[75],此外,Omicron病毒拮抗宿主细胞干扰素反应不足[76]。这也就表明记忆T细胞在病毒感染宿主时能提供保护性免疫,并且,T细胞不是驱动病毒进化的主要因素。
3 VOCs与疫苗
疫苗对VOCs的效力受到广泛关注,尤其是现阶段流行最广泛的Omicron,疫苗研发技术路线有多种(图3),人们担心新抗原的产生使得原有疫苗失去保护力。然而,突破性感染是常见的[77]。同类型疫苗诱导的表位特异性反应可以不同[78],需要强调的是,异源疫苗效果要优于同源疫苗[79],尽管许多疫苗诱导了对野生型SARS-CoV-2及VOCs强大体液免疫反应,但存在差异,比如研究估 计mRNA-1273和ChAdOx1 nCoV-19对Delta的效力比野生型低25%~50%[80],BNT162b2疫苗诱导的抗体能有效中和4种主要的VOCs,但是对Gamma和Delta的中和能力显著降低,Alpha和Beta的中和能力相对保留[81]。此外,接种一剂辉瑞或阿斯利康疫苗的人血清对Delta几乎没有抑制作用,接种两剂后虽然滴度如前所述有所下降,但是95%个体可以产生中和反应[82]。因而对于接种一针剂疫苗后的个体应给予明确的建议,随着接种后时间过去,加强针接种重要性体现,需要更多研究来对比是否接种加强针对VOCs的效力变化。
根据已有研究,恢复期血清和两剂疫苗接种后的血清与Omicron的结合能力有不同程度的下降[83]。尤其是免疫抑制人群,一项研究表明50%血液系统癌症和实体癌患者、大约70%的实体器官移植或自身免疫性疾病患者以及40%的健康对照在6个月时失去了针对循环VOC的nAbs[84]。武汉COVID-19患者感染后1年血浆的中和试验显示,恢复期血浆对Omicron的中和作用较Delta显著降低[85]。此外,多项研究表明,加强针的接种是必要的,能够提高更高的nAbs滴度并增强中和能力[86],并有效抑制病毒进入细胞[87]。加强针后提供对Omicron的防护与第二针后对Wuhan-Hu-1的防护相当[88],但是Omicron仍然表现出从加强针诱导中中和逃逸的能力[89],加强注射6个月后Omicron中和效价的下降与第二剂后7个月针对D614G变异体的中和效价下降相似[90]。接受3剂mRNA疫苗对Omicron的保护低于Delta[91]。先前非Omicron感染对Omicron有低交叉中和作用[92],相对的,接种疫苗个体的Omicron感染增强了对Delta变异体的中和免疫力[93]。更重要的是,第三次疫苗接种也产生了高亲和力抗RBD的记忆B细胞,这表明保护作用更强大[94]。但是,令人担忧的是,完全接种后也可以发生突破性感染[95]。但同时,完全接种疫苗的个体发生Delta突破性感染后相较于完全接种疫苗的个体产生了更多强大的记忆抗体和更强的T细胞反应[96],表现出的临床症状更轻,所以广泛的疫苗接种和突破性感染的结合可能会增加人群的免疫力[97]。值得注意的是,一些血液系统肿瘤在接种疫苗后抗体反应不佳,针对Delta的体液保护在慢性淋巴细胞白血病患者中明显受损[98],抗CD38疗法会削弱SARS-CoV-2疫苗对多发性骨髓瘤患者Alpha和Delta的反应[99],这表明需要进一步优化血液系统疾病的群体中的免疫保护。
基于mRNA的COVID-19疫苗增强剂可诱导针对SARS-CoV-2 Omicron的中和免疫[100]。研究发现,接受同源BNT162b2疫苗接种或异源ChAdOx1-S-BNT162b2疫苗接种的人存在Omicron的一些交叉中和,但在接受同源ChAdOx1-S疫苗接种的人的样本中没有发现[101],与此一致的是,异源接种可以提供更好的针对Omicron的保护[102]。第二针和加强针之间的较长间隔似乎会导致针对所有测试VOCs的nAbs滴度更高,包括Omicron[103]。鉴于不断出现的诊断、治疗和疫苗接种中的问题,将SARS-CoV-2分类为血清型似乎是可行的[104]。需要注意的是,抗体滴度下降可能并不表示保护作用下降,抗体反应的交叉中和能力即效力和广度可以增强[105]。T细胞介导的免疫反应对患者的保护广泛存在,包括患者体液免疫反应受损的情况,且与nAbs相比,SARS-CoV-2特异性记忆T细胞的维持时间相对较长,因此T细胞可以为继nAbs活性的COVID-19提供坚实的防御[106]。同样的,疫苗诱导的抗体对Beta的中和活性降低,但T细胞对其反应保留,所以几种疫苗维持了预防严重COVID-19的能力[107]。因此,应考虑采用复杂的T细胞导向疫苗策略来长期控制COVID-19大流行。同时,疫苗诱导产生的免疫压力带来的病毒逃逸值得关注。
4 VOCs与检测
SARS-CoV-2及时监测是应对和理解大流行的重要手段,快速即时(point-of-care,POC)检测对于遏制大流行是重要的,其5个主要原则包括速度、灵敏度、可负担性、可扩展性和可访问性,同时不需要专门且昂贵的设备[108]。Omicron逃脱研究人员的视线累积了许多不寻常变异,是否与测序的对象或样本量或技术相关引起了人们的思考。通常,可以将检测手段分为3种(图4),基于核酸的检测、基于抗原的检测、基于抗体的检测。
基于核酸的检测是应用范围最广的,可以在发病前5 d到发病后14 d进行广泛的检测,病毒载量、样本类型、取样的人体解剖位置是检测结果的影响因素,因而了解人体中病毒载量的变化规律很有意义。全基因组测序(WGS)在COVID-19大流行中存在成本高、效率低等缺点,并且要求高病毒载量和序列完整性,以及专门的计算基础设施,但仍然可以在具有高病毒载量的阳性样本中验证新的变异体[109]。此外,在Sanger测序基础上改进后的技术也可用于发现和验证新变异[110]。RT-PCR是常见的检测方法,但是对点突变不敏感[111]。qRT-PCR通过等位基因特异性引物延伸策略可以区分废水中的单核苷酸变异的VOCs[112]。RT-PCR熔解筛选测试可用于快速筛选大量患者样本[113]。SARS-CoV-2全基因组嵌合阵列具有单核苷酸分辨率并能检测点突变[114]。值得一提的是,环境样品的检验,尤其是废水中的病毒检测,环境样品不仅能帮助分析病毒谱系,更与临床相关联[115],但其中存在的问题是长片段扩增问题和复合检测[109],SHERLOCK是一个使用Cas13a核糖核酸酶进行RNA检测的系统,一些检测手段例如基于CRISPR的miSHERLOCK(微型仪器特异性高灵敏度酶促解锁)可以实现变种Alpha、Beta和Gamma的共同检出[116]。CRISPR-Cas系统已被用于开发核酸检测平台,催化酶Cas酶的进展无疑将给基于核酸的检测手段带来进展。基于Cas12a的RT-PCR结合CRISPR现场快速检测系统(RT-CORDS)平台可以用于检测SARS-CoV-2变异体中的关键突变,例如69/70缺失、N501Y和D614G[117]。enAsCas12a,具有较广的工作温度范围以及无需RNA纯化步骤的优点[118]。FnCas9高特异性识别单核苷酸变异[111],能够快速适应其他突变。CRISPR-Cas12a系统对多重等位基因特异性测定[119],结合CRISPR/dCas9后提升了性能,适于资源相对缺乏的 环 境 进 行 筛 查[120]。微 流 体CARMEN(mCARMEN),它将基于CRISPR的诊断和微流体技术与临床使用的简化工作流程相结合,可以定量测 量 样 本 中 的SARS-CoV-2Delta和Omicron[121]。qPCR仅适于单突变位点的检测或CRISPR-Cas13a扩增技术无法同时检测所有变异,多重串联PCR能够应对增多的已知VOCs[122],一种多重PCR-质谱微测序技术,实现了多个单核苷酸变异位点的同时识别,也能识别插入和缺失[123]。等温扩增技术具有快速、高效、特异的优点且无需专用的设备,它们通常不针对多个SARS-CoV-2基因,存在敏感性和特异性风险,环介导等温扩增技术(loopmediated isothermal amplification,LAMP)和重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)是基于PCR的可替代技术,已有对变异体适用的RT-LAMP检测手段的报道[124]。有研究表明,逆转录环介导的等温扩增(RT-LAMP)测定对唾液的检测是可行的[125]。但是需要考虑到多引物带来的假阳性风险,与CRISPR-Cas系统结合利于提高灵敏度[126]。由于RNA引导的切割,CRISPR技术与RPA的配对可能会增加检测的特异性。基于RPA的同时靶向SARS-CoV-2包膜蛋白基因和RdRP基因的检测手段实现了同时靶向多个基因,提高灵敏度和特异性,且较LAMP对工作温度的要求低,更加便捷[127]。加强对临床样本变异的监测可以缩小病毒基因组进化分析中的选择偏倚。
快速抗原检测的灵敏度较低,通常作为验证手段。在病毒载量下降的急性期之后,使用基于抗原的快速诊断检测可能会导致高假阴性率,这表明应该用分子和血清学检测的组合来代替检测[128]。有研究表示N蛋白中的T135I突变对商业上可用的抗原检测构成潜在的诊断风险[129]。SARS-CoV-2的快速抗原检测测试低估了COVID-19阳性病例的识别并影响了对K417N/T、E484K和N501Y突变的诊断[130]。基于抗原的快速诊断检测较分子检测节约了时间和成本,世界卫生组织建议抗原检测快速诊断测试的灵敏度和特异性至少为80%和97%,结合基于豆提取物的Beangaurd漱口水收集唾液样本可以得到理想的测试性能[131]。侧向流动免疫层析 (lateral flow immunochromatography assay,LFIA)是一种基于抗原、抗体免疫反应的经典床旁检测技术。
血清转化在症状出现后7~14 d左右达到高峰,故基于抗体的检测较另外两种相对滞后,包括LFIA、酶联免疫吸附试验(ELISA)、化学发光免疫试验(CLIA)、免疫荧光试验(IFA)和胶体金免疫色谱试验(GICA)等。
5 VOCs与治疗
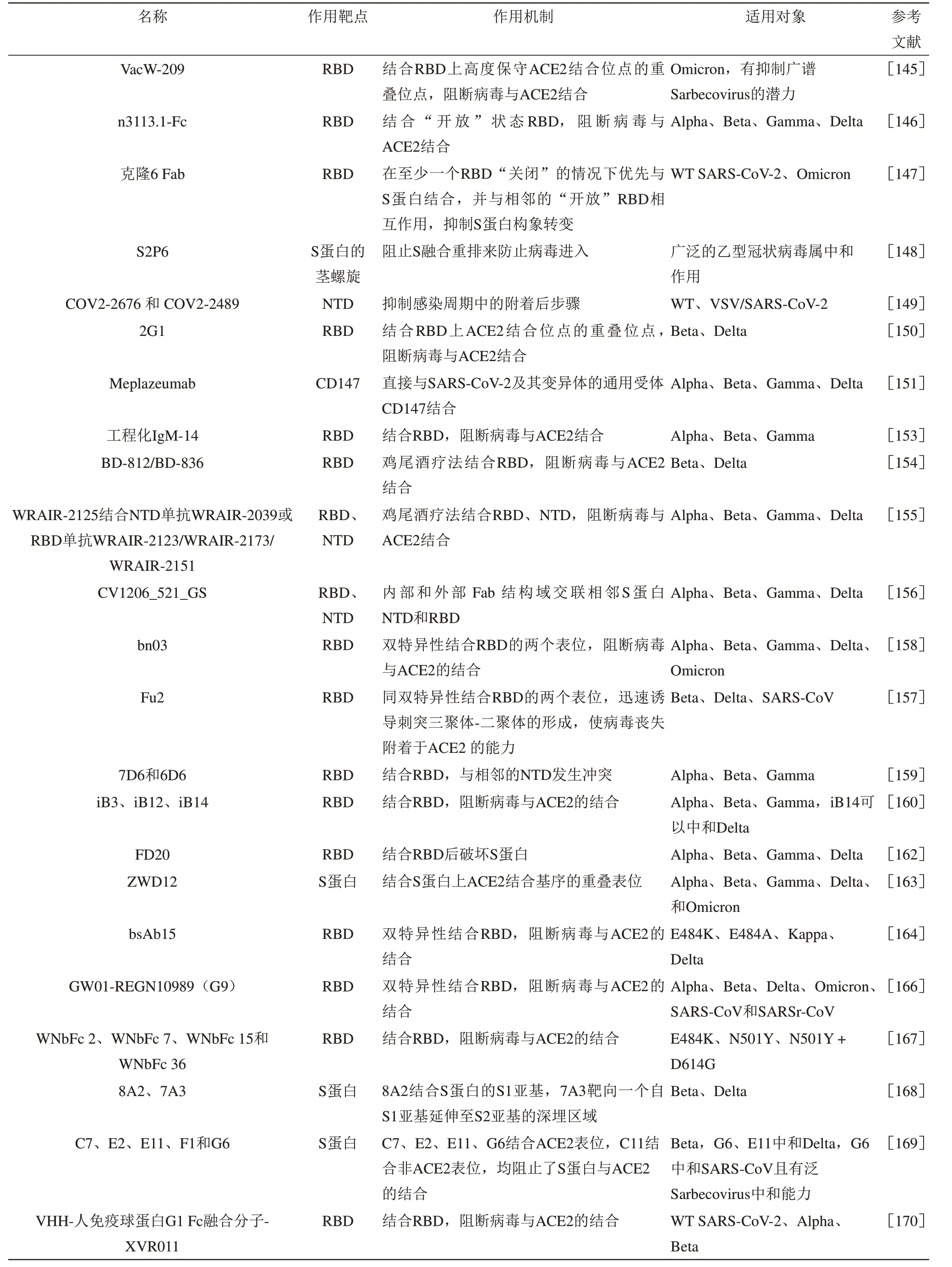
nAbs作为治疗的重要部分,需要测试其对VOCs的 中 和 能 力。CB6(Etesevimab)、LY-CoV555 (Bamlanivimab) 、 P2C-1F11(Amubarvimab)、REGN10933(Casirivimab)、REGN10987(Imdevimab)和S309(Sotrovimab)已被批准用于临床[132]。E484K突变已被证明能够在 体 外 对Bamlanivimab耐 药[118],K417E/N/T、D420A/G/N、N460I/K/S/T、T415P、Y489C/S等突变均对Etesevimab耐药[133],Gamma和Beta谱系中E484/K417突变特异性组合对Bamlanivimab+Etesevimab单 抗 耐 药,Q493K也 耐 药[134]。AZD7442是两种单克隆抗体AZD8895(Tixagevimab)和AZD1061(Cilgavimab)的组合被用于COVID-19暴露前预防[135]。免疫功能低下的 患 者 使 用REGEN-Cov(Regeneron:Casirivimab+Imdevimab)进行预防性治疗时出现过突破性感染[136]。Omicron可以逃脱所有I/II类抗体LY-CoV555、REGN10933、CT-59、ADZ1061、ADZ8895、P2C-1F11和DXP-604的阻断能力,但III类mAb(非ACE2阻断抗体)的中和敏感性受该变异体的影响较小,如hu33和S309[137]。与此类似的研究,也指出LY-CoV016对缺乏R346K的Omicron的中和能力完全丧失,对ADZ1061、ADZ8895的 中 和 能 力 下 降12倍[138]。Regdanvimab、P2B-2F6、Fab2-15和S2-M11对E484突变敏感,以及S2-H14对N501和Y505突变的亲和力下降,体外实验也发现,E484处具有突变的Omicron、Beta、Gamma、Kappa和Lambda显示 出 对REGN-10933、P2B-2F6、Fab2-15和S2-M11结合的最强抗性[139]。值得关注的是,S309保留了对BA.1和BA.1+R346K的活性,但对BA.2存 在 明 显 抗 性。McCallum等[140]通 过 对Omicron突变的深入分析解释了广泛的nAbs逃逸。至此,除了最近授权的LY-CoV1404(Bebtelovimab)[135]外,没有任何授权的单克隆抗体疗法可以充分覆盖Omicron的所有亚谱系[141]。
Sun等[142]提出将中和表位分为3类。I类是ACE2结合位点,结合后可以破坏宿主受体结合[143]。II类是高度保守的表位,优势在于保留对多种变体的中和活性。例如35B5抗体通过靶向一个保守表位破坏控制S蛋白“关闭”到“开放”构象的N-聚糖开关,对Omicron也有效[144]。VacW-209结合RBD上高度保守的表位从而保留了对Omicron的抗性[145]。III类是识别抗体可能无法接近的独特表位。但需要注意非ACE2竞争性抗体,非ACE2竞争全人源域抗体(n3113.1-Fc)与“开放”RBD的侧面结合,结合试验和假病毒中和试验表明保留了对Alpha、Beta、Gamma和Delta的抗性[146]。此外由于S蛋白具有“开放”和“关闭”两种构象,所以可进一步将nAbs细分为只能结合“开放”或“关闭”构象的抗体,以及能结合两种构象的抗体。锁定S蛋白的“关闭”构象并阻止S蛋白变构[147]、与S蛋白的茎螺旋结合后阻止S蛋白融合重排[148]、靶向NTD抑制感染周期中的附着后步骤[149]均是nAbs发挥作用的机制。结合表位和亲和力是影响抗体效力的两大因素,窄结合表位和高亲和力的抗体似乎展现出了出色的效力[150]。CD147被鉴定为SARS-CoV-2感染细胞的另一受体,其人源化抗CD-147抗体Meplazeumab能够阻断SARS-CoV-2及其变异体Alpha、Beta、Gamma、Delta[151]。
面对VOCs导致nAbs保护效力下降的挑战,有以下几条解决思路。一是改进现有单克隆的结构,例如通过优化Fc结构域可以提升nAbs效力[152],工程化IgM-14有效地中和由其相应IgG-14引起的抗性病毒,包括Alpha、Beta、Gamma[153]。二是联合使用多种单特异性的nAbs即鸡尾酒疗法[154],要求是两种或多种抗体的结合表位存在不同并且克服空间位阻,因此靶向RBD的nAbs和靶向NTD的nAbs混合联用是可行的[155]。三是开发双特异性nAbs[156-158],优点在于成本较鸡尾酒疗法低。四是开发针对难以接近的特殊表位的nAbs。五是开发针对保守表位的nAbs,抑制广谱Sarbecoviruses感染[159]。后面3种类型的nAbs都有应用于鸡尾酒疗法的潜能。而抗体的开发主要源自患者恢复期血浆[160-162]、疫苗接种后的血浆[163]、人源化小鼠、噬菌体[157]或酵母文库[164]、预先建立 的 单 域 抗 体 库[165]。此 外,抑 制 广 谱Sarbecoviruses感染的抗体越来越受到欢迎[166]。
纳米抗体主要来自于羊驼、美洲驼和骆驼,是最小的天然抗原识别结构域之一,可以被设计成多价形式,并可以与Fc结构域融合,但是由于体积小容易被肾脏清除[167]。同时,纳米抗体以其体积小、稳定性好的优点适于通过吸入的方式给药[158]。体积小的纳米抗体可以克服更大空间位阻进入某些深埋的区域发挥作用[168],不同纳米抗体之间的结合也是可行的[169]。来源骆驼衍生的单域抗体(VHH)与Fc结构域结合后形成VHH-IgG1 Fc融合分子,有效抑制了体内、体外的病毒复制[170]。纳米抗体与nAbs结合后具有病毒捕获和拦截功能,以及光热功能,因此,在捕获病毒后可以灭活病毒,这种纳米抗体提供了nAbs发挥作用的平台[171]。
ACE2模拟物也能靶向病毒S蛋白阻止病毒进入细胞[172],者血浆中有循环细胞外囊泡(extracellular vesicles,EVs)表 达 细 胞 外 囊 泡ACE2(evACE2)[173],ACE2的可溶性胞外域蛋白可以作为“中和诱饵”来阻止SARS-CoV-2及其变异体进入,包括Omicron[132]。工程化ACE2可变性大,可以通过改变氨基酸实现对新变异体的适应[174]。负电荷的高度硫酸化的线性聚甘油硫酸盐与S蛋白结合,并且可以通过静电相互作用阻止病毒进入宿主细胞,适于N501Y和E484K突变[175]。此外,通过封闭ACE2也能是有效的[176-177]。
病毒感染过程还有多个靶点。现有的TMPRSS2抑制剂包括ketobenzothiazole(kbt)[178]、avoralstat[179]、N-0385[180]、α1-抗胰蛋白酶[181],可以阻止S蛋白重排。Omicron对这3种泛冠状病毒融合抑制剂EK1、EK1C4和EKL1C的敏感性与D614G和Delta一样[182]。组织蛋白酶L即CTSL在功能上切割SARS-CoV-2 S蛋白并增强病毒进入,而金刚烷胺能抑制假病毒感染细胞中的组织蛋白酶L[183]。主蛋白酶(Mpro)在病毒中具有保守性[183],可在多个位置切割SARS-CoV-2的两种多肽(pp1a和pp1ab),产生对病毒复制至关重要的较短的非结构蛋白[184],是潜在的重要抗病毒靶点,PF-07321332[185]、ebselen[186]、GC376[187]、masitinib[188]、Coronastat[189]、Y180[183]均是Mpro的抑制剂,PF-07321332对Alpha、Beta、Gamma、Delta均有效[190],Luttens等[191]提出超大虚拟筛选(ultralarge virtual screening)来筛选Mpro抑制剂。通过剪接丙型肝炎蛋白酶抑制剂boceprevir和narlaprevir以及已知的SARS-CoV-1蛋白酶抑制剂的成分而产生的BBH-1、BBH-2和NBH-2,在体外表现出与PF-07321332相当的抗病毒特性[169]。I型干扰素(interferon I,IFN-I)触发信号级联反应并激活下游干扰素刺激基因,共同促进抗病毒状态,其中参与脂质代谢的脂肪酸合酶(fatty acid synthase,FASN)是干扰素抑制基因,FASN过表达增强了病毒和宿主细胞的细胞膜融合和细胞间合胞体的形成,FASN抑制剂能有效抑制Alpha、Beta、Gamma、Delta的细胞侵入[192]。干扰素诱导的跨膜蛋白IFITMs能与S蛋白相互作用来促进病毒感染,是潜在的预防和治疗靶点[193]。
干扰病毒基因组的复制过程也能发挥抗病毒作用。Remdesivir[194]、AT-527[195]都是靶向RdRp的核苷类似物,corilagin(RAI-S-37)能结合并抑制RdRp[196]。Simeprevir不 仅 抑 制Mpro还 能 抑 制RdRp,并且能在体外与Remdesivir协同作用[197]。suramin一个位点直接阻断RNA模板链的结合,另一个位点与RdRp催化位点附近的RNA引物链发生冲突,从而抑制RdRp活性,在体外细胞中表现出了复制抑制活性[198]。此外,一种金属超分子螺旋体能结合SARS-CoV-2基因组5'-UTR关键区域从而抑制病毒的复制[199]。氟喹诺酮类抗菌药物merafloxacin能抑制程序性-1核糖体移码从而阻止了Vero E6的SARS-CoV-2复 制[200]。Remdesivir、Molnupiravir和Nirmatrelvir(PF-07321332)在 体外实验中表现出了对5种受关注变异体的抗病毒活性[201],且Omicron对Molnupiravir+Nirmatrelvir组合高度敏感[202]。
总的来说,本文总结了最新以及对VOCs有潜在治疗作用的药物(表1),以上药物靶点分为两部分,宿主细胞外的靶点和宿主细胞内的靶点,前者药物或抗体直接结合到病毒阻断病毒感染细胞过程,后者包括病毒结合、融合、复制、翻译等关键分子(图5)。

Table 1 Therapeutic drug for COVID-19表1新冠肺炎治疗药物
续表1
6 结 语
从SARS-CoV、MERS-CoV到SARS-CoV-2,冠状病毒给人类带来的危害不言而喻,SARS-CoV-2的高突变率更是为全球疫情防控不断提出挑战,进一步了解SARS-CoV-2的起源和突变特征是预测COVID-19疫情走向的重要基础。为跟上病毒进化的脚步,更具有保护性的疫苗和广泛抗冠状病毒功能的抗体亟待开发和寻找。此外,一些建议可能对全球防控疫情是有益的。第一,如上文所述,免疫抑制人群是潜在有害突变的来源,因此,需要根据人体的免疫情况对人群进行分层管理,免疫抑制人群包括长期HIV感染人群、患血液系统肿瘤人群、长期接受免疫抑制剂如糖皮质激素治疗人群(包括接受器官移植人群、患有风湿性疾病、银屑病和炎症性肠病等患者),且免疫抑制人群对疫苗的反应很可能不佳,重在加强对SARS-CoV-2的预防,需要提高免疫抑制人群和医务工作者的防范意识。对于感染了SARS-CoV-2的免疫抑制者,则需要加强隔离措施。第二,SARS-CoV-2载量高时宿主内病毒的多样性反而低,来自人体的有害突变是否能够成功传播给其他人还存疑,并且,缺乏环境样本可能造成系统发育学分析偏倚,这意味着必须重视环境样本,优化快速检测环境样本的技术手段,关注环境来源的传播途径,尤其是冷链运输传播病毒。第三,Omicron是现在主导的变异体,较于之前主导的Alpha、Beta、Gamma、Delta,Omicron有着强大的免疫逃逸能力,从Omicron的发现历程来看,尽管全球SARS-CoV-2测序基因组能通过一些数据库共享,但是某些资源较少的国家和地区测序数量不足,很可能漏掉高突变的有害变异体,因此,国际社会加强对资源较少地区基因组监测的资金和技术支持应当优先考虑。第四,疫苗的分配问题一直是焦点问题,首先解决供不应求、国家地区间分配不均的问题;其次,应当重视影响疫苗效力的因素,如上文所述的接种间隔时间长短、同源疫苗和异源疫苗,优先为感染的高危人群确定最佳的接种方案。第五,物理干预措施效果受到高传播性变异体的威胁,需要进一步加强物理干预措施,例如,扩大社交距离,增加佩戴口罩场所如空旷的室外场所。

