mRNA肿瘤疫苗的免疫学机制和临床研究进展
邓卓雅 田昱莹 杨鹏辉
(1)解放军总医院第一医学中心肝胆胰外科医学部,全军肝胆外科研究所,北京 100853;2)解放军医学院,北京 100853;3)内蒙古医科大学,呼和浩特 010110)
近年来,尽管肿瘤治疗取得了显著进展,但恶性肿瘤仍然是世界第二大致死原因[1]。临床上常规的肿瘤治疗手段包括手术、放疗、化疗、靶向治疗、免疫治疗和综合治疗等。此外,检查点抑制剂(checkpoint inhibitor,CPI)对多种恶性肿瘤的有效治疗启发了人们对肿瘤免疫治疗的新思路[2]。肿瘤免疫治疗的目的是激活宿主的抗肿瘤免疫,改变抑制肿瘤的微环境,最终达到缩小肿瘤,提高患者总体生存率的目的。肿瘤疫苗是一种有潜力的抗肿瘤免疫治疗手段。针对肿瘤相关抗原(tumorassociated antigen,TAA)或 肿 瘤 特 异 性 抗 原(tumor-specific antigens,TSA)的疫苗可以特异性地攻击和摧毁高表达肿瘤抗原的恶性肿瘤细胞,并通过免疫记忆而实现对肿瘤的持续杀伤作用。因此,与其他免疫疗法相比,肿瘤疫苗提供了特异、安全和可耐受的治疗方法。尽管研究者在开发肿瘤疫苗方面做出了相当大的努力,但由于肿瘤抗原的高度多样性和相对较低的免疫反应,几十年来将肿瘤疫苗转化为有效的临床治疗方法仍然具有挑战性[3]。mRNA疫苗作为肿瘤疫苗的重要类型,能够编码TAA、TSA及其相关的细胞因子,同时激发体液和细胞介导的免疫反应,增加克服疫苗耐药性的可能性,从而达到加强患者抗肿瘤免疫的效果,成为一种具有良好前景的治疗方式。mRNA疫苗具有多种优势,如能够产生强有力的保护性免疫反应,mRNA的生产速度更快、更灵活、成本更低,可以用于精准和个性化的治疗。体外转录后再加帽加尾是mRNA肿瘤疫苗公认的生产方法,它类似于真核细胞胞浆中自然加工和成熟mRNA。当接种疫苗部位的细胞吸收后,mRNA被运输到细胞质。接着,通过核糖体合成mRNA编码的蛋白质,然后进行翻译后修饰,产生正确折叠的功能蛋白质。mRNA疫苗可以使其编码的蛋白质或肽瞬时表达,持续几天或几周,使得mRNA更容易控制。更为重要的是从安全性出发,与DNA疫苗相比,mRNA不会整合到宿主基因组中。
本文聚焦于mRNA疫苗目前在肿瘤治疗方面的应用,并总结了mRNA领域的发展和面临的挑战,将有助于更好地认识和了解mRNA疫苗的免疫学机制和临床研究进展,为肿瘤治疗提供新的研究策略。
1 mRNA制备策略
mRNA肿瘤疫苗的制备方法是体外转录(in vitro transcription,IVT),它模拟真核细胞胞浆中自然加工和成熟mRNA(图1)。体外转录是一个相对简单的过程,但制造高质量的、高度可翻译的、不会引起严重炎症的“治疗性”mRNA一直是该领域的主要限制。最近炎症和自身免疫得到了很大程度的解决,包括加帽加尾技术的改善、加入修饰性核苷[4](特别是修饰的尿苷)、优化编码序列[5]、以及通过高效液相色谱(high performance liquid chromatography,HPLC)[6]严 格 纯 化IVT mRNA以去除双链RNA(dsRNA)污染物。这些技术将有助于减少外源mRNA的信号,从而降低炎症反应并改善mRNA的翻译水平。
1.1 序列构建
首先,mRNA疫苗需要设计一条DNA模板去进行体外转录。该DNA模板至少需要包含目的蛋白质的开放阅读框(open reading frame,ORF)、侧翼的5′非翻译区(5′untranslated region,5′UTR)和3′非翻译区(3′untranslated region,3′UTR)。其次需要含有可用的RNA聚合酶(例如T7、T3或SP6噬菌体RNA聚合酶)[7]的引物结合位点启动体外转录。
ORF本身编码的目的蛋白质会影响翻译效率,有些稀有密码子也会降低翻译效率。而氨基酸可由几个密码子共同编码,利用密码子的兼并性可以优化氨基酸对应的密码子进而优化翻译过程[8]。但原始序列的操纵也可能导致不利结果,有研究表明即使是同义突变也会导致疾病的发生[9]。
UTR具有重要的细胞功能,可以通过与RNA结合蛋白相互作用来影响mRNA降解速率和翻译效率,从而调节蛋白质的表达[10]。5′UTR在翻译的启动和启动前复合体的形成过程中起着重要的作用。5′UTR除了有助于启动翻译和提高翻译效率外,对mRNA的稳定性也很重要。3′UTR可以通过包含如来自α-或β-珠蛋白等序列[11]来提高翻译效率;也可以增加miRNA的结合位点来调控靶基因在不同组织的表达,例如增加miRNA-122结合位点来减少在正常肝组织表达从而降低肝毒性[12]。此外,较高的GC含量和较低的U含量有利于降低免疫原性,最大限度地提高IVT mRNA的稳定性[13]。
1.2 体外转录
体外转录(IVT)是将设计好的模板DNA链根据碱基互补原则转录生成RNA链的过程。RNA聚合酶识别转录启动子后转录开始。在体外转录过程中,修饰的核苷酸可以用来进一步稳定RNA并降低免疫原性[14]。常见的替代有N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、5-甲基尿嘧啶(m5U)、2-硫代尿嘧啶(s2U)或假尿嘧啶(ψ)等。特别是m5C和ψ,不仅被报道降低体外转录后RNA的免疫原性,甚至可以提高翻译效率。
1.3 加帽
真核细胞中典型的5′帽结构是一个倒置的7-甲基鸟苷(m7G),它通过5′-5′三磷酸桥与RNA的第一个核苷酸共转录。5′帽结构的功能是增加体外转录后RNA的稳定性和翻译效率,并消除其免疫原性。正常核糖体的结合与启动转录需要5′帽子结构的作用,5′UTR和5′帽子结构的作用相关,在翻译的启动和启动前复合体的形成过程中起着重要的作用。体外转录后RNA有一个高度免疫原性的5′三磷酸部分。三磷酸化的RNA在细胞质中被模式识别受体(pattern recognition receptor,PRR)识别,并引起Ⅰ型干扰素(typeⅠinterferon,IFNⅠ)反应[15]。为了防止RNA被识别为外源物质,必须去掉其三磷酸,并添加一个5′帽。有几种方法来实现这一点[16]。加帽可以通过在体外转录反应中添加一个帽子类似物来进行共转录。添加一个帽子类似物有可能会被错误地结合,导致mRNA不具备翻译能力,而抗反向帽类似物(anti-reverse cap analog,ARCA)使聚合酶以正确的方向结合ARCA[17]。也可以通过用磷酸酶去除三磷酸腺苷和用2′-O-甲基转移酶添加m7G来完成转录后的封顶。无论是转录中还是转录后加帽,都不能保证所有的RNA分子都会被修饰加帽,由于错误封顶激活PRRs导致外源mRNA免疫原性的提高[18]。
1.4 加尾
Poly(A)尾可以使用Poly(A)聚合酶[19]在转录后添加,也可以构建在模板中直接转录。Poly(A)尾可以减缓RNA免受RNA核酸外切酶的降解过程,提高RNA稳定性和翻译效率。Poly(A)尾的长度一般是100~250个核苷酸,但最佳长度取决于靶细胞类型。使用修饰的腺苷可以进一步提高多聚(A)尾的稳定性,使其不受细胞核糖核酸酶的降解[20]。在DNA模板中构建Oligo(dT)来添加Poly(A)尾可以更好地控制尾巴的精确长度,并使随后的酶促反应失效,但作为模板的一部分其长度往往受到限制。
1.5 纯化
体外转录后需要纯化mRNA,并测定其浓度,排除异常、截断和降级产品。临床上通过层析的技术纯化mRNA,去除了由转录失败而引起的较短模板片段或由自身互补3′延伸引起的dsRNA,这两者都是造成杂质的常见原因。为了从转录的mRNA中去除dsRNA,人们提出了一种基于对纤维素的吸附来纯化mRNA的替代方法[21]。在IVT过程中,可以通过降低Mg2+浓度或在高温下产生RNA来减少dsRNA种类[22]。HPLC实现了dsRNA的更完整和更彻底的去除[23]。然而,HPLC纯化mRNA的成本高、收率低(<50%)。最近,Baiersdorfer等[21]报道了一种快速、廉价的纯化方法。该方法利用dsRNA与含有乙醇的缓冲液中的纤维素粉的选择性结合,结合快速蛋白液相色谱(fast protein liquid chromatography,FPLC),可去除高达90%的dsRNA。现经证明,成功的mRNA翻译和蛋白质表达不需要使用任何修饰的核苷酸,更多地依赖于mRNA的纯度和其单个部分的序列组成[24]。
2 mRNA递送系统
除了构建序列、生产mRNA,开发高效、安全的mRNA疫苗递送系统也是mRNA疫苗技术的关键。已有的传统方法,如体外负载树突状细胞(dendritic cell,DC)、结内输送mRNA和机械方法(基因枪、电穿孔)来传递裸露的mRNA用于疫苗接种[25],但这些方法要么复杂昂贵(体外负载DC),要么难以在人体内使用(结内输送、电穿孔),因此,传递mRNA的理想方式是使用一种能够保护mRNA不被降解,并促进细胞有效摄取的材料。
2.1 多聚体纳米颗粒
多聚体纳米颗粒封装mRNA可保护mRNA并使其免于降解,并且其特定的化学性质可以帮助细胞摄取和内体逃逸。聚乙烯亚胺(polyethylenimine,PEI)是一种广泛用于核酸输送的阳离子聚合物,商品化的线性PEI衍生物jetPEI®已被用于体内和体外的mRNA转染。脂肪链修饰的低分子PEI可以降低毒性[26-27]。聚酰胺胺(polyamidoamine,PAMAM)或聚丙烯亚胺树枝状大分子是另一类用于mRNA传递的阳离子高分子材料。Khan等[27]开发了脂肪链修饰的PAMAM树枝状大分子,用于系统地将siRNA输送到肺内皮细胞并递送了抗原编码的SAM。生物可降解聚合物的开发是为了提高运载工具的清除率,同时降低其荷电毒性。聚β-氨基酯(poly beta-amino esters,PBAEs)是一种用于siRNA/mRNA递送的生物可降解聚合物。此外,Blakeny等[28]开发的生物可还原聚CBA-co-4-氨基-1-丁醇(Pabol)被用于在小鼠体内传递编码血凝素(HA)的SAM。
2.2 蛋白质-mRNA复合体
蛋白质-mRNA复合体是指将鱼精蛋白等蛋白质直接缀合到RNA,该复合体通过胞吞作用进入细胞,通过涉及Toll样受体(Toll-like receptor,TLR) 的 髓 系 分 化 标 志 物88(myeloid differentiation marker 88,MyD88)依赖性途径激活免疫系统。鱼精蛋白是一种阳离子多肽,通过静电相互作用自发缩合mRNA,保护包裹的mRNA不被细胞外核糖核酸酶降解。鱼精蛋白-mRNA复合物还可以作为佐剂,激活TLR7/8以诱导Th-1型免疫反应[29-30]。RNActive®疫苗在Ⅰ/Ⅱ期患者中具有良好的耐受性和免疫原性,其中一些已经显示出中等的抗肿瘤效果。阳离子细胞穿透肽(cellpenetrating peptides,CPPs)能 与RNA形 成 复 合物。研究人员推测CPPs可能促进带负电荷的糖胺聚糖在细胞表面聚集,并引发微胞吞噬[30]。
2.3 脂质纳米颗粒(lipid nanoparticles,LNPs)
近几年,高效核酸输送材料的开发取得了突飞猛进的进展。脂质纳米颗粒(lipid nanoparticles,LNPs)最初是为小干扰RNA(small interfering RNA,siRNA)递送而研发,现已成为目前使用最广泛的体内传递mRNA材料[31]。Pardi等[32]证实mRNA-LNPs可以在体内表达后,多项肿瘤疫苗研究已经使用了LNPs包裹的mRNA。此外,2021年,中国国家纳米科学中心王海、聂广军团队[33]设计了一款水凝胶长效稳定RNA疫苗,体内动物实验显示将其皮下注射后,可以至少在30 d内持续释放RNA纳米疫苗,进入引流淋巴结内部并且被抗原提呈细胞摄取,实现持久的抗肿瘤免疫治疗效果。
3 mRNA激发的免疫应答反应
注射mRNA疫苗后,编码的蛋白质将被翻译并呈递给免疫系统。该过程类似于RNA病毒感染的自然过程及其连续诱导的保护性免疫应答。外源mRNA进入细胞质后会发生与内源性mRNA相似的反应——mRNA在细胞质中被翻译成蛋白质,蛋白质经过翻译后修饰通过靶向序列或跨膜结构域进入亚细胞间隔,比如分泌途径、细胞膜、细胞核、线粒体或过氧化物酶体[34]。因此,递送外源mRNA进入细胞质对于抗原的表达至关重要,但这个过程是通过胞内体途径还是通过质膜直接进入尚未研究透彻[35]。
3.1 mRNA肿瘤疫苗诱导固有免疫反应
3.1.1 免疫细胞识别
外源性mRNA通常被认为是具有免疫原性的,表现为类似RNA病毒特性,通过TLR激活先天免疫细胞[7,36]。TLR属于固有免疫反应PRR的一组,作为病原体相关分子模式(pathogen-associated molecular patterns,PAMP)的“感受 器”检测PAMP。mRNA可被抗原呈递细胞(antigen presenting cell,APC)识别,激活TLR,如TLR3、TLR7和TLR8[37],一旦TLR感应到PAMP,就会通过连续激活适应性免疫应答来启动先天免疫应答[38],产生促炎细胞因子如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),干 扰 素α(interferon-α,IFN-α),白介素-6(interleukin-6,IL-6),干扰素γ(interferon-γ,IFN-γ)诱导蛋白10和APC(如DC)上的共刺激分子[39]。最终导致适应性B细胞和T细胞应答的产生[38]。TLR7由B细胞[40]、巨噬细胞和DC[41]表达,并且可以检测单链RNA(single stranded RNA,ssRNA)。因此,B细胞通过MYD88/TLR7依赖性信号通路快速激活,为调节mRNA疫苗诱导的适应性免疫应答提供刺激。此外,TLR7信号传导增加促炎细胞因子的产生,增加抗原呈递并改善记忆B细胞存活[35]。
3.1.2 非免疫细胞识别
在非免疫细胞中,细胞质维甲酸诱导基因Ⅰ(retinoic acid-inducible gene I,RIG-I)样 受 体(RIG-I like receptor,RLR)和黑色素瘤分化相关基因(melanoma differentiation-associated gene 5,MDA5)感知外源mRNA并介导细胞因子和趋化因子的产生[19,40,42-43],进而招募先天免疫细胞,如DC和巨噬细胞到mRNA注射部位[42]。虽然早期诱导强大细胞因子的产生对提高疫苗效力来说是有利的,但由于细胞因子会导致自身免疫等严重的全身副作用,或削弱mRNA疫苗的免疫应答使得肿瘤疫苗不能完全发挥抗肿瘤免疫作用(图2)。有研究表明,在慢性感染发生时,IFN-Ⅰ应答保持不变,产生的多种下游效应与持续的T细胞受体(T cell receptor,TCR)信号和其他免疫调节机制(如共抑制受体、免疫抑制细胞因子的表达和调节性T细胞数量的增加)相结合,这会导致CD8+T细胞反应功能障碍,也称为T细胞耗竭。因此人们在mRNA疫苗技术中寻求用不同的方法来将IFNⅠ等细胞因子的诱导降至最低。例如,Miao等[15]提出,加入不饱和脂质尾部、二氢咪唑接头和环胺头部基团的mRNA,可以通过细胞内干扰素基因(stimulator of interferon genes,STING)途径而不是TLR途径激活APC,从而减少细胞因子的表达,降低由于细胞因子引起的自身免疫反应导致的副作用,提高抗肿瘤效果。
综上所述,对于外源mRNA的先天感应可能导致mRNA翻译停滞、mRNA降解以及连续的次要抗原特异性免疫反应[43],这些表明在mRNA接种后先天免疫和获得性免疫之间存在密切联系。
3.2 mRNA肿瘤疫苗诱导获得性免疫
3.2.1 抗原呈递
在注射mRNA疫苗后,其编码的蛋白质将被翻译并呈递给免疫系统,并激发获得性免疫。mRNA编码的蛋白质被翻译后通过微吞饮、内吞或吞噬作用被APC(如DC)摄取[44],可能形成含有抗原蛋白的吞噬小体或内小体[45],通过DC上的主要组织相容性复合体Ⅰ(MHC-Ⅰ)和主要组织相容性复合体Ⅱ(MHC-Ⅱ)提呈。APC可以将外源抗原通过MHC-II呈递给CD4+T细胞,并在MHCI上交叉呈递给CD8+T细胞。由此产生的细胞毒性T淋巴细胞诱导称为交叉激发。CD4+T细胞为B细胞和CD8+T细胞提供帮助。最后,抗原特异性B细胞和T细胞的克隆扩增导致靶细胞消除。此外,所有有核细胞都有能力去处理mRNA并在MHC-Ⅰ上呈递翻译的蛋白质或多肽,但只有APC能够在MHC-Ⅰ和MHC-Ⅱ上呈递,进而诱导CD4+T细胞和B细胞产生免疫反应(图3)。此外,DC可以内化活细胞的胞浆和细胞膜物质来启动T细胞反应[46]。
3.2.2抗原分类
为了诱导获得性免疫,需要将特定的抗原提呈给免疫细胞。mRNA肿瘤疫苗通常编码TAA,这些抗原在癌细胞上优先表达。对这些肿瘤来源的抗原进行分类,可以细分为:a.组织分化抗原如人类癌胚抗原(human carcinoembryonic antigen,CEA)或MART-1,也可在健康组织上表达;b.肿瘤种系(睾丸癌)抗原(例如NY-ESO-1或MAGE-3);c.肿瘤细胞过表达的正常蛋白(如EGFR、MUC1、Her2/neu);d.病毒蛋白(如EBV、HPV);e.肿瘤特 异 性 突 变 抗 原(如MUM-1、β-catenin或CDK4)[47-48]。基因异常是肿瘤发展的重要驱动因素[49]。体细胞突变可能产生新抗原表位,这些表位是肿瘤衍生的肽并且可以与MHC结合[50]并被T细胞识别,因此编码新抗原的mRNA疫苗被认为是最佳的肿瘤疫苗候选[49]。同样,识别这些抗原的T细胞在过继转移或免疫检查点抑制后介导临床反应[51]。且有研究表明含有较高新抗原表位负荷的肿瘤,如黑色素瘤、非小细胞肺癌和错配修复缺陷的结直肠癌,都对免疫检查点抑制剂有较好的反应[52]。
3.2.3 免疫效应
基于多肽的疫苗受到MHC限制,而mRNA疫苗允许组合编码不同抗原的mRNA。mRNA电穿孔的树突状细胞具有多种MHC-I和MHC-II限制性多肽,并能诱导多克隆的CD4+和CD8+T细胞应答。CD4+辅助T细胞对于有效诱导细胞毒T淋巴细胞(cytotoxic T lymphocyte,CTL)和B细胞应答非常重要[53],并且mRNA疫苗在存在辅助表位时可以进一步提高免疫应答。将mRNA导入树突状细胞后,诱导CD4+T细胞反应是由自噬介导的[54]。最后,疫苗组合物中可以包括编码免疫调节蛋白的mRNA,可以进一步提高其效力。综上所述,编码两个或更多蛋白质或长肽的mRNA疫苗可以实现广泛的多克隆免疫反应,避免了对某些MHC分子的限制和由于抗原丢失而导致的免疫逃逸风险。
应用编码突变抗原表位的mRNA可产生强烈的抗原特异性CD8+T细胞反应和有效持久的CD4+T细胞介导的肿瘤消退。Kreiter等[55-56]证明,大多数肿瘤特异性突变是由CD4+T细胞识别的,这种细胞具有很强的抗肿瘤活性。CD4+T细胞应答主要由一种以Th1为主的免疫应答以及由CD4+和CD8+T细胞产生的IFN-γ组成。对于这种强烈的Th1反应,不同的研究试图利用mRNA疫苗作为工具来调节Th分化。例如,对于Ⅱ型免疫反应(其特征是分泌细胞因子IL-4、IL-5、IL-13和过敏原特异性IgE),应用了mRNA疫苗从而减少了过敏性辅助T细胞(T helper 2,Th2)反应。
除了诱导T细胞免疫外,mRNA疫苗还诱导中和抗体。T滤泡辅助细胞(T follicular helper,Tfh)不仅对生发中心(germinal center,GC)的发生至关重要,还驱动免疫球蛋白类的转换、亲和力成熟和持久的B细胞记忆反应。尽管Tfh的确切机制尚未清楚,但这种细胞会被mRNA疫苗激活,然后产生足够数量、有效和持久的中和抗体[57]。Pardi等[58]将脂质纳米颗粒包裹的mRNA疫苗用于皮下注射,发现可以诱导小鼠和非人灵长类动物产生抗原特异性CD4+T细胞、B细胞和浆细胞反应以及高效的中和抗体。疫苗的接种方式决定了抗原表达的持续时间(肌肉注射较皮内注射表达的时间长),持续的抗原表达导致高抗体滴度以及生发中心B细胞和Tfh反应[59]。
4 mRNA疫苗的抗肿瘤免疫应答策略
多种技术可以改善mRNA的传递、组成、免疫原性或可译性。然而,大多数肿瘤疫苗试验很难在晚期或难治性肿瘤患者中发挥作用,其中,主要原因是无法高效诱导T细胞免疫反应。TAA是一种非突变自身抗原,通常能诱导中枢T细胞耐受[60]。所以针对肿瘤的免疫反应需要考虑几个具体的因素:疫苗应用的最佳时机、靶抗原的选择、与免疫佐剂的联用、对肿瘤微环境的改变以及与其他肿瘤治疗结合(图4)。这些策略可能会产生协同甚至相加的抗肿瘤效果。
4.1 疫苗应用时机
肿瘤疫苗通常在肿瘤达到一定大小或已经转移时使用。这时癌细胞与免疫系统进行了长时间的“互动”,可能已经形成了逃离免疫系统的机制,并削弱了疫苗诱导的抗癌免疫的治疗效果[61]。因此,为提高mRNA疫苗治疗效果,应在疾病的早期阶段(如辅助治疗期间)应用。如在一项随机的II期临床试验中,招募黑色素瘤术后且无复发的患者,进行自体DC递送编码TriMix的mRNA和编码4种TAA(MAGE-A3、MAGE-C2、酪 氨 酸 酶 或gp100)之一的mRNA共电穿孔治疗并与HLA II类靶向信号相关的疗效[62-63]。这种治疗耐受性良好,提高了患者1年无病存活率。研究者提出,与CPI联合治疗或靶向治疗可能会进一步提高高复发风险患者的存活率[63]。
4.2 靶抗原选择
肿瘤患者个体间的异质性会阻碍有效的免疫诱导,使产生的肿瘤免疫反应明显不同。肿瘤累积了数以千计的基因组突变,其中一小部分会产生新的抗原表位,这些表位可以被免疫系统识别,并抑制肿瘤生长。下一代测序(next generation sequencing,NGS)技术的进步可破译肿瘤患者的基因组、外显子组和转录组,从而针对肿瘤患者的个体免疫原性突变构建个性化mRNA疫苗,并实现快速大量生产,极大地推动了个性化肿瘤治疗的进展[64-65]。
4.3 免疫佐剂联用
在mRNA疫苗系统中添加免疫佐剂可以增强mRNA疫苗的免疫原性。如用诺华公司生产的佐剂MF59和阳离子纳米乳剂(cationic nanoemulsion,CNE)配制的自扩增RNA疫苗,在各种动物模型中被证明可以增强mRNA疫苗的免疫原性和有效性[7,66]。某些免疫调节分子也具有佐剂活性。TriMix是布鲁塞尔大学开发的一种新的佐剂策略,由编码三种免疫激活蛋白的mRNA组成CD70、CD40配 体(CD40L)和TLR4[30,62,67]。TriMix mRNA可以增加裸露的、未修饰的、未纯化的mRNA的免疫原性,它还与增强DCs的成熟度和细胞毒性T淋巴细胞反应有关[67]。2018年,Leal等[68]采用TriMix裸体mRNA策略治疗获得性免疫缺陷综合征 (acquired immune deficiency syndrome,AIDS)患者。使用大剂量TriMix mRNA的治疗表明,可以刺激和检测到高的人类免疫缺陷病毒(human immunodeficiency virus,HIV)特异性T细胞反应。这项研究已经证明了这种策略的高度安全性和耐受性。CureVac公司还开发了具有所谓自佐剂活性的RNActive®疫苗。它们只包含有体外转录的mRNA和鱼精蛋白复合的络合物[69-70]。这种递送的mRNA尤其增强了B和T细胞反应,包括T细胞效应和记忆反应,以及Th1和Th2细胞和GC B细胞等亚群的扩张[42,69]。在临床前模型中,RNActive®疫苗可有效预防不同的流感病毒株,并显示出抗肿瘤效果[42,70-72]。疫苗可有效预防不同的流感病毒株,并显示出抗肿瘤效果[72-73]。
4.4 改变肿瘤微环境
肿瘤微环境(tumor microenvironment,TME)中存在的几个免疫细胞是免疫抑制环境中的关键调节细胞,促进了肿瘤的发生以及血管生成和转移[74]。其中,癌相关成纤维细胞(cancerassociated fibroblasts,CAF)和肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)可被认为是在TME中发现的最丰富的非肿瘤细胞且TAMs对环境刺激有显著的反应潜力,许多研究表明,TAMs的调节可以诱导抗肿瘤T细胞反应[75-78]。已有研究表明,使用IVT mRNA编码TAMs[79],通过CAR-T纳米颗粒技术将其送入肿瘤内,可以诱导肿瘤相关DCs(tumor-associated DCs,TADC)的局部调节[80]。TME中肿瘤细胞与各种免疫组分的相互作用可以显著影响肿瘤细胞的生长。大多数肿瘤细胞通过表达免疫抑制蛋白如程序性死亡配体1(PD-L1)、产生免疫抑制因子如IL-10和趋化因子、招募免疫抑制细胞如调节性T细胞、M2巨噬细胞和髓系来源的抑制细胞来进行免疫逃逸,这种促进肿瘤生长的微环境导致T细胞的无能和耗尽,从而延长了肿瘤细胞的存活期[61,81]。因此,理想的肿瘤疫苗可以改善局部免疫细胞组成,恢复肿瘤免疫监视。免疫检查点已被证明能影响肿瘤微环境的结构,并且有重新激活和扩大原有T细胞或诱导新的抗癌免疫反应的潜力[82]。免疫检查点抑制剂能够维持一次诱导的免疫反应,并防止T细胞耗竭标志物的上调,这使它们成为mRNA疫苗的有效伴侣[83]。例如,免疫检查点抑制剂与编码Trp2的mRNA疫苗相结合,在C57BL/6小鼠B16F10黑色素瘤模型中诱导了强大的TAA特异性免疫反应,从而抑制了肿瘤的生长[83]。在这个模型中,PD-L1 siRNA和mRNA疫苗的联合传递下调了抗原呈递DC中PD-L1的表达,从而增加了T细胞的激活和增殖[83]。
5 mRNA肿瘤疫苗临床研究进展
mRNA经DC递送的疫苗是第一个进入临床试验的mRNA治疗性肿瘤疫苗[30]。目前基于IVT mRNA的疫苗主要分为3部分,mRNA编码免疫刺激剂、TAA和TSA。在大多数临床试验中,mRNA肿瘤疫苗已被应用于治疗侵袭性、难治性和转移性实体肿瘤,并进一步与检查点调节剂或细胞因子结合以增强抗肿瘤效果。这一部分综述了mRNA编码的免疫刺激剂、肿瘤相关抗原和肿瘤特异性抗原肿瘤疫苗在临床的应用,以及讨论个性化疫苗和带有检查点阻断调节剂的联合免疫疗法的优势。
mRNA编码的免疫刺激剂通常是细胞因子或趋化因子,它们诱导APC成熟和并激活APC,激活T细胞介导的免疫,并调节功能失调的免疫肿瘤微环境。已经被用来编码免疫刺激剂的mRNA,目前大多数评估处于I/II阶段,并评估单一治疗或与其他药物(包括PD-1/PD-L1抗体或肿瘤疫苗)联合治疗的耐受性(表1)。
抗原选择是开发有效的肿瘤疫苗的基础。肿瘤疫苗可以被设计成针对在恶性肿瘤细胞中优先表达的TAA。例如,酪氨酸酶、gp100、MAGE-A3、MAGE-C2已被确定为黑色素瘤的TAA。在多项临床研究中,编码所有TAA的mRNA疫苗已经用于治疗转移性黑色素瘤(表2)。
多种因素限制了TAA疫苗的广泛应用,如:a.仅在某些实体肿瘤中发现有限的TAA,从而限制了其应用;b.TAA具有广泛的变异性,导致免疫效应逃逸和产生耐药性;c.正常组织中也存在TAA。针对TAA的疫苗可能会引发中枢和外周免疫耐受反应,从而降低疫苗接种效率。肿瘤特异性抗原,又称为新抗原,是目前mRNA疫苗的核心靶点。新抗原来源于肿瘤细胞中的随机体细胞突变,而正常细胞中不存在。新抗原可以被宿主免疫系统识别为一个“非我”组分,因此是肿瘤疫苗的一个显著靶点[84]。开发个性化新抗原疫苗最关键的的一步是鉴定和确认患者肿瘤中表达的特异性免疫原性非同义体细胞突变。首先进行肿瘤组织活检。肿瘤组织的活检是为了进行完整的外显子组、RNA或转录组测序。可以通过比较肿瘤和匹配的健康组织的序列来识别肿瘤中的非同义体细胞突变,如点突变和插入缺失。接着使用MHC-Ⅰ类表位预测算法筛选、分析和鉴定具有最高免疫原性的突变。进一步确认候选抗原的排序列表。基于新抗原的个性化疫苗可以针对各种类型的变异突变[84](表3)。
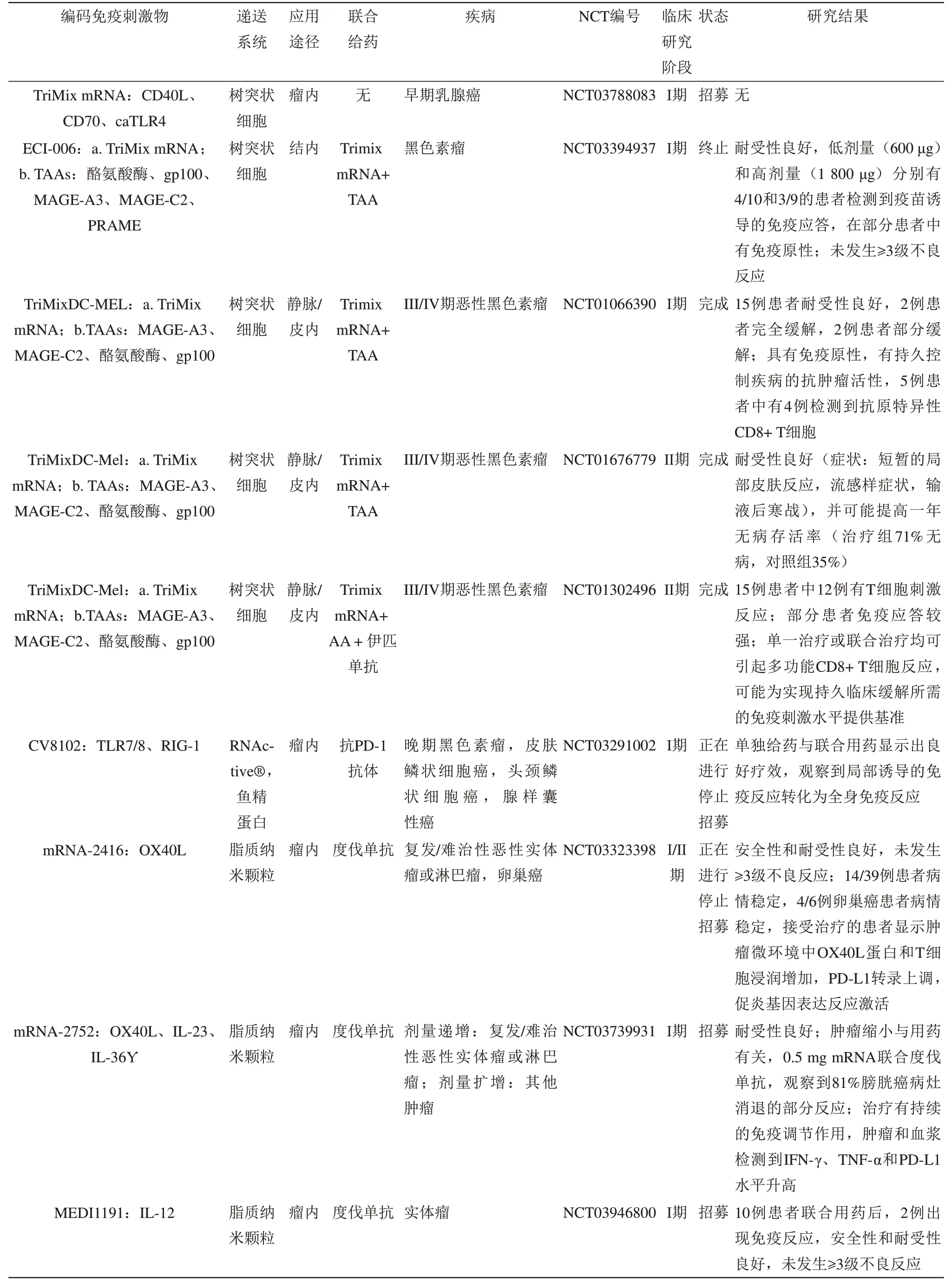
Table 1 Clinical trials of mRNA encoding an immunostimulant表1编码免疫刺激剂的mRNA的临床试验

Table 2 Clinical trials of mRNA encoding TAAs表2编码TAAs的mRNA的临床试验

Table 3 Clinical trials of mRNA encoding neo-antigen(Neo-Ag)表3编码新抗原(Neo-Ag)mRNA的临床试验

续表3
6 安全与挑战
直到2020年,世界上还没有批准单一的mRNA疫苗治疗方案。自新型冠状病毒肺炎(COVID-19)疫情爆发以来,美国食品药品监督管理局(FDA)批准了针对严重急性呼吸综合征冠状病毒2(SARS-CoV-2)的不同mRNA疫苗,证明mRNA疫苗针对新出现的传染病大流行具有快速有效的生产优势。然而,与传染病类疫苗针对明确抗原的预防性接种不同,大多数肿瘤靶标抗原表现出高度的个体间异质性,且数量有限、特征不明显,mRNA肿瘤疫苗安全性、有效性问题显得尤为突出。开发肿瘤疫苗的另一挑战在于抗癌治疗性疫苗需要激活MHC-Ⅰ介导的CD8+T细胞反应,这进一步增加了有效抗肿瘤免疫的难度。作为一种治疗性肿瘤疫苗,需要较大用药剂量、且多次重复给药。治疗性肿瘤疫苗需要对mRNA的生产有更高的安全性标准[85]。
mRNA疫苗的安全性体现在以下几个方面。a.mRNA肿瘤疫苗可以同时编码多种抗原,具有非整合性、高度可降解性、无插入诱变潜力等特点。b.IVT产生的mRNA不含细胞和致病病毒成分,没有感染的可能性,在正在进行的临床试验中测试的大多数mRNA疫苗通常耐受性良好,很少出现注射部位免疫反应[86]。全身性炎症也可以通过去除dsRNA等污染物或改变给药途径等方式将先天免疫反应限制在局部注射部位。由于I型干扰素反应的激活可能与自身免疫有关,所以在mRNA疫苗接种之前必须评估个体自身免疫反应增加的风险[25]。c.mRNA肿瘤疫苗的另一个优点是生产速度快。成熟的mRNA制造技术可以在短时间内生产出新型疫苗。最近新抗原的发现和鉴定促进了个性化疫苗治疗的发展。mRNA疫苗先驱BioNTech和Moderna领导的治疗实体肿瘤的临床试验展示了个性化疫苗强大的抗肿瘤免疫功能[87],开启了治疗性肿瘤疫苗的新纪元。为了进一步提高mRNA疫苗的抗癌效力,应当联合使用特定佐剂、CPIs、T细胞激活单克隆抗体、调节肿瘤微环境(如细胞因子)或联合放射治疗或化疗,以克服免疫逃逸机制以提高疫苗效力。目前有多项以评估mRNA疫苗与其他肿瘤疗法的联合应用疗效的临床试验正在进行。这些临床试验有助于发现更安全、更高效的抗肿瘤疗法,以提高肿瘤患者的生存质量。
综上所述,mRNA是一种功能强大、用途广泛的肿瘤疫苗治疗方式,有望显著提高肿瘤临床治疗效果。未来的研究应集中(但不限于)解决mRNA矛盾的免疫原性、设计先进和可耐受的递送系统,来提高抗原表达和提呈的效率,以及优化mRNA的结构以达到延长和控制表达持续时间的目的。此外,应继续发展肿瘤个性化疫苗,提高患者的生存率和生活质量。

