洋川芎内酯A 联合表柔比星干预膀胱癌5637 细胞的作用机制研究
林 磊,杨树立,孙超群,李宝山
(1.平顶山市第一人民医院泌尿外科,河南 平顶山 467000;2.河南大学第一附属医院泌尿外科,河南 开封 475000)
膀胱癌的发病率和病死率在泌尿系统恶性肿瘤中居首位,其发病率预计在未来十年内将持续上升,严重损害公众健康[1]。 膀胱癌分为非肌层浸润性膀胱癌和肌层浸润性膀胱癌,大多数患者为非肌层浸润性膀胱癌,经尿道膀胱肿瘤切除术后复发率为 75%[2]。 膀胱癌由于其高复发率和转移率而不易治愈,化疗或其他全身治疗对其疗效有限,五年生存率低于 50%[3]。 表柔比星(EPI)也称表阿霉素,是经尿道前切除至非肌层浸润性膀胱癌,用以预防癌症复发和进展最常用的膀胱内化疗药物之一[4]。但随着耐药性的出现,使其应用受到很大限制。因此,迫切需要寻找联合用药方案,增加膀胱癌细胞对EPI 的敏感性。 洋川芎内酯类化合物提取自中药川芎、当归等伞形科植物,主要包括洋川芎内酯A(SEA)、洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯D、洋川芎内酯F、洋川芎内酯J、洋川芎内酯M、洋川芎内酯 Q 等[5]。 现代药理学证明,洋川芎内酯化合物具有抗氧化损伤、抗炎、镇痛、抗凝及抗血小板聚集、舒张血管等多种药理作用[6-11]。 近年来的临床应用和实验研究表明,中药及中药活性成分治疗膀胱癌具有明显优势。 已有研究报道,SEA 具有抑制结肠癌细胞增殖的作用[11]。 但目前还没有关于SEA 调节膀胱癌细胞对EPI 敏感性方面的研究,本文旨在研究SEA 影响膀胱癌5637 细胞对EPI 敏感性的作用。
1 材料和方法
1.1 试验药物
SEA(批号M4427)购自美国AbMole 生物技术公司。 化学式 C12H16O2,相对分子质量为 192.25424,纯度>98%。
1.2 试验动物
12 只SPF 级裸鼠购自北京维通利华实验动物技术有限公司,雄性,6 周龄,体质量(20±3)g,许可证号 SCXK(京)2015-0001。 于 SPF 级别动物饲养房饲养。 保持湿度30%,气温20~25 ℃,每周更换灭菌垫料,按时添加裸鼠饲料及饮水。 动物实验伦理审批号:2020-1011。
1.3 试验试剂
EPI(批号 XY-1752-250)购自美国 biovision 公司;洛斯维·帕克纪念研究所(RPMI)1640 培养基(批号 61870-127)、胎牛血清(批号 26400-036)、青-链霉素(批号 15140-122)、胰蛋白酶(批号 25200-056)购自美国 Gibco 公司;CCK-8 试剂盒(批号 C0037)、BCA 蛋白浓度测定试剂盒(批号P0012)购自上海碧云天生物技术研究所;Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(批号G003-1-2)购自南京建成生物工程研究所;Anti 多药耐药关联蛋白 1(MRP1,批号 ab233383)、增殖细胞核抗原(PCNA,批号ab92552)、裂解的半胱氨酸天冬氨酸蛋白酶-3(cleaved caspase-3,批号ab2302)、拓扑异构酶-Ⅱ(Topo-Ⅱ,批号 ab109524)购自英国 Abcam 公司;Anti 肺耐药蛋白(LRP,批号610512)购自美国 BD 公司。
1.4 试验仪器
全自动多功能酶标仪(型号BS-1101)购自北京华泰和合商贸有限公司;流式细胞仪购自美国BD公司;全自动凝胶成像分析系统(型号ZF-288)购自上海金鹏分析仪器有限公司;电热恒温培养箱(型号DHP-360S)购自上海高致精密仪器有限公司。
1.5 细胞培养
人输尿管上皮永生化细胞SV-HUC-1 和人膀胱癌细胞5637 来源于中国科学院典型培养物保藏委员会细胞库,将细胞培养于RPMI 1640 培养基(含10%胎牛血清、1×105U/L 青霉素和 1×105U/L 链霉素)中,置于5%二氧化碳、37 ℃的恒温培养箱中培养。 培养基 2 d 更换一次,3~4 d 传代一次,实验用细胞为对数生长期细胞。
1.6 CCK-8 检测细胞活力与增殖
将人输尿管上皮永生化细胞SV-HUC-1 和人膀胱癌细胞 5637 接种于 96 孔板(100 μL/孔)孵育 24 h 后,用不同剂量(0、0.5、1、5、10、20、40、80、160 μmol/L)SEA 处理细胞,每孔加入 10 μL CCK-8 溶液孵育 4 h,在450 nm 处用酶标仪测定光密度(OD)值,并计算半数抑制浓度(IC50)值。 选用人膀胱癌细胞5637 进行后续实验。
1.7 细胞分组
采用SEA 处理人膀胱癌细胞5637 细胞,将细胞分为对照组、SEA 低剂量组(SEA10 组)、SEA 中剂量组(SEA20 组)、SEA 高剂量组(SEA40 组)、EPI 单独处理组(EPI 组)和联合处理组(SEA40+EPI 组)。SEA 低、中、高剂量组分别用 10、20、40 μmol/L 剂量 SEA 处理细胞,EPI 质量浓度为 1.2 μg/mL[4],联合处理组SEA 剂量为40 μmol/L。
1.8 流式细胞仪检测细胞凋亡
取对数生长期细胞离心5 min,弃上清,收集细胞,用PBS 重悬细胞并计数;取1×105重悬细胞,3500 r/min 离心5 min,离心半径 8 cm,弃上清,加入500 μL 结合液轻轻重悬细胞,加入 5 μL Annexin VFITC,轻轻混匀;再加入5 μL 碘化丙啶,轻轻混匀。室温避光孵育10 min。 用流式细胞仪进行检测,Annexin V-FITC 为绿色荧光,PI 为红色荧光。 Q1 为坏死细胞,Q2 为晚期凋亡细胞,Q3 为正常细胞,Q4为早期凋亡细胞,细胞凋亡率=Q2+Q4。
1.9 裸鼠移植瘤模型建立[12]
各组裸鼠后肢腹侧皮下分别注射0.2 mL 的1×107个/mL 膀胱癌细胞5637 悬液,接种24 h 后将裸鼠随机分为对照组、SEA 药物组、EPI 药物组和SEA+EPI组。 SEA 组裸鼠灌胃 SEA 20 mg/kg[13-15],EPI 组裸鼠皮下接种部位注射 EPI 0.002 mg/kg[16],SEA+EPI组灌胃SEA 20 mg/kg 并同时于皮下接种部位注射EPI 0.002 mg/kg,对照组灌胃等量生理盐水并于皮下接种部位注射等量生理盐水,连续30 d。
1.10 肿瘤体积
模型建立后每隔5 天用游标卡尺记录所成瘤的长径和短径,肿瘤体积 = 长径×短径2×1/2[17]。 在第30 天记录移植瘤的长径和短径后,断颈法处死裸鼠。
1.11 免疫蛋白质印迹(Western Blot)法检测MRP1、LRP、Topo-Ⅱ、PCNA、cleaved caspase-3 蛋白表达
先将各组待测细胞与裸鼠移植瘤肿瘤组织用PBS 清洗3 次,再加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取,BCA 试剂盒测定蛋白质含量,提取等量的蛋白质样品,100 ℃变性5 min。 然后进行SDS-PAGE 凝胶电泳分离并转移至PVDF 膜,5%的BSA 室温封闭1~2 h 后加入相应的一抗,4 ℃过夜孵育,次日,清洗后再加入辣根过氧化物酶标记的二抗,室温孵育1 h,清洗。 最后加入发光液后,于凝胶成像仪进行曝光拍照,并用ImageJ 软件统计灰度值,计算相对表达量。 GAPDH 作为上样量参照,至少重复三个独立的实验。
1.12 统计学方法
使用SPSS 17.0 软件对实验数据进行统计学分析。 数据表示为,各组间比较采用方差分析法。取α=0.05 为检验水准。
2 结果
2.1 SEA 对SV-HUC-1 细胞和人膀胱癌5637 细胞活力的影响
采用CCK-8 试剂盒检测SV-HUC-1 细胞和5637癌细胞活力,见图 1。 与 0 μmol/L 剂量时相比,5637癌细胞 10、20、40 μmol/L 剂量时细胞存活率显著降低,差异具有统计学意义(P<0.05),SV-HUC-1 细胞80 μmol/L 剂量时细胞存活率显著降低,差异具有统计学意义(P<0.05);5637 癌细胞 40 μmol/L 剂量时细胞存活率显著低于SV-HUC-1 细胞40 μmol/L剂量,差异具有统计学意义(P<0.05)。 通过计算得出 SV-HUC-1 细胞 IC50值为 148.754 μmol/L,5637 膀胱癌细胞 IC50值为 94.273 μmol/L,说明 SEA 对 SVHUC-1 细胞和5637 癌细胞具有杀伤力,且对5637膀胱癌细胞杀伤力高于SV-HUC-1 细胞。
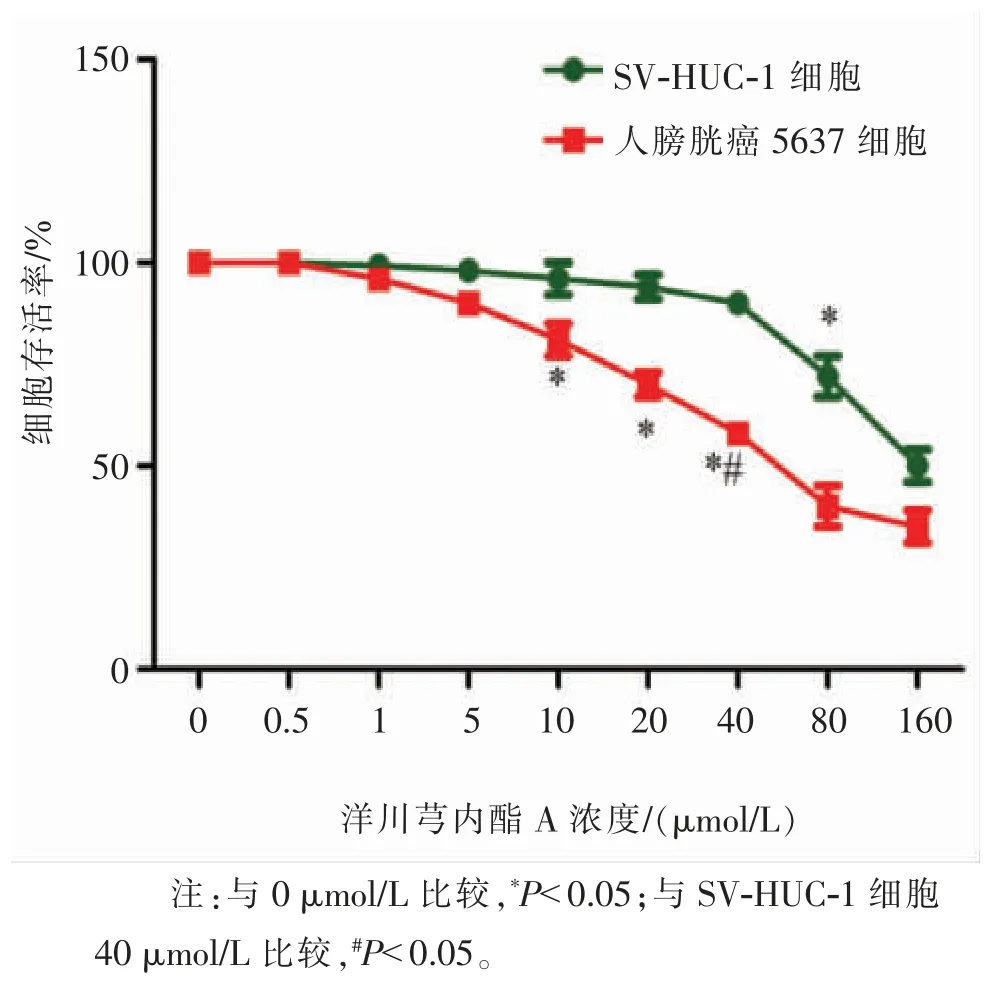
图1 洋川芎内酯A 对SV-HUC-1 细胞和人膀胱癌5637 细胞活力的影响
2.2 SEA 对人膀胱癌5637 细胞凋亡和增殖的影响
采用流式细胞仪检测人膀胱癌5637 细胞凋亡结果。 对照组细胞凋亡率显著低于SEA20 组和SEA40组,EPI 组细胞凋亡率显著高于对照组,SEA40+EPI组细胞凋亡率显著高于EPI 组,差异均有统计学意义(P<0.05)。 对照组 450 nm 处 OD 值显著高于SEA20 组、SEA40 组和 EPI 组,SEA40+EPI 组 450 nm处OD 值显著低于EPI 组,差异均有统计学意义(P<0.05)。 见图 2、表 1。
表1 洋川芎内酯A 对人膀胱癌5637 细胞凋亡与增殖的影响()
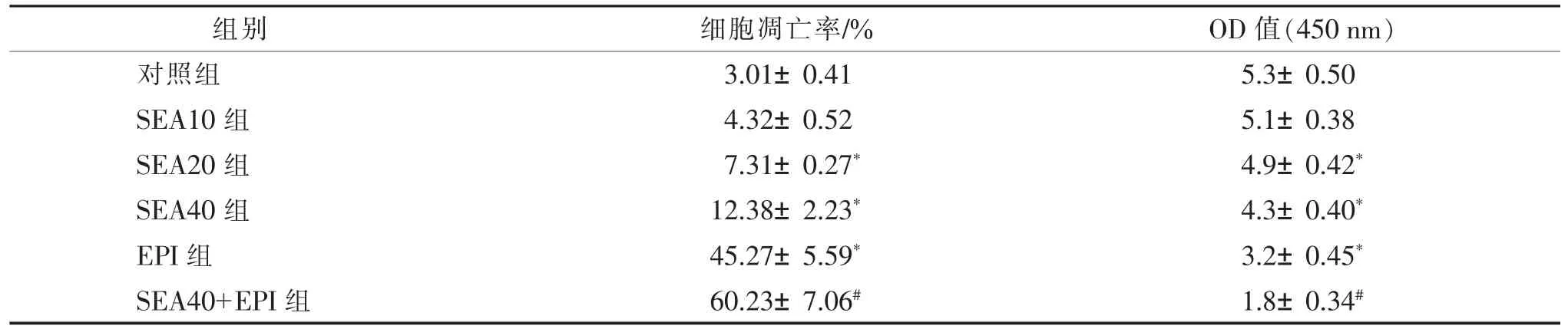
表1 洋川芎内酯A 对人膀胱癌5637 细胞凋亡与增殖的影响()
注:SEA 为洋川芎内酯 A,EPI为表柔比星,OD 为光密度。 与对照组比较,*P<0.05;与 EPI 组比较,#P<0.05。
组别 细胞凋亡率/% OD 值(450 nm)对照组 3.01±0.41 5.3±0.50 SEA10 组 4.32±0.52 5.1±0.38 SEA20 组 7.31±0.27* 4.9±0.42*SEA40 组 12.38±2.23* 4.3±0.40*EPI 组 45.27±5.59* 3.2±0.45*SEA40+EPI 组 60.23±7.06# 1.8±0.34#

图2 洋川芎内酯A 对人膀胱癌5637 细胞凋亡的影响
2.3 SEA 对人膀胱癌 5637 细胞 MRP1、LRP、Topo-Ⅱ蛋白水平的影响
采用Western Blot 检测人膀胱癌细胞5637 中MRP1、LRP、Topo-Ⅱ蛋白水平,结果如表 2、图 3 所示。 对照组MRP1 蛋白水平显著高于SEA20 组和SEA40 组,EPI 组MRP1 蛋白水平显著高于对照组,SEA40+EPI 组MRP1 蛋白水平显著低于 EPI 组,差异均有统计学意义(P<0.05);对照组LRP 蛋白水平显著高于 SEA20 组和 SEA40 组,EPI 组 LRP 蛋白水平显著高于对照组,SEA40+EPI 组LRP 蛋白水平显著高于 EPI 组,差异均有统计学意义(P<0.05);对照组Topo-Ⅱ蛋白水平显著低于SEA20 组和SEA40组,EPI 组 Topo-Ⅱ蛋白水平显著低于对照组,SEA40+EPI 组Topo-Ⅱ蛋白水平显著高于EPI 组,差异均有统计学意义(P<0.05)。
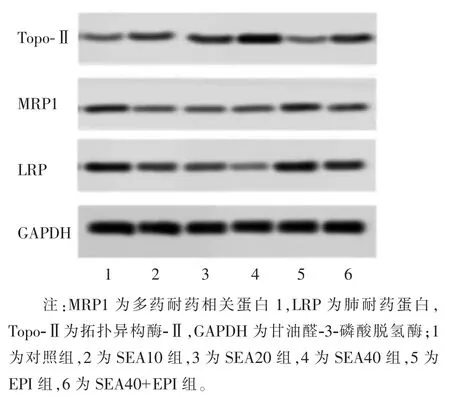
图3 洋川芎内酯A 对人膀胱癌5637 细胞MRP1、LRP、Topo-Ⅱ蛋白水平的影响
表2 洋川芎内酯 A 对人膀胱癌 5637 细胞 MRP1、LRP、Topo-Ⅱ蛋白水平的影响(,kDa)
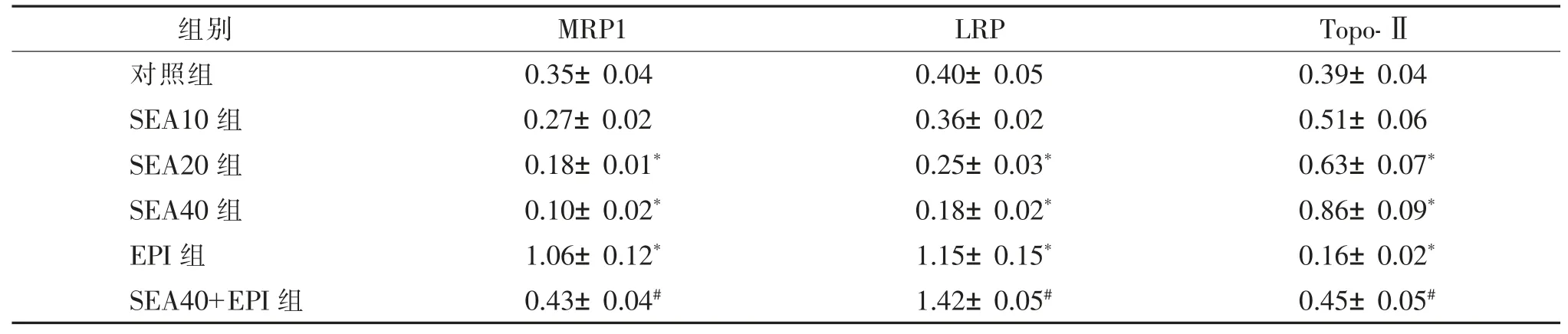
表2 洋川芎内酯 A 对人膀胱癌 5637 细胞 MRP1、LRP、Topo-Ⅱ蛋白水平的影响(,kDa)
注:SEA 为洋川芎内酯A,EPI为表柔比星,MRP1 为多药耐药相关蛋白1,LRP 为肺耐药蛋白,Topo-Ⅱ为拓扑异构酶-Ⅱ。 与对照组比较,*P<0.05;与 EPI 组比较,#P<0.05。
组别 MRP1 LRP Topo-Ⅱ对照组 0.35±0.04 0.40±0.05 0.39±0.04 SEA10 组 0.27±0.02 0.36±0.02 0.51±0.06 SEA20 组 0.18±0.01* 0.25±0.03* 0.63±0.07*SEA40 组 0.10±0.02* 0.18±0.02* 0.86±0.09*EPI 组 1.06±0.12* 1.15±0.15* 0.16±0.02*SEA40+EPI 组 0.43±0.04# 1.42±0.05# 0.45±0.05#
2.4 SEA 对裸鼠移植瘤模型肿瘤生长的影响
构建裸鼠移植瘤模型,检测30 d 内肿瘤体积的变化,如图4 所示。 对照组肿瘤体积显著大于SEA药物组和EPI 药物组,SEA+EPI 组肿瘤体积显著小于EPI 药物组,差异均有统计学意义(P<0.05)。
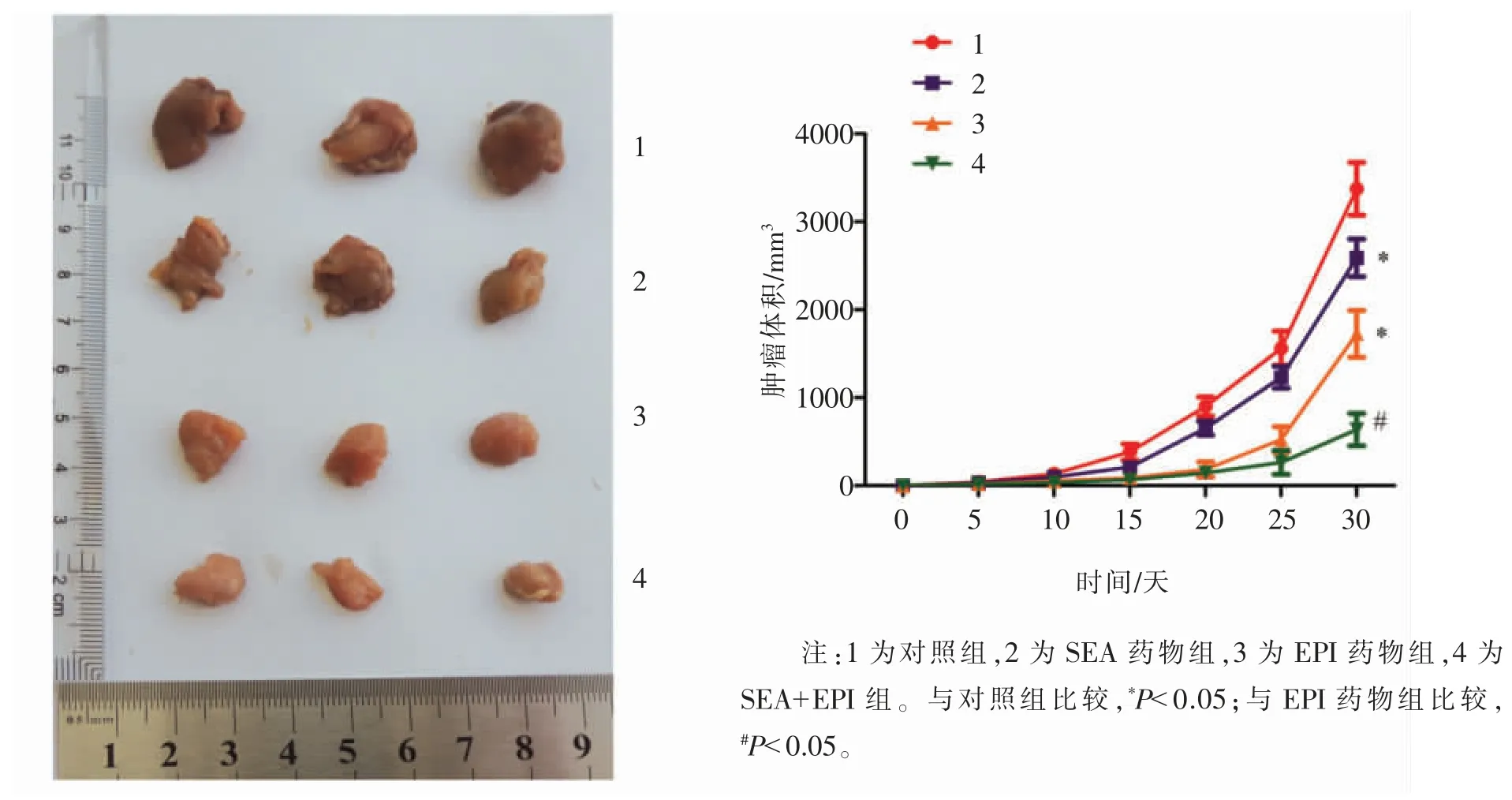
图4 洋川芎内酯A 对肿瘤生长的影响
2.5 SEA 对裸鼠移植瘤模型 MRP1、PCNA、cleaved caspase-3 蛋白水平的影响
Western Blot 检测裸鼠移植瘤中MRP1、PCNA、cleaved caspase-3 蛋白水平结果如表 3、图5 所示。对照组MRP1 蛋白水平显著高于SEA 药物组,EPI药物组MRP1 蛋白水平显著高于对照组,SEA+EPI组MRP1 蛋白水平显著低于EPI 组,差异均有统计学意义(P<0.05);对照组PCNA 蛋白水平显著高于SEA药物组和 EPI 药物组,SEA+EPI 组 PCNA 蛋白水平显著低于EPI 组,差异均有统计学意义(P<0.05);对照组cleaved caspase-3 蛋白水平显著低于SEA药物组和EPI 药物组,EPI 药物组cleaved caspase-3蛋白水平显著低于SEA+EPI 组,差异均有统计学意义(P<0.05)。
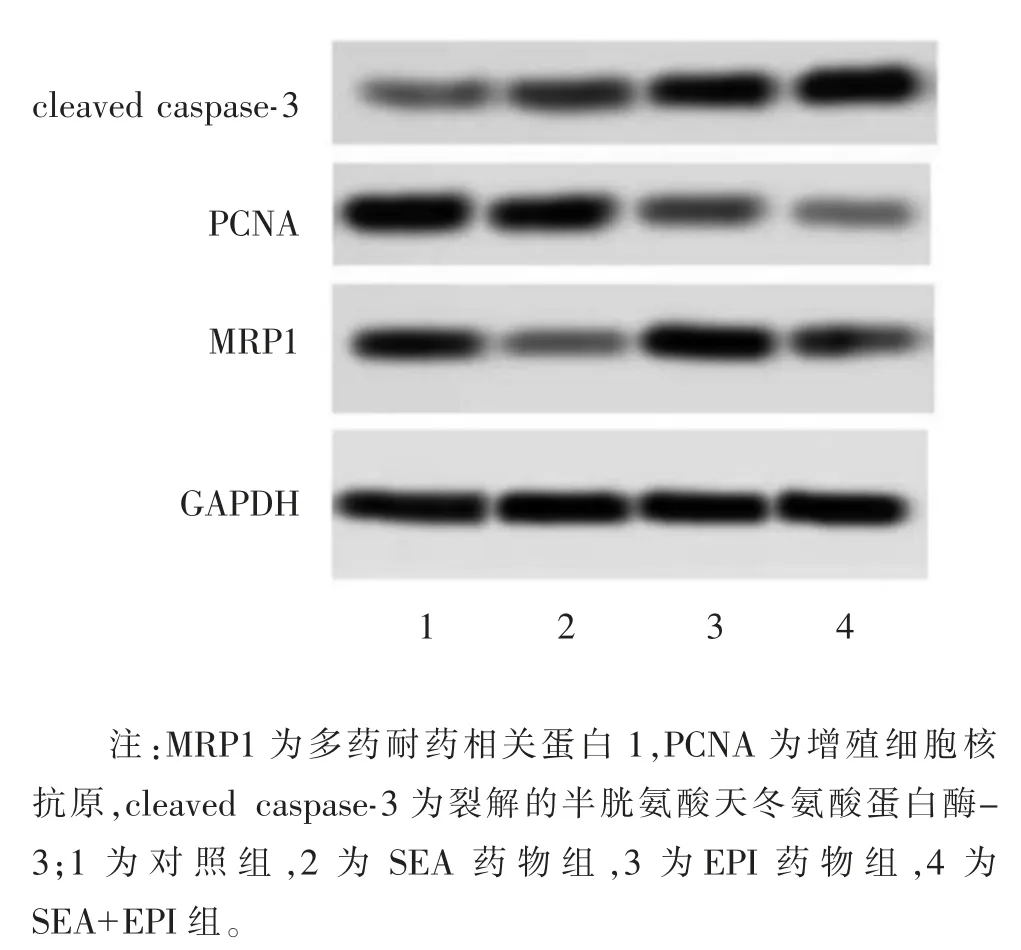
图5 洋川芎内酯A 对裸鼠移植瘤MRP1、PCNA、cleaved caspase-3 蛋白水平的影响
表3 洋川芎内酯A 对裸鼠移植瘤MRP1、PCNA、cleaved caspase-3 蛋白水平的影响(,kDa)
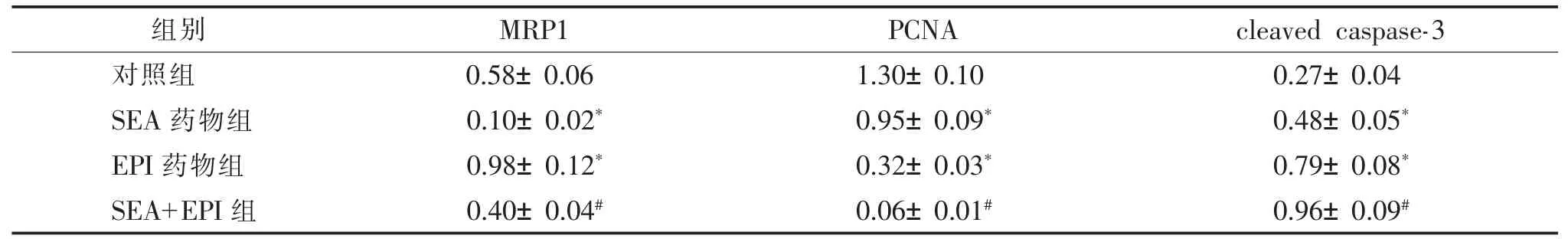
表3 洋川芎内酯A 对裸鼠移植瘤MRP1、PCNA、cleaved caspase-3 蛋白水平的影响(,kDa)
注:SEA 为洋川芎内酯A,EPI为表柔比星,MRP1 为多药耐药相关蛋白1,PCNA 为增殖细胞核抗原,cleaved caspase-3 为裂解的半胱氨酸天冬氨酸蛋白酶-3。 与对照组比较,*P<0.05;与EPI 药物组比较,#P<0.05。
组别 MRP1 PCNA cleaved caspase-3对照组 0.58±0.06 1.30±0.10 0.27±0.04 SEA 药物组 0.10±0.02* 0.95±0.09* 0.48±0.05*EPI 药物组 0.98±0.12* 0.32±0.03* 0.79±0.08*SEA+EPI 组 0.40±0.04# 0.06±0.01# 0.96±0.09#
3 讨论
膀胱癌是常见的尿路上皮恶性肿瘤,虽然可通过手术、化疗或放疗消除原发膀胱癌肿瘤,但肿瘤经常复发并可能发展为肌肉浸润性疾病[18-19]。 复发性肿瘤获得耐药性是限制癌症治疗的关键因素,常见化学制剂的耐药性涉及多种机制,这些机制可以是内在的,也可以是在治疗过程中获得[20]。
川芎多用于治疗脑血管和心血管疾病,包括中风、高血压、心率失常和内分泌失调等[21]。 SEA 是川芎的主要成分之一,用于治疗心脑血管疾病和偏头痛[22]。 Wang 等[23]研究发现 SEA 对结肠癌细胞 HT-29具有细胞毒性,并以剂量依赖的方式抑制其增殖。PCNA 又称周期数,是评价细胞增殖的指标,PCNA在膀胱癌的发生发展中起重要作用,检测其蛋白表达水平,可辅助常规病理诊断,改善膀胱癌患者的预后[24]。 本研究发现,SEA 具有下调 PCNA 蛋白表达、降低人输尿管上皮永生化细胞SV-HUC-1 和人膀胱癌细胞5637 细胞活力、抑制人膀胱癌细胞5637 细胞增殖的作用,与EPI 联合应用对膀胱癌细胞的杀伤性优于单独使用EPI。
细胞凋亡是响应异常和细胞损伤的重要细胞机制,异常凋亡反应在癌症发生发展过程中十分常见[25]。 细胞凋亡是细胞程序性死亡,治疗癌症的化学预防策略之一就是诱导细胞凋亡[26]。 杨帆等[27]研究发现茶多酚联合EPI 可通过上调cleaved caspase-3蛋白表达,增强EPI 对膀胱癌T24 细胞的致凋亡敏感性。 本研究结果与上述研究结果一致,SEA 上调人膀胱癌细胞5637 cleaved caspase-3 蛋白表达,促进人膀胱癌细胞5637 凋亡。 且SEA 与EPI 联合促细胞凋亡效果优于单独使用EPI,说明SEA 能增强EPI 对膀胱癌的敏感性。
对化学治疗药物的耐药性通过几种药物代谢发生。 MRP1 作为重要的ATP 结合盒转运蛋白,通过改变药物流入或外排影响细胞内药物浓度,且多重耐药是膀胱癌治疗的严重障碍[28]。 MRP1 的过表达可减少细胞内浓度、降低抗癌药物的细胞毒性,因此,抑制多药耐药蛋白表达是提高化疗敏感性的潜在途径。 Topo-Ⅱ是许多抗癌药的主要靶标。 当靶酶Topo-Ⅱ的活性和敏感性通过下调或突变降低时,发生对Topo-Ⅱ的耐药性[29]。 LRP 通过胞吐囊泡或泵分子从细胞内药物靶标中泵出药物来介导耐药性[30]。Wang等[31]研究发现川芎嗪通过下调 MRP1、LRP,上调 Topo-Ⅱ逆转人膀胱癌多药耐药。 Wang 等[32]研究发现白藜芦醇通过降低MRP1、LRP 表达水平,增加Topo-Ⅱ表达水平,从而改善膀胱癌耐药性。 本研究结果与上述研究结果一致,SEA 在体内与体外实验均可下调MRP1 水平,体外实验下调人膀胱癌细胞5637 LRP 蛋白水平,上调人膀胱癌细胞5637 Topo-Ⅱ蛋白水平,且与EPI 联合应用效果优于单独使用EPI。 说明SEA 具有降低EPI 耐药性的作用。
本文揭示了SEA 增加人膀胱癌5637 细胞对EPI 敏感性的作用:SEA 降低人输尿管上皮永生化细胞SV-HUC-1 和人膀胱癌细胞5637 细胞活力,促进人膀胱癌细胞5637 细胞凋亡,降低人膀胱癌细胞5637 MRP1、LRP 蛋白水平,升高人膀胱癌细胞5637 Topo-Ⅱ蛋白水平,抑制体内移植瘤生长,降低体内移植瘤MRP1、PCNA 蛋白水平,升高体内移植瘤cleaved caspase-3 蛋白水平,且与EPI 联合应用效果优于单独应用EPI。 本研究为治疗膀胱癌提供了新的方法和思路,也为EPI 与SEA 的联合应用提供了实验基础,但具体临床效果还待进一步研究。

