血清外泌体miR-454通过下调PDK1调控非小细胞肺癌的发生发展
董晓平,刘红岗,张 勇
(空军军医大学第二附属医院胸腔外科,陕西 西安 710038)
肺癌是人类最常见的癌症类型之一,也是全球癌症相关死亡的主要原因。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的85%,主要包括鳞状细胞癌和腺癌。尽管针对NSCLC的诊断和现有的分子治疗已经取得了进展,但患者的5年总生存率仍然很低,仅为19%[1]。而导致患者预后不良的主要原因是缺乏特异性的生物标志物及早期检测工具,因此大多数患者确诊时已处于晚期。外泌体是小的细胞外囊泡,直径为30~150 nm,具有免疫相容性和低毒性。外泌体通常在不同细胞之间转移生物分子,如蛋白质、脂质、mRNA和miRNA,从而在不同的病理生理过程中发挥作用[2]。肿瘤衍生的外泌体与肿瘤微环境中的其他细胞相互作用,可调控肿瘤的进展、转移和免疫逃逸[3]。虽然细胞外miRNAs可以与特定的RNA结合蛋白结合并在循环系统中运输,但外泌体miRNAs更稳定,是癌症治疗的理想靶点。miRNAs是内源性的小的非编码RNA,长度约为22个核苷酸,其可以结合到靶基因的特定区域,如3’非翻译区(3’UTR),以调控靶基因的降解或翻译抑制。因此,miRNAs通过靶向靶mRNAs,在肿瘤发生发展和细胞增殖、迁移、侵袭、凋亡等多种生物学过程中发挥关键作用[4]。据报道,外泌体的分泌可能导致癌细胞生物学行为的改变,miRNAs在NSCLC早期诊断中具有高度敏感性和特异性,可作为NSCLC患者诊断和治疗的潜在生物标志物[5]。以往研究发现,NSCLC患者血清外泌体中miR-454水平显著下调[6]。然而,外泌体miR-454在NSCLC中的作用及相关机制尚未完全明确。因此,本研究拟探讨外泌体miR-454对NSCLC发生发展的影响,以期为NSCLC的诊断和治疗提供理想的生物标志物。
1 材料与方法
1.1 材料
纳入2019年10月至2021年2月我院收治的NSCLC患者40例(NSCLC组),同时选取我院体检中心与之匹配的健康受试者40例(健康对照组)。所有NSCLC患者在试验前均未接受任何放疗或化疗。在获得受试者的书面同意后,采集其外周静脉血样本,离心后获得血清样本。冷冻保存管中的血清样品用液氮处理后在-80 ℃条件下保存。本研究方案已获得我院伦理委员会批准(伦理批号:KS2019027)。
1.2 主要试剂与仪器
人支气管上皮样细胞(human bronchial epithelial cells,HBE)、NSCLC细胞A549(武汉普诺赛生命科技有限公司);ExoQuick外泌体提取试剂盒、Exo-FectTMExosome转染试剂盒[安诺论(北京)生物科技有限公司];外泌体蛋白提取试剂盒(美国EZBioscience公司);MTT试剂盒(上海碧云天生物技术有限公司);膜联蛋白V(Annexin V)-FITC细胞凋亡检测试剂盒(北京百奥莱博科技有限公司);TRIzol试剂(美国Invitrogen公司);TaqMan miRNA试剂盒(美国Applied Biosystems公司);NC mimic、miR-454 mimic、NC inhibitor、miR-454 inhibitor(广州锐博生物科技有限公司);Vector、pcDNA-PDK1(上海生工生物工程有限公司);HSP70、CD63、CD81、E-cadherin、N-cadherin、Vimentin、PDK1一抗(美国Abcam公司)。透射电镜(日本Hitachi公司);多功能酶标仪(美国Biotek公司);实时荧光定量PCR仪(美国Thermo Fisher Scientific 公司)。
1.3 外泌体分离和鉴定
用ExoQuick外泌体提取试剂盒处理健康对照组和NSCLC组血清样本,然后根据说明书将上清液在4 ℃下离心(1 500 r/min)以获得外泌体,并使用透射电镜进行形态学鉴定。将提取的血清外泌体用4%多聚甲醛固定1 h,随后用PBS洗涤,然后将外泌体颗粒固定在2.5%戊二醛中,并装载到formvar碳包覆的电子显微镜网格上,在室温下保持5 min,随后使用标准的1%乙酸铀酰(pH 4.0)在室温下对外泌体颗粒染色10 min,用PBS洗涤网格后在透射电镜下观察。将提取的NSCLC患者血清外泌体和去除外泌体的血清分别设为外泌体组和血清组,使用Western blot检测外泌体中表面标志物HSP70、CD63和CD81蛋白的表达。
1.4 Western blot检测
根据说明书使用RIPA裂解缓冲液或外泌体蛋白提取试剂盒提取总蛋白。然后用10% SDS-PAGE凝胶电泳分离蛋白(浓缩胶90 V,分离胶110 V),并转移到PVDF膜上(电流200 mA,90 min)。使用5%脱脂牛奶在室温下封闭膜1 h,随后与一抗于4 ℃孵育过夜。使用TBST洗涤3次,将膜与二抗孵育1 h,然后用TBST冲洗。将膜放置在干净的玻璃板上,将增强化学发光试剂盒中等量的A溶液和B溶液在暗室中混合后加到膜上,对蛋白信号进行可视化,并使用Image J软件进行定量。
1.5 细胞培养与转染
根据说明书将HBE细胞置于添加10%无外泌体胎牛血清的RPMI 1640培养基中,将A549细胞置于添加10%无外泌体胎牛血清的Ham’s F-12 K培养基中,所有细胞均置于37 ℃、5% CO2培养箱中培养。按照说明书使用Exo-FectTMExosome转染试剂盒将NC mimic、miR-454 mimic、NC inhibitor、miR-454 inhibitor、miR-454 mimic+Vector、miR-454 mimic+pcDNA-PDK1分别转染到外泌体中,分别设为NC mimic组、miR-454 mimic组、NC inhibitor组、miR-454 inhibitor组、miR-454+Vector组、miR-454+pcDNA-PDK1组,检测转染效率。将A549细胞以2×103个/孔的密度接种到含10%无外泌体胎牛血清培养基的24孔板中,当汇合度为 50%~60%时,细胞与血清来源的外泌体(每孔 50 μL)共孵育24 h作为血清外泌体组,与不含外泌体的血清共孵育作为对照组。然后收集细胞进行细胞功能检测。
1.6 MTT实验
将A549细胞以5×103个/孔的密度接种到96孔板中,并置于37 ℃、5% CO2的培养箱中培养。培养0 h、24 h、48 h、72 h后,向每孔中加入10 μL MTT溶液孵育2 h,然后加入DMSO溶解结晶物,使用酶标仪测定570 nm处各孔的光密度(OD)值。
1.7 Transwell实验
分别使用预先涂有或未涂基质凝胶的Transwell小室进行侵袭或迁移实验。将在不含血清培养基中的A549细胞(2×104)接种到预先涂有或未涂Matrigel的上室,下室加入含10%胎牛血清的培养基。培养24 h后,细胞迁移或侵袭到腔室的下表面,用甲醛固定并用结晶紫染色。使用倒置显微镜观察迁移或侵袭细胞的形态。
1.8 流式细胞术
使用Annexin V-FITC细胞凋亡检测试剂盒检测细胞凋亡情况。收集细胞,用胰蛋白酶处理细胞并悬浮在PBS中。共收集5×104个细胞,用195 μL Annexin V-FITC结合缓冲液处理,然后用5 μL Annexin V-FITC和10 μL PI染色,随后在室温下避光孵育20 min。使用流式细胞仪检测细胞凋亡情况,并计算凋亡率。
1.9 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测
分别使用TRIzol试剂或外泌体RNA分离试剂盒从细胞或外泌体中分离总RNA。然后使用反转录试剂盒将1 μg总RNA转录为cDNA,并使用SYBR Green缓冲液扩增mRNA,进行RT-qPCR。反应条件:95 ℃预变性1 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸45 s,共40个循环。根据说明书使用TaqMan miRNA试剂盒检测miR-454的表达。以GAPDH和U6分别作为mRNA和miRNA的内参,采用2-△△Ct法计算目的基因的相对表达量。
1.10 双荧光素酶报告基因实验
生物信息学网站预测PDK1与miR-454的靶向关系。构建PMIR-GlO-PDK1 3’UTR野生型和PMIR-GlO-PDK1 3’UTR突变型重组报告载体,命名为PDK1-WT和PDK1-MUT。将A549细胞以1×105个/孔的密度接种到24孔板中,将miR-454 mimic或NC mimic与重组载体(PDK1-WT或PDK1-MUT)转染至细胞中,于37 ℃、5% CO2培养48 h后收集细胞,使用双荧光素酶分析系统检测相对荧光素酶活性。
1.11 统计学分析

2 结果
2.1 NSCLC患者血清中外泌体鉴定
透射电镜结果显示,外泌体形态为典型的脂质双层膜包裹的圆形颗粒。Western blot结果显示,与血清组比较,外泌体组中表面标志物HSP70、CD63和CD81蛋白的表达显著增加(P<0.05),见图1。
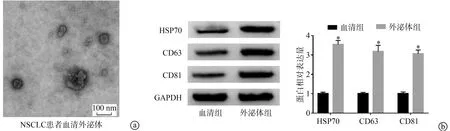
a:透射电镜观察分离的外泌体形态;b:Western blot检测HSP70、CD63、CD81蛋白的表达 *:与血清组比较,P<0.05
2.2 NSCLC患者血清外泌体对A549细胞增殖、侵袭、迁移及凋亡的影响
MTT实验结果显示,血清外泌体组细胞增殖能力较对照组增强,差异有统计学意义(P<0.05);流式细胞术结果显示,血清外泌体组中细胞凋亡率较对照组降低,差异有统计学意义(P<0.05);Transwell实验结果显示,血清外泌体组细胞侵袭和迁移能力较对照组增强,差异有统计学意义(P<0.05);Western blot结果显示,血清外泌体组中E-cadherin蛋白表达水平较对照组降低,N-cadherin以及Vimentin蛋白表达水平较对照组升高,差异均有统计学意义(P<0.05),见图2。

a:MTT实验检测细胞增殖;b:流式细胞术检测细胞凋亡;c:Transwell实验检测细胞迁移和侵袭;d:Western blot检测蛋白表达 *:与对照组比较,P<0.05
2.3 外泌体miR-454对A549细胞增殖、侵袭、迁移及凋亡的影响
与健康对照组比较,NSCLC组患者血清来源的外泌体中miR-454的表达降低,差异有统计学意义(P<0.05)。与HBE细胞相比,A549细胞中miR-454的表达降低,差异有统计学意义(P<0.05)。与NC mimic组比较,miR-454 mimic组中的miR-454表达显著升高,细胞增殖、侵袭和迁移能力降低,E-cadherin蛋白表达水平升高,N-cadherin及Vimentin蛋白表达水平降低,细胞凋亡率升高,差异均有统计学意义(P<0.05),见图3。

a:RT-qPCR检测NSCLC患者和健康对照组血清来源的外泌体中miR-454的表达;b:RT-qPCR检测A549和HBE细胞中miR-454的表达;c:RT-qPCR检测miR-454在外泌体中的转染效率;d:MTT实验检测细胞增殖;e:Transwell实验检测细胞迁移和侵袭;f:Western blot检测E-cadherin、N-cadherin和Vimentin蛋白的表达;g:流式细胞术检测细胞凋亡 *:与健康对照组比较,P<0.05;#:HBE细胞比较,P<0.05;△:与NC mimic组比较,P<0.05
2.4 PDK1与miR-454的靶向关系
PDK1是miR-454的靶基因之一,miR-454与PDK1 3’UTR之间具有特殊的结合位点。双荧光素酶报告基因结果显示,A549细胞转染miR-454 mimic和PDK1-WT后的荧光素酶活性显著低于转染NC mimic和PDK1-WT的细胞(P<0.05),而共转染miR-454 mimic和PDK1-MUT的细胞与共转染NC mimic和PDK1-MUT的细胞相比,其细胞的荧光素酶活性变化无统计学意义(P>0.05)。RT-qPCR和Western blot结果显示,与NC mimic组比较,miR-454 mimic组细胞中miR-454的表达显著升高(P<0.05),PDK1 mRNA和蛋白表达水平显著降低(P<0.05);与NC inhibitor组比较,miR-454 inhibitor组细胞中miR-454的表达显著降低(P<0.05),PDK1 mRNA和蛋白表达水平显著升高(P<0.05),见图4。

a:miR-454与PDK1 3’UTR的结合位点;b:双荧光素酶报告基因实验验证miR-454与PDK1的关系;c:RT-qPCR检测miR-454的转染效率;d、e:RT-qPCR和Western blot检测PDK1 mRNA和蛋白表达 *:与NC mimic组比较,P<0.05;#:与NC inhibitor组比较,P<0.05
2.5 PDK1在NSCLC患者血清外泌体和细胞中的表达
RT-qPCR和Western blot结果显示,与健康对照组比较,NSCLC组患者血清外泌体中PDK1 mRNA和蛋白表达水平显著升高(P<0.05);与HBE细胞比较,A549细胞中的PDK1 mRNA和蛋白表达水平均显著升高(P<0.05),见图5。
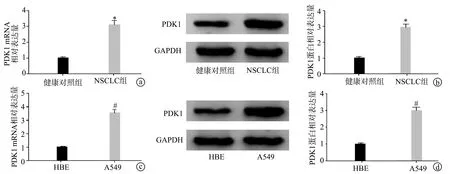
a、b:RT-qPCR和Western blot检测NSCLC组和健康对照组血清源外泌体中PDK1的表达;c、d:RT-qPCR和Western blot检测PDK1在HBE、A549细胞中的表达 *:与健康对照组比较,P<0.05;#:与HBE细胞比较,P<0.05
2.6 外泌体miR-454通过靶向PDK1对NSCLC细胞增殖、侵袭、迁移及凋亡的影响
与miR-454+Vector组比较,miR-454+pcDNA-PDK1组细胞中PDK1 mRNA和蛋白表达水平显著升高,细胞增殖、侵袭和迁移能力增强,E-cadherin蛋白表达水平降低,N-cadherin及Vimentin蛋白表达水平升高,细胞凋亡率降低,差异均有统计学意义(P<0.05),见图6、7。
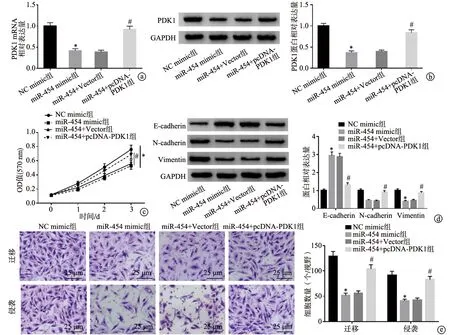
a、b:RT-qPCR和Western blot检测各组PDK1 mRNA和蛋白的表达;c:MTT实验检测细胞增殖;d:Western blot检测E-cadherin、N-cadherin和Vimentin蛋白的表达;e:Transwell实验检测细胞迁移和侵袭 *:与NC mimic组比较,P<0.05;#:与miR-454+Vector组比较,P<0.05

*:与NC mimic组比较,P<0.05;#:与miR-454+Vector组比较,P<0.05
3 讨论
NSCLC是全球癌症相关死亡的主要原因,尽管治疗策略取得了重大突破,但总体治愈率和存活率并不理想。有研究表明,外泌体具有作为肺癌早期诊断标志物的潜力[7]。从细胞膜上脱落或者由细胞分泌的具有双层膜结构的囊泡状小体被描述为外泌体、细胞外囊泡、微粒或微囊泡,其可以黏附并融合到循环细胞或远处的驻留细胞,传递细胞质成分。细胞通讯对于癌症的发展至关重要,肿瘤细胞与基质细胞之间的相互作用可重塑肿瘤微环境,并通过肿瘤间通讯影响肿瘤生长、侵袭和存活。研究报道,肿瘤来源的外泌体通过运输各种蛋白、脂质和核酸在细胞通讯中发挥重要作用[8]。已知肿瘤来源的外泌体可调节肿瘤生长、血管生成、肿瘤转移、耐药性和免疫逃逸。本研究亦发现,源自NSCLC患者的血清外泌体可显著促进NSCLC细胞增殖、迁移和侵袭,提示外泌体可作为NSCLC患者疾病监测和预后的生物标志物。
研究表明,肿瘤来源的外泌体至少可部分通过运输miRNAs介导肿瘤细胞的恶性进展,一些外泌体miRNAs已被认为是癌症生物标志物和治疗靶点[9-10]。先前研究报道,miR-454在NSCLC细胞外泌体中显著下调[6];此外,miR-454在NSCLC组织和细胞系中下调,miR-454过表达可显著抑制NSCLC细胞增殖和转移[11]。以上研究表明miR-454在NSCLC中可作为肿瘤抑制因子。本研究结果显示,NSCLC血清来源的外泌体miR-454过表达可诱导NSCLC细胞凋亡,且削弱了NSCLC细胞增殖、侵袭和迁移能力,与上述研究结果一致,提示miR-454可以通过外泌体转移抑制NSCLC的进展。
为了进一步研究miR-454在NSCLC中的作用机制,本研究筛选并鉴定了miR-454的靶基因PDK1,并通过双荧光素酶报告基因实验验证了两者的靶向关系。有研究发现,miR-454可通过靶向PDK1表达抑制人胶质母细胞瘤细胞增殖,本研究结果与之一致[12]。丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)是一种线粒体多酶复合物,可催化丙酮酸的氧化脱羧,是负责调节碳水化合物稳态的主要酶之一。丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)可以介导PDH磷酸化,从而导致PDH失活。PDK1在肾癌和乳腺癌等多种癌症中表达均升高[13-14]。miR-613通过调节PDK1抑制喉鳞状细胞癌的进展[15]。此外,PDK1的高表达与肺腺癌的发生和发展有关,有研究报道,PDK1在NSCLC组织中表达上调,过表达PDK1可促进细胞增殖,抑制细胞凋亡[16]。PDK1过表达可逆转miR-375对NSCLC细胞增殖和迁移的抑制作用[17]。本研究结果显示,PDK1在NSCLC血清来源的外泌体和细胞系中的表达均升高;PDK1作为miR-454的靶基因,其过表达逆转了miR-454对NSCLC细胞增殖、迁移和侵袭的抑制作用;此外,miR-454显著增加了NSCLC细胞中E-cadherin蛋白的表达,降低了N-cadherin和Vimentin的表达,而过表达PDK1逆转了这一结果,提示miR-454可通过靶向PDK1抑制NSCLC细胞的恶性进展。
综上所述,本研究探讨了外泌体miR-454在NSCLC中的作用,发现外泌体miR-454过表达阻断了NSCLC的发生发展,这一机制是通过抑制PDK1发挥作用的。因此,外泌体miR-454可能成为NSCLC诊断和治疗的新靶点。

