基于mTOR/HIF-1α/VEGF通路研究红芪多糖防治放射性肺损伤的作用机制
王 强,王 艺,张 莉,尚 芸,李亮亮,杜籼芹,李 爽,蔺兴遥, 2*
基于mTOR/HIF-1α/VEGF通路研究红芪多糖防治放射性肺损伤的作用机制
王 强1,王 艺1,张 莉1,尚 芸1,李亮亮1,杜籼芹1,李 爽1,蔺兴遥1, 2*
1. 甘肃中医药大学,甘肃 兰州 730000 2. 敦煌医学与转化教育部重点实验室,甘肃 兰州 730000
研究红芪多糖对放射性肺损伤(radiation-induced lung injury,RILI)的防治作用及其机制。雌性C57BL/6J小鼠随机分为对照组、模型组、红芪水煎液(5 g/kg)组及红芪多糖低、中、高剂量(15、30、60 mg/kg)组和吡非尼酮(200 mg/kg)组,每组8只。对照组佯装辐照,其余各组均采用单次16 Gy全肺X线辐照建立RILI模型。自造模前7 d,各给药组ig相应药物,1次/d,连续5周。所有小鼠均在取材前1 d进行肺功能检测;分别在造模前1 d及肺功能检测后进行CT影像学检测;采用苏木素-伊红(HE)染色观察小鼠肺组织病理变化;采用ELISA检测小鼠血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)水平;采用Western blotting检测小鼠肺组织中哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)及TNF-α蛋白表达。与对照组比较,模型组小鼠肺泡炎症明显,肺功能受损,肺部CT值升高(<0.01),血清中TNF-α及IL-6水平升高(<0.01),肺组织中mTOR、HIF-1α、VEGF及TNF-α蛋白表达上调(<0.01)。与模型组比较,红芪多糖组明显减轻小鼠肺泡炎症,改善肺功能,降低肺部CT值(<0.01),抑制血清中TNF-α及IL-6水平(<0.05、0.01),下调肺组织中mTOR、HIF-1α、VEGF及TNF-α蛋白表达(<0.05、0.01)。红芪多糖能够减轻小鼠RILI前期炎症的损伤,其机制可能与抑制mTOR/HIF-1α/VEGF信号通路有关。
红芪多糖;放射性肺损伤;肺功能;炎症;哺乳动物雷帕霉素靶蛋白/缺氧诱导因子-1α/血管内皮生长因子信号通路
放射性肺损伤(radiation-induced lung injury,RILI)包括前期放射性肺炎及后期放射性肺纤维化,是胸部放疗最常见的剂量限制性并发症[1]。由于RILI有许多促成因素和诊断环境,其报告的发病率差异显著,数据显示,RILI发病率最高的是肺癌(5%~25%),其次是纵隔淋巴瘤(5%~10%)和乳腺癌(1%~5%)[2]。RILI的发生不仅限制了放疗的最高剂量,降低了肿瘤的控制率,而且可导致呼吸困难等症状,影响患者生活质量,甚至后期可进展为呼吸衰竭,威胁患者生命。目前RILI的发病机制尚未完全阐明,国内外尚无针对RILI的特效药[3]。吡非尼酮是美国胸科学会/欧洲呼吸学会/日本呼吸学会/拉丁美洲胸科学会(ATS/ERS/JRS/ALAT)2022年更新的临床实践指南中,推荐用于治疗特发性肺纤维化的药物之一,具有抗炎、抗氧化和抗纤维化等特性[4-6],可用于治疗RILI。然而,长期应用吡非尼酮可能会使患者出现胃肠道症状、皮肤不良反应以及肝功能损伤等不良反应,在美国的一项III期临床试验中,14.4%的患者因为其不良反应不得不停止用药[7]。近年来,中医药在干预RILI的发生发展上取得了较好的疗效[8-9],因此,研究中医药防治RILI并探索其作用机制具有重要临床意义。
红芪多糖是甘肃省道地药材红芪Hand.-Mazz.中提取出的主要活性物质,具有抗炎、抗氧化、机体保护、免疫调节等多种药理作用[10-14]。此外,文献报道红芪多糖对内毒素诱导的急性肺损伤具有保护作用[15]。本课题组前期研究发现,红芪多糖可以明显改善博来霉素诱导的肺间质纤维化[16-17],而红芪多糖是否可以改善RILI目前尚未见报道。基于此,本研究建立RILI小鼠模型,通过小鼠肺功能检测、CT影像学检测、组织病理学检测等手段初步探讨红芪多糖对RILI的防治作用及机制。
1 材料
1.1 动物
SPF级雌性C57BL/6J小鼠56只,6~8周龄,体质量(20±2)g,购自斯贝福(北京)生物技术有限公司,实验动物质量合格证号SCXK(京)2019-0010,实验动物设施使用证号SYXK(甘)2020-0009。动物饲养于甘肃中医药大学实验动物中心,室温(23±2)℃,相对湿度40%~52%,12 h光照/ 12 h黑暗交替,动物自由进食饮水。动物实验经甘肃中医药大学动物实验伦理委员会批准(批准号2021-241)。
1.2 药材
红芪饮片购自甘肃省陇南市安化镇,经甘肃省药品检验研究院马潇主任药师鉴定为豆科植物多序岩黄芪Hand.-Mazz.的干燥根,符合《中国药典》2020年版规定。
1.3 药品与试剂
吡非尼酮胶囊(国药准字H20133376,批号20210414)购自北京康蒂尼药业股份有限公司;-无水葡萄糖(质量分数≥98%,批号B21882)购自上海源叶生物科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号2111M33)、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(批号2111M25)购自江苏菲亚生物科技有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号B1501)、TNF-α抗体(批号B7201)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体(批号N1301)、HRP标记的山羊抗兔IgG抗体(批号B0201)均购自美国Immunoway公司;缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)抗体(批号GR3368586-5)购自英国Abcam公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(批号No.43866)购自美国GeneTex公司。
1.4 仪器
MF-RO-10型实验动物饮用水处理器(杭州永洁达净化科技有限公司);X-RAD225型生物辐照仪(美国Precision X-ray公司);Inlivew-3000B型动物PET/SPECT/CT(北京永新医疗设备有限公司);WPB PLT-UNR-RT-2型动物肺功能仪(德国EMKA公司);SpectraMax i3x型多功能酶标仪(美国Molecular Devices公司);UV-power型紫外可见分光光度计(北京瑞利分析仪器有限公司);SCIENTZ-48型高通量组织研磨器(宁波新芝生物科技股份有限公司);WD-9405F型脱色摇床、DYY-60型电泳仪(北京六一生物科技有限公司);SFC-182型生物显微镜(麦克奥迪实业集团有限公司)。
2 方法
2.1 药物制备
2.1.1 红芪水煎液制备 红芪饮片加入8倍量纯水浸泡6 h后,煎煮1.5 h,滤过,再加入6倍量纯水煎煮1.5 h,合并2次滤液,浓缩得红芪水煎液。
2.1.2 红芪多糖提取纯化 红芪水煎液离心取上清液,进行4次醇沉(分别加入无水乙醇使溶液乙醇体积分数达到70%、80%、80%及90%),每次醇沉后静置24 h,取沉淀加入纯水溶解,离心,取上清液进行下一次醇沉。90%乙醇醇沉后滤过取沉淀,用无水乙醇洗3遍,50 ℃烘干后得红芪粗多糖。将红芪粗多糖用纯水配制为15 mg/mL多糖溶液,加入10%三氯乙酸溶液(多糖溶液与三氯乙酸溶液体积比为4∶1),低温剧烈振荡30 min,离心,取上清液,加入3倍体积95%乙醇溶液醇沉,滤过,干燥后得红芪多糖,1 kg红芪饮片提取纯化得红芪多糖6 g。
2.1.3 红芪多糖质量分数测定 以无水葡萄糖为标准品,配制质量浓度分别为0.024、0.035、0.047、0.059、0.071 mg/mL的葡萄糖溶液,苯酚硫酸法显色后通过紫外分光光度仪于485 nm处测得吸光度()值分别为0.244、0.362、0.501、0.629、0.750,以质量浓度为横坐标(),值为纵坐标()进行回归分析,得线性回归方程=10.808-0.014,=0.999 7。精密配制0.042 mg/mL红芪多糖溶液,测得值为0.364,代入回归方程得所提红芪多糖质量分数为83.27%。
2.2 动物分组、模型制备及给药
将56只雌性C57BL/6J小鼠随机分为对照组、模型组、红芪水煎液(5 g/kg)组及红芪多糖低、中、高剂量(15、30、60 mg/kg)组和吡非尼酮(200 mg/kg)组,每组8只。所有小鼠ip 3%戊巴比妥钠(40 mg/kg)麻醉,除对照组外,其余各组小鼠均仰卧固定于动物台,充分暴露肺部,进行单次16 Gy全肺X线辐照,未照射部位用铅块屏蔽,照射距离为48 cm,剂量率为2 Gy/min,照射时间8 min;对照组麻醉后佯装辐照。自造模前7 d,各给药组ig相应药物(20 mL/kg),对照组和模型组ig等体积0.9%氯化钠溶液,1次/d,连续5周。
2.3 一般状况观察
观察小鼠毛发改变、精神状态、活动度等,每周定时测量并记录小鼠体质量。于造模后28 d取材时测量肺组织质量并计算小鼠肺指数。
肺指数=肺质量/体质量
2.4 肺功能检测
于取材前1 d运用无约束全身体积描记仪对各组小鼠进行清醒状态下肺功能检测。将小鼠放入动物体积描记箱中,待其呼吸状态平稳时记录肺功能指标,包括吸气时间(Ti)、呼气时间(Te)、潮气量(TV)、每分钟通气量(MV)、吸气气流高峰(PIF)、呼气气流高峰(PEF)。
2.5 CT检测
分别于造模1 d前及肺功能检测结束后,对小鼠进行麻醉后CT检测。各组小鼠ip 3%戊巴比妥钠(40 mg/kg)麻醉,以俯卧位放置于小动物PET/CT床位,勾选全肺进行CT扫描。采用NMsoft-AIWS V1.7图像处理软件将扫描结果断层重建后融合显示,选用3D等值线限定CT值Min=−1000 HU、Max=0勾选全肺,软件统计小鼠肺部平均CT值。
2.6 肺组织病理学检测
各组小鼠麻醉后,股动脉取血,脱颈椎处死,取左肺,以10%甲醛溶液固定,经脱水、包埋、切片后,进行苏木素-伊红(HE)染色。采用Szapiel法评价肺泡炎症程度[18]:无肺泡炎症,记0分;轻度肺泡炎,肺泡间隔略微增宽,其间有炎性细胞浸润,病变面积小于全肺20%,记1分;中度肺泡炎,病变面积占全肺20%~50%,记2分;重度肺泡炎,病变面积占全肺50%以上,记3分。
2.7 ELISA检测血清中TNF-α和IL-6水平
各组小鼠全血常温静置2 h后,4 ℃、3000 r/min离心15 min,分离血清。按照ELISA试剂盒说明书检测小鼠血清中TNF-α和IL-6水平。
2.8 Western blotting检测肺组织中TNF-α、mTOR、VEGF和HIF-1α蛋白表达
取各组小鼠右肺组织,加入蛋白裂解液,低温匀浆裂解,用高通量组织研磨器(70 Hz)充分研磨肺组织,4 ℃、12 000 r/min离心15 min,分离上清液。用BCA蛋白定量试剂盒检测蛋白浓度,上清液加入蛋白上样缓冲液,沸水浴10 min,蛋白样品于−20 ℃保存备用。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用5%脱脂牛奶封闭2 h后,以TBST洗涤3次,分别加入相应抗体,4 ℃孵育过夜;TBST洗涤3次,加入HRP标记的山羊抗兔IgG抗体,室温孵育2 h,TBST洗涤后,均匀滴加ECL试剂,暗室曝光,用Image J 1.48V图像处理软件分析条带灰度值。
2.9 统计分析
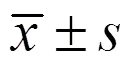
3 结果
3.1 一般状况观察
3.1.1 小鼠生存状况 如图1所示,对照组小鼠在实验过程中动作敏捷、精神良好、皮毛光泽。其余各组小鼠在辐照后均出现不同程度的动作减缓、精神萎靡。各给药组小鼠在辐照后7 d左右动作、精神状况逐渐恢复,模型组及吡非尼酮组小鼠恢复较慢。小鼠在辐照后21 d左右出现辐照部位毛发脱落。
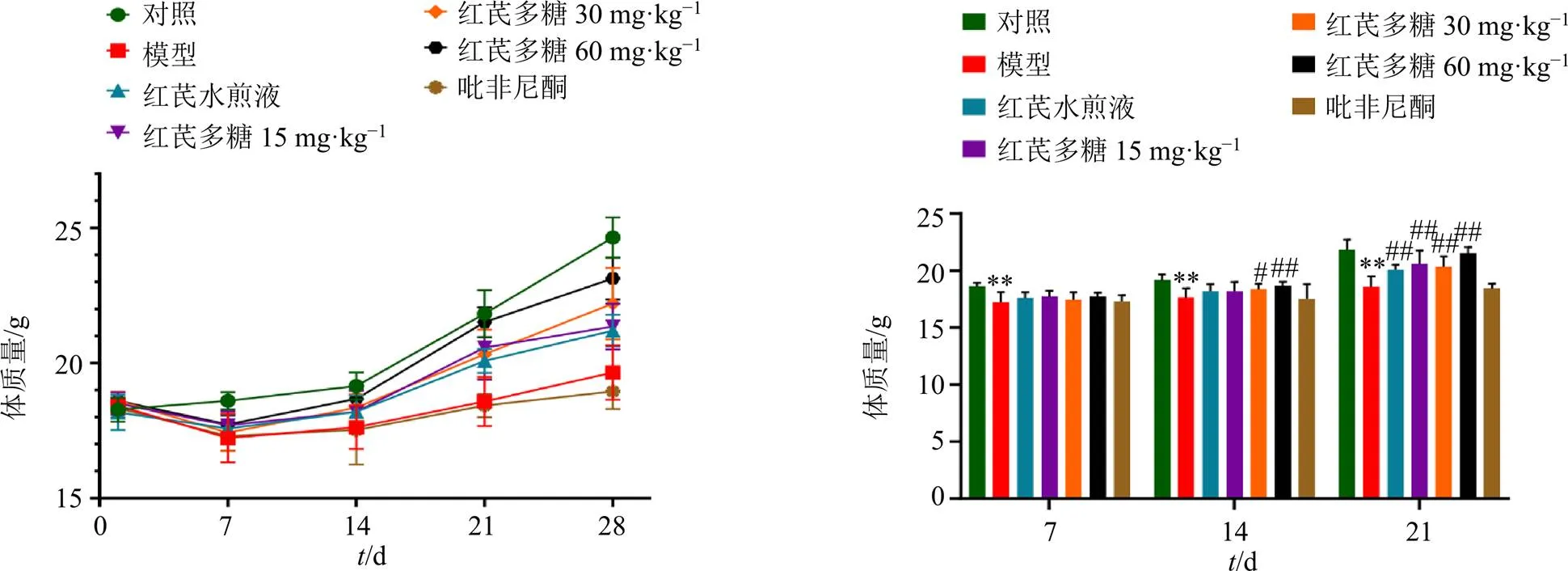
3.1.2 小鼠体质量变化 如图2所示,辐照后,除对照组小鼠体质量平缓上升外,其余各组小鼠体质量均在7 d内呈下降趋势,7 d后小鼠体质量开始逐渐恢复并上升。其中,模型组及吡非尼酮组上升最慢,红芪多糖高剂量组上升最快。7~21 d,与对照组比较,模型组小鼠体质量显著降低(<0.01)。14 d时,与模型组比较,红芪多糖中、高剂量组小鼠体质量显著增加(<0.05、0.01)。21 d时,除吡非尼酮组外,其余各给药组小鼠体质量均高于模型组(<0.01)。
3.2 肺组织病理学观察
如图3所示,对照组小鼠肺组织无明显病理学改变,结构清晰,轮廓完整。模型组小鼠肺组织破坏严重,可见支气管上皮细胞坏死脱落,肺泡间隔明显增宽,肺间质有大量炎性细胞浸润,血管肌层增厚,周围水肿。与模型组比较,各给药组均能在一定程度减轻小鼠肺组织炎症反应,其中红芪多糖中、高剂量组及吡非尼酮组效果较为明显。
图1 辐照后21 d各组小鼠脱毛情况
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01,下图同

图3 红芪多糖对RILI小鼠肺组织病理变化的影响 (HE, ×200)
如表1所示,与对照组比较,模型组小鼠肺指数和肺泡炎评分显著升高(<0.01);与模型组比较,红芪多糖低、中、高剂量组及吡非尼酮组小鼠肺指数显著降低(<0.01),吡非尼酮组和红芪多糖中、高剂量组小鼠肺泡炎评分显著降低(<0.05、0.01)。
表1 各组小鼠肺指数和肺泡炎评分(, n = 8)
与对照组比较,P<0.01;与模型组比较,P<0.05P<0.01,下表同
P< 0.01control group;P< 0.05P< 0.01model group, same as below tables
3.3 小鼠肺功能检测
于辐照后27 d对小鼠进行清醒状态下肺功能检测,如表2所示,与对照组比较,模型组小鼠Ti、TE显著升高(<0.01),PIF、PEF、TV及MV显著降低(<0.01)。与模型组比较,红芪多糖低、中、高剂量组及吡非尼酮组小鼠Ti、TE均显著降低(<0.05、0.01),MV显著升高(<0.01);红芪多糖中、高剂量组及吡非尼酮组TV及PEF显著升高(<0.05、0.01)。
3.4 小鼠肺组织CT值变化
如表2所示,辐照前各组之间小鼠肺部CT值无明显差异。辐照后27 d,与对照组比较,模型组小鼠肺部CT值升高(<0.01);与模型组比较,红芪多糖高剂量组及吡非尼酮组小鼠肺部CT值显著降低(<0.01)。
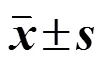
表2 各组小鼠肺功能指标及CT值(, n = 8)
3.5 血清中TNF-α和IL-6水平
如图4所示,与对照组比较,辐照28 d后模型组小鼠血清中TNF-α和IL-6水平均显著升高(<0.01);与模型组比较,红芪多糖中、高剂量组及吡非尼酮组小鼠血清中TNF-α和IL-6水平均显著降低(<0.05、0.01)。
3.6 肺组织中TNF-α、mTOR、VEGF和HIF-1α蛋白表达
如图5所示,与对照组比较,辐照28 d后模型组小鼠肺组织中TNF-α、mTOR、VEGF及HIF-1α蛋白表达水平均显著升高(<0.01);与模型组比较,红芪多糖中、高剂量组及吡非尼酮组肺组织中TNF-α、mTOR、VEGF及HIF-1α蛋白表达均水平显著降低(<0.05、0.01)。

图4 红芪多糖对RILI小鼠血清中TNF-α及IL-6水平的影响(, n = 8)

图5 红芪多糖对RILI小鼠肺组织中mTOR、HIF-1α、VEGF和TNF-α蛋白表达的影响(, n = 8)
4 讨论
RILI从临床上主要分为炎症期和纤维化期,炎症期常发生于1~3个月,纤维化期常发生于6~24个月,而从分子水平观察,RILI则是一个连续进展的过程。肺部辐照产生大量的活性氧和活性氮,氧化损伤DNA、脂质和蛋白质,从而导致肺泡上皮细胞和血管内皮细胞的损伤或凋亡。随后,许多炎性细胞被募集到损伤部位,并分泌大量细胞因子,进而产生一系列细胞因子级联反应,介导炎症反应及后期的纤维化[19]。由于肺纤维化的不可逆性及难治性,在肺炎时期采取积极的干预措施对防治RILI具有重要意义。
组织病理学、肺功能及CT影像学检测在诊断RILI中发挥重要作用,可有效评价RILI程度及发展阶段[20]。本研究根据文献调研及前期预实验结果综合分析,最终采用单次16 Gy全肺X线辐照建立RILI模型,于辐照后28 d取材。肺组织HE染色结果显示,模型组小鼠肺组织结构破坏严重,炎性细胞浸润明显;肺功能及CT检测结果显示,模型组小鼠肺功能明显受损,肺部CT值显著升高;而给予红芪多糖后可减少小鼠肺组织炎症细胞浸润,改善肺功能各项指标,降低肺部CT值。在肺功能检测结果中,红芪多糖组小鼠PIF虽较模型组有所提高,但差异不具统计学意义,可能是由于小鼠并没有自主用力吸气意识导致结果并不完全准确。RILI前期炎症CT影像学表现在动物模型中并不明显,可表现为均匀的斑片状、小结节状磨玻璃影或实变影等,在后期纤维化时可出现条状、带状纤维条索影等[21]。由于本研究只进行到辐照后28 d,小鼠尚未出现明显的肺纤维化,故通过比较各组间辐照前后CT值来统计分析CT结果。肺部CT值是X线辐照衰减在CT图像上的量化指标,能客观地评价肺组织密度,反映肺组织损伤程度,可应用于辅助诊断RILI[22]。以上结果表明RILI小鼠模型成功建立且红芪多糖对RILI具有一定保护作用。
在肺部辐照早期,TNF-α、IL-6等细胞因子的过度表达对RILI的发生发展起到了重要作用。TNF-α是RILI炎症阶段的启动因子,通过诱导黏附分子的表达,招募炎性细胞到组织损伤部位,启动炎性细胞产生氧化物,从而发挥促炎作用[23]。IL-6是下丘脑-垂体-肾上腺轴的内源性调节因子,在炎症过程中的免疫-神经内分泌调节中发挥重要作用[24]。临床研究亦显示,循环IL-6早期变化可作为预测放射性肺炎的指标[25]。因此,检测小鼠血清中TNF-α和IL-6水平可在一定程度反映RILI前期肺炎损伤情况,且在初始阶段对TNF-α和IL-6进行药理调控可能会阻止RILI的进展。本研究发现模型组小鼠辐照后血清中TNF-α及IL-6水平显著升高,而红芪多糖可下调TNF-α及IL-6水平,提示红芪多糖减轻RILI前期炎症损伤可能与抑制TNF-α及IL-6的释放有关。
Fleckenstein等[26]研究发现,RILI炎症期、纤维化期与组织缺氧有关。肺部辐照后几周内就会发生血管损伤,如内皮细胞肿胀导致毛细血管狭窄和闭塞、较大血管内纤维蛋白栓的形成及内皮细胞增生等,从而导致组织缺氧[27]。而在缺氧条件下,HIF-1α激活VEGF过表达,从而促进血管内皮细胞增殖,诱导血管生成,增加血管通透性,导致肺高渗性水肿和毛细血管内皮细胞损伤,引起肺部炎症[28-29]。mTOR是HIF-1α的上游基因,mTOR激活可以使HIF-1α入核,进而调控下游的VEGF表达,加重炎症损伤[30]。本研究结果显示,辐照后小鼠肺组织mTOR蛋白表达显著增加,并伴随着HIF-1α、VEGF及TNF-α上调;而红芪多糖可以降低小鼠肺组织中mTOR、HIF-1α、VEGF及TNF-α蛋白表达,表明红芪多糖改善RILI的作用可能与抑制mTOR/HIF-1α/ VEGF信号通路有关。
综上所述,红芪多糖有明显改善RILI炎症的作用,其机制可能与下调mTOR/HIF-1α/VEGF信号通路从而抑制TNF-α和IL-6等炎症因子的释放有关。吡非尼酮改善RILI前期炎症的总体效果优于红芪多糖,但从体质量变化趋势分析,吡非尼酮组小鼠辐照后体质量下降明显且恢复较慢,考虑为吡非尼酮诱发小鼠出现胃肠道反应甚至肝损伤所致。而红芪多糖中、高剂量组对前期肺炎也有较好的治疗作用,且辐照后体质量均快速回升,并未出现不良反应。由此可以考虑为红芪多糖的毒副作用低于吡非尼酮,需要进一步深入研究。本研究只进行到辐照后28 d,病理上处于放射性肺炎阶段,关于红芪多糖对RILI后期肺纤维化阶段的作用效果及机制有待后续探索研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Madani I, de Ruyck K, Goeminne H,. Predicting risk of radiation-induced lung injury [J]., 2007, 2(9): 864-874.
[2] Hanania A N, Mainwaring W, Ghebre Y T,. Radiation-induced lung injury: Assessment and management [J]., 2019, 156(1): 150-162.
[3] Xia C C, Shi W Y, Zhang Y Y,. Prevention and treatment of radiation-induced lung injury [J]., 2020, 12(23): 2161-2173.
[4] Raghu G, Remy-Jardin M, Richeldi L,. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: An official ATS/ERS/JRS/ALAT clinical practice guideline [J]., 2022, 205(9): e18-e47.
[5] Lopez-de la Mora D A, Sanchez-Roque C, Montoya-Buelna M,. Role and new insights of pirfenidone in fibrotic diseases [J]., 2015, 12(11): 840-847.
[6] 胡朝阳, 张小红, 常瑞, 等. 汉防己甲素片联合吡非尼酮治疗肺间质纤维化的临床研究[J]. 现代药物与临床, 2020, 35(4): 739-743.
[7] King T E Jr, Jr B, Castro-Bernardini S,. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis [J]., 2014, 370(22): 2083-2092.
[8] 张彦伟, 张志强, 吴丽贤, 等. 雷公藤内酯醇减少放射性肺纤维化中肌成纤维细胞活化与抑制TGF-β1/ERK/Smad3通路相关 [J]. 中国药理学通报, 2017, 33(5): 630-636.
[9] 刘炜, 骆新, 沈静. 补肺汤通过TGF-β/Smad3信号通路抑制小鼠肺纤维化的研究 [J]. 医药导报, 2020, 39(6): 747-752.
[10] 张, 周尚儒, 燕玉奎, 等. 红芪杂多糖及其透明质酸水凝胶对大鼠骨关节炎的治疗作用 [J]. 免疫学杂志, 2019, 35(1): 65-70.
[11] Zhao L G, Chen T Q, Feng D M,. Structural characterization and antioxidant activity of a heteropolysaccharide isolated from[J]., 2014, 16(6): 677-684.
[12] 杨杰, 卫东锋, 李晓东, 等. 红芪多糖对脑微血管内皮细胞氧化损伤保护作用的差异蛋白质研究 [J]. 中药药理与临床, 2016, 32(2): 113-118.
[13] 颜春鲁, 李钦, 姚贞宇, 等. 红芪多糖对免疫抑制大鼠免疫功能与细胞因子的影响 [J]. 中国临床药理学杂志, 2017, 33(13): 1233-1236.
[14] 赵良功, 方瑶瑶, 刘小花, 等. 红芪多糖对骨髓间充质干细胞和成骨细胞的影响[J]. 中草药, 2021, 52(2): 432-436.
[15] 耿广琴, 谢晓蓉, 王雅莉, 等. 红芪总多糖对急性肺损伤小鼠细胞因子及抗氧化功能的影响 [J]. 中国临床药理学杂志, 2017, 33(15): 1443-1446.
[16] 苏韫, 张毅, 李娟, 等. 红芪有效部位对肺间质纤维化模型大鼠肺组织胶原面积、透明质酸及层黏连蛋白的影响 [J]. 中国中医药信息杂志, 2016, 23(4): 72-76.
[17] 王艺, 张毅, 李娟, 等. 红芪多糖、红芪黄酮和红芪皂苷抗博来霉素致大鼠肺间质纤维化的作用 [J]. 中成药, 2022, 44(2): 573-578.
[18] Szapiel S V, Elson N A, Fulmer J D,. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse [J]., 1979, 120(4): 893-899.
[19] Huang Y J, Zhang W Q, Yu F R,. The cellular and molecular mechanism of radiation-induced lung injury [J]., 2017, 23: 3446-3450.
[20] 王绿化, 傅小龙, 陈明, 等. 放射性肺损伤的诊断及治疗 [J]. 中华放射肿瘤学杂志, 2015, 24(1): 4-9.
[21] 张安妮, 孙晶晶, 胡鈱琪. 放射性肺损伤影像学表现的研究进展 [J]. 肿瘤学杂志, 2021, 27(3): 236-240.
[22] Tao Q S, Zhu T, Ge X Q,. The application value of spiral CT lung densitometry software in the diagnosis of radiation-induced lung injury [J]., 2021, 2021: 9305508.
[23] Rübe C E, Wilfert F, Uthe D,. Modulation of radiation-induced tumour necrosis factor α (TNF-α) expression in the lung tissue by pentoxifylline [J]., 2002, 64(2): 177-187.
[24] Dai C D, Imaki T, Suda T,. Involvement of corticotropin-releasing hormone- and interleukin (IL)-6-dependent proopiomelanocortin induction in the anterior pituitary during hypothalamic-pituitary-adrenal axis activation by IL-1alpha [J]., 2005, 146(12): 5496-5502.
[25] Arpin D, Perol D, Blay J Y,. Early variations of circulating interleukin-6 and interleukin-10 levels during thoracic radiotherapy are predictive for radiation pneumonitis [J]., 2005, 23(34): 8748-8756.
[26] Fleckenstein K, Zgonjanin L, Chen L G,. Temporal onset of hypoxia and oxidative stress after pulmonary irradiation [J]., 2007, 68(1): 196-204.
[27] Yarnold J, Brotons M C V. Pathogenetic mechanisms in radiation fibrosis [J]., 2010, 97(1): 149-161.
[28] Zhang X J, Li J J, Li C F,. HSPA12B attenuates acute lung injury during endotoxemia in mice [J]., 2015, 29(2): 599-606.
[29] Lin F, Pan L H, Ruan L,. Differential expression of HIF-1α, AQP-1, and VEGF under acute hypoxic conditions in the non-ventilated lung of a one-lung ventilation rat model [J]., 2015, 124: 50-55.
[30] Hu Y, Liu J, Wu Y F,. mTOR and autophagy in regulation of acute lung injury: A review and perspective [J]., 2014, 16(9): 727-734.
Mechanism of hedysarum polysaccharides on preventing and treating radiation-induced lung injury based on mTOR/HIF-1α/VEGF signaling pathway
WANG Qiang1, WANG Yi1, ZHANG Li1, SHANG Yun1, LI Liang-liang1, DU Xian-qin1, LI Shuang1, LIN Xing-yao1, 2
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Key Laboratory of Dunhuang Medicine, Ministry of Education, Lanzhou 730000, China
To investigate the preventive effect and mechanism of hedysarum polysaccharides on radiation-induced lung injury (RILI).Female C57BL/6J mice were randomly divided into control group, model group,decoction (5 g/kg) group, hedysarum polysaccharides low-, medium-, high-dose (15, 30, 60 mg/kg) groups and pirfenidone (200 mg/kg) group, with eight mice in each group. Control group was feigned to be irradiated, other groups were accepted a single dose of 16 Gy X-ray irradiation to establish RILI model. Before 7 d of modeling, each administration group was ig corresponding drugs, once a day for five weeks. All mice were tested for pulmonary function at 1 d before sampling; CT imaging was performed before modeling and after pulmonary function test; Hematoxylin-eosin (HE) staining was used to observe the pathological changes in lung tissue of mice; ELISA was used to detect levels of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) in serum of mice; Western blotting was used to detect mammalian target of rapamycin (mTOR), hypoxia-inducible factor-1α (HIF-1α), vascular endothelial growth factor (VEGF) and TNF-α protein expressions in lung tissue of mice.Compared with control group, model group showed significant alveolar inflammation, impaired pulmonary function, and lung CT value was increased (< 0.01), TNF-α and IL-6 levels in serum were increased (< 0.01), mTOR, HIF-1α, VEGF and TNF-α protein expressions in lung tissue were up-regulated (< 0.01). Compared with model group, hedysarum polysaccharides group reduced alveolar inflammation, improved pulmonary function, reduced lung CT value (< 0.01), inhibited levels of TNF-α and IL-6 in serum (< 0.05, 0.01), and down-regulated mTOR, HIF-1α, VEGF and TNF-α protein expressions in lung tissues (< 0.05, 0.01).Hedysarum polysaccharides can effectively alleviate the inflammatory injury in early stage of RILI in mice, and its mechanism may be related to the inhibition of mTOR/HIF-1α/VEGF signaling pathway.
hedysarum polysaccharides; radiation-induced lung injury; lung function; inflammation; mammalian target of rapamycin/hypoxia-inducible factor-1α/vascular endothelial growth factor signaling pathway
R285.5
A
0253 - 2670(2022)21 - 6771 - 08
10.7501/j.issn.0253-2670.2022.21.014
2022-07-16
甘肃省人才发展专项资金(40160401);甘肃省中医药研究中心专项开放课题(zyzx-2020-zx19)
王 强,硕士研究生,研究方向为中西医结合防治肿瘤。E-mail: 1033618469@qq.com
蔺兴遥,硕士生导师,教授,从事中医药防治重大疾病基础与应用基础研究。E-mail: 878104134@qq.com
[责任编辑 李亚楠]

