重楼黄酮的提取工艺及其抗氧化功效验证
张正旭,褚佳豪,周云冬,吴迪,李学涛,彭效明,李翠清,居瑞军
(1.北京石油化工学院,北京 100000;2.云南白药集团股份有限公司,云南 昆明 650000;3.辽宁中医药大学,辽宁 沈阳 110000)
重楼为云南重楼或七叶一枝花的干燥根茎[1],具有清热解毒、消肿止痛、凉肝定惊的功效[2],对治疗跌打损伤有独特疗效[3],是多种中成药的主要原料之一[4-6]。重楼主要含有甾体皂苷、黄酮、多糖、植物脱皮激素和脂肪酸类等活性成分[7-8]。其中,黄酮化合物具有抗炎、杀菌、抗氧化和抗肿瘤等作用[9-11]。
黄酮类化合物是植物在生长过程中产生的一类次生代谢产物,主要贮藏在叶片之中,是药用植物的主要活性成分之一,具有抑制肿瘤细胞增殖、消除炎症、降低血压、抗衰老等生理活性[12-15],是制备功能性食品和开发高效、低毒天然药物的重要原材料。黄酮一般难溶于水,易溶于乙醇、正丁醇、乙酸乙酯等有机溶剂。常见的提取方法有有机溶剂萃取法、甲醇提取法、碱法及超临界流体(CO2)萃取法[16-17]。有机溶剂萃取虽然操作方便,提取率高,但得到的精制物中容易混入较多杂质,后续分离困难;碱法提取杂质较少,提取物纯度高,但提取率较低;超临界流体萃取需要在高压的环境下进行,对设备的要求高,提取成本大;甲醇提取法具有提取设备要求简单、产物杂质少、提取率高等优点,但甲醇具有挥发性和毒性[18]。因此,本研究采用乙醇-水溶液作为溶剂,对重楼中黄酮类化合物进行提取,并采用单因素试验及响应面试验优化提取工艺条件,随后利用大孔吸附树脂进行纯化,以上样量、径高比、洗脱液浓度为指标,进行正交试验,优选最佳纯化精制工艺,并对取得的精制物进行抗炎功效验证,希望为重楼加工以及黄酮相关制品的制备工艺提供理论依据。
1 仪器与试剂
1.1 主要仪器 UV2600型紫外-可见光分光光度计(上海舜宇恒平科学仪器有限公司);SCIENTZ-10型冷冻干燥机(宁波新芝生物科技有限公司);DF-101T型集热式加热磁力搅拌器(河南省予华仪器厂);Centrifuge 5418 R型冷冻高速离心机(德国Eppendorf);HBS-1096A型酶标仪(南京德铁实验设备有限公司)。
1.2 药物与试剂 重楼(产地云南,云南白药健康产品有限公司);无水乙醇、氢氧化钠(分析纯,北京化工厂);芦丁对照品(批号:512E031)、硝酸铝-九水合物、CCK-8、ABTS二铵盐、Na2EDTA、连苯三酚、K[Fe(CN)6](大连美仑生物技术有限公司);亚硝酸钠(分析纯,天津福晨化学试剂厂);AB-8、D101、H103、SP825、HP-20大孔吸附树脂(沧州华众环保科技有限公司);FeSO4·7H2O、K2S2O8、三氯乙酸(天津市科密欧化学试剂有限公司);水杨酸(北京索莱宝科技有限公司);Tris(批号:409F051,北京索莱宝科技有限公司);抗坏血酸(批号:CAN5456,富士フイルム和光純薬株式会社);DPPH[批号:1898-66-4,梯希爱(上海)化成工业发展有限公司]。
2 方法
2.1 芦丁线性关系考察 精密称取芦丁标准品5.0 mg,以纯化水定容至50 mL,配制成质量浓度为0.1 mg/mL的芦丁标准溶液。分别取芦丁标准溶液0、0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、2.0、2.2 mL到具塞试管中,加入70%乙醇水溶液1 mL,再加入5% NaNO2溶液0.3mL,摇匀静置6min,加入10% Al(NO3)3溶液0.3 mL,摇匀静置6 min,加入10% NaOH溶液3.0 mL,摇匀静置15 min,配制得到不同浓度芦丁标准品溶液,在510 nm波长下测定吸光度,绘制标准曲线,检测线性是否良好。
2.2 重楼黄酮样品的含量测定 取20 g重楼药材,在常温下粉碎,过10目筛。用60%乙醇按料液比为1∶10进行回流提取2次,提取时间为100 min,收集滤液为含黄酮的浸提液。滤液经减压浓缩,冷冻干燥得重楼黄酮样品D1,取适量重楼黄酮样品以60%乙醇水溶液溶解定容至100 mL,通过上述方法测定其黄酮含量。
2.3 单因素试验 根据“2.2”项下重楼黄酮的提取条件,固定料液比1∶10,提取时间100 min,考察乙醇浓度40%、50%、60%、70%、80%对重楼黄酮提取率的影响;固定乙醇浓度为60%,料液比1∶10,考察提取时间80、90、100、110、120 min对重楼黄酮提取率的影响;固定乙醇浓度为60%,提取时间100 min,考察料液比1∶6、1∶8、1∶10、1∶11、1∶12对重楼黄酮提取率的影响。
2.4 响应面试验设计 选定提取次数为2次,选用考察因数分别为乙醇浓度(X1)、提取时间(X2)、料液比(X3)。采用3因素3水平的Box-Behnken响应面法进行试验设计,以重楼总黄酮含量(Y)为因变量,优化提取工艺。因素值及水平值见表1。

表1 重楼黄酮提取的响应面设计试验因素和水平
2.5 静态吸附与解吸附 分别取10 g经过预处理的AB-8、D101、H103、SP825、HP-20大孔树脂装入250 mL的锥形瓶中,再加入浓度为0.175 mg/mL重楼黄酮D1粗提液100 mL,以25 ℃恒温振荡24 h,待树脂充分吸附粗提液后,过滤,测定滤液重楼总黄酮的含量,计算树脂的吸附量。
将上述吸附饱和的大孔树脂装入250 mL锥形瓶中,加入95%乙醇100 mL,25 ℃恒温振荡24 h充分解析后,过滤,测定滤液的重楼黄酮的含量,计算解析率。根据吸附率和解析率确定最适合的大孔树脂。
2.6 静态吸附曲线的绘制 分别取10 g经过预处理的D101大孔树脂装入250 mL的锥形瓶中,再加入浓度为0.08 mg/mL的重楼黄酮D1粗提液100 mL,25 ℃恒温水浴,200次/h振荡。每隔一段时间取样,进行吸光度检测,求得黄酮浓度,进而计算树脂吸附量。树脂进行3次重复试验,计算3次重复试验的平均值。
2.7 黄酮精制样品的制备 根据上述筛选的最佳树脂D101进行湿法装柱,将重楼黄酮D1粗提液配制成50 mg/mL,静态吸附3 h,然后分别用20%乙醇(2 BV)、40%乙醇(2 BV)及60%乙醇(4 BV)进行洗脱,收集洗脱液进行减压浓缩进行冻干,依次标注D2、D3和D4,取适量依次测量其含量。
2.8 重楼黄酮的抗氧化功效验证
2.8.1 DPPH自由基清除能力检测 取200 μL的待测液与等体积的2×10-4mol/L的DPPH溶液混匀(A1管);取等体积的水与2×10-4mol/L的DPPH溶液混匀(A2管);取等体积的无水乙醇与待测液混匀(A3管);反应30 min后,在520 nm下测A1、A2和A3管的吸光度值,按照下面公式计算各样品的自由基清除率。称量0.10 g VC粉末,用蒸馏水定容到100 mL容量瓶中,现用现配,作为阳性对照。每个样品设置6个不同的浓度,每个浓度重复测定5次。
清除率=[(A2+A3)-A1]/A2×100%
2.8.2 OH自由基清除能力检测 准确量取0.166 8 g FeSO4粉末,用蒸馏水定容到100 mL容量瓶中,现用现配。取25 μL的30%H2O2,加40.85 mL蒸馏水稀释混匀,现用现配。准确称量0.041 4 g水杨酸粉末,用无水乙醇定容到50 mL容量瓶中。称量0.10 gVC粉末,用蒸馏水定容到100 mL容量瓶中,现用现配,作为阳性对照。按照表3的方案加入各种试剂,然后在520 nm处测定吸光度值,按照下面公式计算各样品的清除率。每个样品设置6个不同的浓度,每个浓度重复测定5次。(见表2)

表2 OH 自由基清除能力反应体系
清除率=[(A-C)-(B-D)]/(A-C)×100%
2.8.3 ABTS自由基的清除能力检测 准确称取ABTS二铵盐60 mg,加蒸馏水16 mL溶解,准确称取K2S2O810.8 mg,加蒸馏水16 mL溶解,将等体积的ABTS与K2S2O8溶液混合,室温避光放置12 h,得ABTS备用液。ABTS备用液加10倍量的蒸馏水稀释,得ABTS检测液。取30 μL的待测液与300 μL的ABTS检测液混匀(A1管),取30 μL蒸馏水与300 μL的ABTS检测液混匀(A2管),取30 μL待测液与300 μL的蒸馏水混匀(A3管),各组混匀后,室温静置6 min,在405 nm下测A1、A2和A3管的吸光度值,按照下面公式计算各样品的自由基清除率。称量0.10 g VC粉末,用蒸馏水定容到100 mL容量瓶中,现用现配,作为阳性对照。每个样品设置6个不同的浓度,每个浓度重复测定5次。
清除率=[(A2+A3)-A1]/A2×100%
2.8.4 对Fe3+的还原能力检测 取200 μL待测液,分别加入等体积的磷酸盐缓冲液(pH值=6.6)及1%K[Fe(CN)6],混匀后于50 ℃的电热恒温水浴锅中放20 min。急速冷却,取出后向各管加入200μL的10%三氯乙酸,混匀后,3 500 r/min离心10 min。取上层清液200 μL,依次加入200 μL蒸馏水和50 μL的0.1%FeCl3,混匀,作为待测组分。在630 nm处测定吸光度值(A)。A越大,则样品的还原力越大。称量0.20 g VC粉末,用蒸馏水定容到100 mL容量瓶中,现用现配,作为阳性对照。每个样品设置6个不同的浓度,每个浓度重复测定5次。
3 结果
3.1 芦丁标准曲线 采用亚硝酸钠-硝酸铝显色法测定重楼中总黄酮的标准曲线,根据测定的一系列浓度和对应的吸光度值,将数据拟合。方程为:Y=12.126X-0.022 2,R2=0.999 3。表示线性较好,可用于试验操作。(见图1)

图1 芦丁标准曲线
3.2 单因素试验结果
3.2.1 乙醇浓度 随着乙醇浓度的增加,总黄酮提取量呈先升高后降低趋势。当重楼黄酮含量达到最大值时乙醇浓度为60%,故选取60%乙醇作为提取溶剂。(见图2)

图2 乙醇浓度对重楼黄酮提取效果的影响
3.2.2 提取时间 重楼黄酮含量随着提取时间的延长呈先升高后下降趋势。当提取时间为100 min时,重楼黄酮含量达到最大值。这可能由于随着时间的延长,重楼总黄酮在提取溶剂中被不断溶出,但随着时间延长,其他杂质也会随之明显增加,使得重楼黄酮含量下降。因此,选取提取时间为100min。(见图3)

图3 提取时间对重楼黄酮提取效果的影响
3.2.3 料液比 在较低料液比时重楼黄酮含量比较低,随着料液比的不断增加,重楼黄酮的含量也在不断增加。当料液比达到1∶10时,随着料液比的不断增加,重楼黄酮含量逐渐趋于稳定。出于时间、人力资源等因素考虑,选取料液比为1∶10。(见图4)
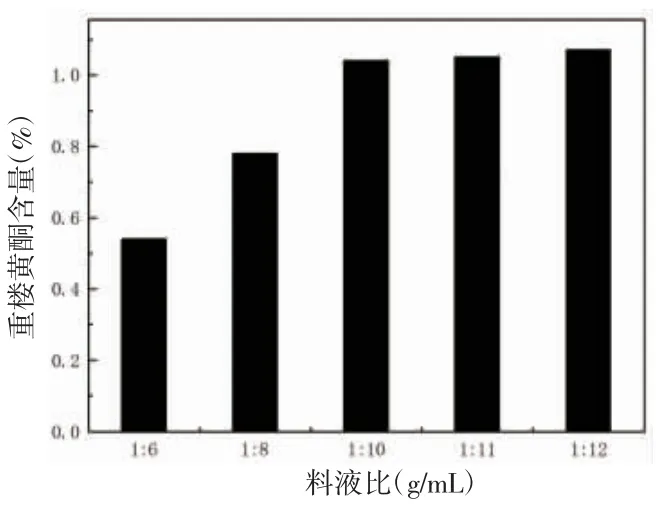
图4 料液比对重楼黄酮提取效果的影响
3.3 响应面法试验结果 重楼黄酮的响应面试验结果见表3,模型的方差分析见表4,各交互因素响应曲面及相应的等高线图见图5~7。利用软件对重楼黄酮含量的实验数据进行拟合,得到重楼黄酮含量和乙醇浓度(X1)、提取时间(X2)和料液比(X3)3三个自变量之间的模型。回归方程为:Y=1.06+0.13X1+0.12X2+10.045X3-7.000E-003X1X2+7.000E-003X1X2+7.250E-003X1X2-0.25X12-0.26X22-0.21X32。经过响应面的工艺优化,得到最优提取工艺条件为,提取乙醇浓度65.03%,提取时间104.75 min,料液比1∶10.23。为了方便实施操作,选取提取乙醇浓度65%,提取时间105 min,料液比1∶10为最佳提取工艺条件。

表3 重楼黄酮响应面实验结果

表4 重楼黄酮方差分析结果

图5 实验因素X1和X2 对结果Y 影响的响应图与等高线图

图6 实验因素X1和X3 对结果Y 影响的响应图与等高线图

图7 实验因素X2和X3 对结果Y 影响的响应图与等高线图
3.4 最佳树脂的选择 取质量浓度为0.175 mg/mL重楼黄酮D1提取液100 mL,进行大孔树脂吸附试验。试验结果显示大孔树脂吸附率由高到低依次为AB-8、D101、SP825、HP-20、H103,数据之间差异无统计学意义(P>0.05)。而大孔树脂解析率由高到低依次为HP-20、D101、SP825、H103、AB-8,数据间的差异较为明显。以上试验数据表明:虽然HP-20解析率相对优于D101,但究其原因是吸附量小于D101,导致解析率高于D101,解析量低于D101,综合比较纯化效果可知D101纯化效果最好。(见表5)
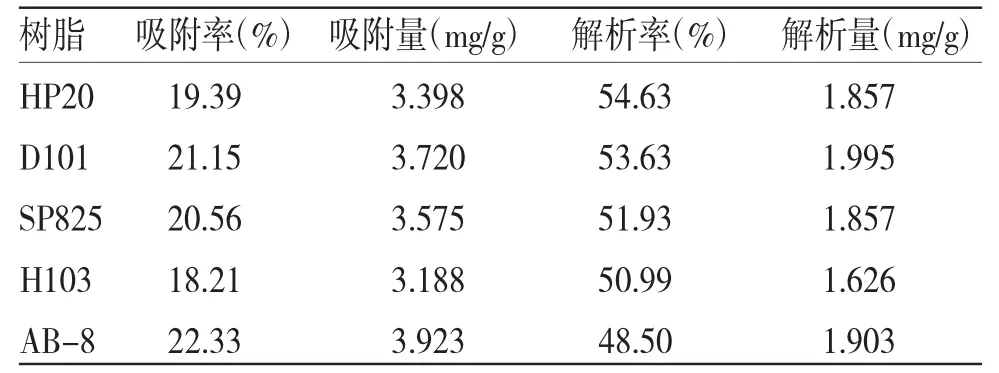
表5 5 种大孔树脂对重楼黄酮的吸附解析效果
3.5 静态吸附曲线 重楼黄酮静态吸附曲线见图8。在3 h内,D101大孔吸附树脂对重楼黄酮的吸附量随时间的增加而增加,在3 h后吸附趋于平衡状态,即3 h就可达到重楼黄酮静态吸附平衡,且最大吸附量为2.2 mg/g。

图8 大孔树脂吸附重楼黄酮吸附量随时间的变化关系图
3.6 黄酮精制样品的制备 用不同浓度的洗脱液进行梯度洗脱,收集不同洗脱段溶液进行减压浓缩、冷冻干燥,依次标注为D2、D3和D4,冻干后称质量并测定其含量,结果见表6。
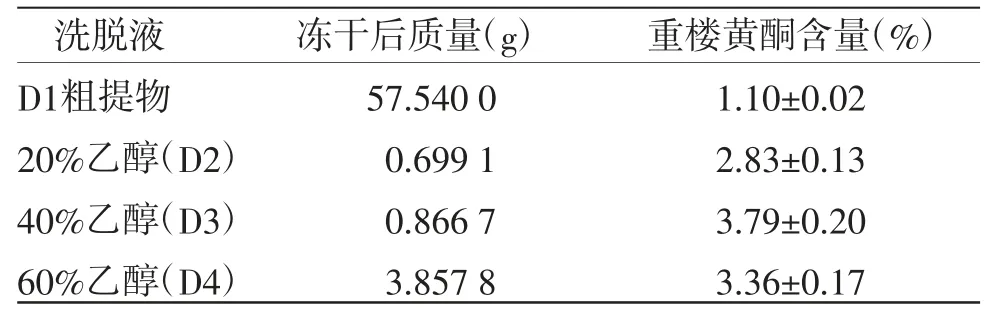
表6 不同组分重楼黄酮的含量信息表
3.7 重楼黄酮抗氧化功效验证结果分析
3.7.1 DPPH自由基清除能力检测结果 重楼黄酮D1~D4组分都有一定的DPPH自由基清除作用。在质量浓度为5 mg/mL时,DPPH自由基的清除率分别为(81.94±7.39)%、(32.49±6.08)%、(60.38±2.84)%、(55.49±0.91)%。由于重楼黄酮D2和D3与DPPH反应生成黄色物质,该物质在520 nm处有吸收,导致其自由基清除结果不明显。但结合到实验观察到的现象,可知DPPH自由基清除能力大小为:重楼黄酮D2>重楼黄酮D3>重楼黄酮D1>重楼黄酮D4。(见图9)

图9 重楼黄酮不同组分对DPPH 自由基清除能力比较
3.7.2 OH自由基清除能力检测结果 重楼黄酮D1~D4组分都具有一定的OH自由基清除作用。在质量浓度为6 mg/mL时,OH自由基的清除率分别为(39.11±1.67)%、(74.02±3.78)%、(57.53±3.08)%、(29.31±1.40)%。可知不同组分对OH自由基清除能力大小为:重楼黄酮D2>重楼黄酮D3>重楼黄酮D1>重楼黄酮D4。(见图10)

图10 重楼黄酮不同组分对OH 自由基清除能力比较
3.7.3 ABTS自由基的清除能力检测结果 重楼黄酮D1~D4组分都具有一定的ABST自由基清除作用。在质量浓度为6 mg/mL时,ABTS自由基的清除率分别为(57.95±3.69)%、(100.89±0.56)%、(106.32±0.71)%、(73.88±0.94)%。可知不同组分重楼黄酮组分对ABST自由基清除能力大小为:重楼黄酮D3>重楼黄酮D2>重楼黄酮D4>重楼黄酮D1。(见图11)

图11 重楼黄酮不同组分对ABTS 自由基清除能力比较
3.7.4 对Fe3+的还原能力检测结果 重楼黄酮D1~D4都具有一定的Fe3+的还原能力作用。在质量浓度为8 mg/mL时的吸光度分别为(0.30±0.04)、(0.40±0.01)、(0.35±0.01)、(0.24±0.00)。可知不同组分对Fe3+的还原能力大小为:重楼黄酮D2>重楼黄酮D3>重楼黄酮D1>重楼黄酮D4。(见图12)
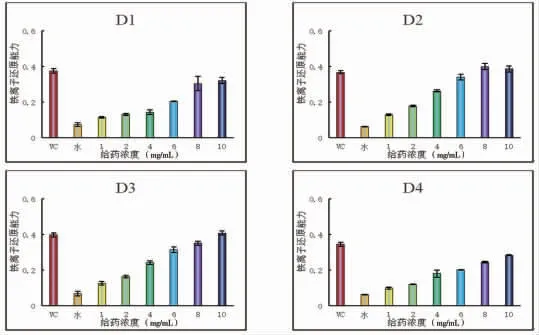
图12 重楼黄酮不同组分对Fe3+的还原能力比较
综上,功效验证结果表明不同提取物之间的抗氧化效果为:重楼黄酮D2(20%乙醇洗脱)>重楼黄酮D3(40%乙醇洗脱)>重楼黄酮D1粗提物>重楼黄酮D4(60%乙醇洗脱)。
4 结论
通过单因素和响应面设计试验,可得重楼黄酮的最优提取工艺为提取乙醇浓度65%,提取时间105 min,料液比1∶10。利用该条件可提取得到重楼黄酮粗提物D1。重楼黄酮精制工艺的探索,筛选了5种大孔吸附树脂,得到D101树脂更有利于重楼黄酮的提取。利用20%乙醇、40%乙醇及60%乙醇对重楼黄酮粗提物D1在大孔树脂D101上进行洗脱,最终获得不同组分精制物D2~D4。对D1~D4的抗氧化功效进行研究,包括对DPPH、OH、ABTS自由基清除能力及对Fe3+还原能力的试验,可以得到重楼黄酮D2组分(20%乙醇洗脱)。重楼黄酮组分D2组分,有非常好的抗氧化能力。其次为重楼黄酮D3(40%乙醇洗脱),活性均高于重楼黄酮粗提物D1。表明重楼黄酮中具体抗氧化活性的有效部分可能在20%和40%乙醇洗脱组分中。重楼的大孔吸附树脂20%、40%乙醇洗脱部分富集到的黄酮为抗氧化主要活性部位,这些结果为重楼黄酮作为功能原料或药物的开发提供参考。

