例讲奥赛考点
——碳正离子的产生及稳定性比较
唐生岳
(江苏省大丰高级中学)
化学反应的实质是旧键的断裂和新键的形成.有机化学反应中旧键的断裂主要有2种方式:一种是均裂形成自由基;另一种是异裂形成碳正离子(或是形成碳负离子).有机反应的机理主要包括自由基反应机理、亲电反应机理、亲核反应机理及环状过渡态的周环反应机理.其中,考查最多的是亲电反应(加成或取代)机理和亲核反应(加成或取代)机理,而亲电反应机理是碳正离子或是具有缺电子特征结构的物质与具有富电子特征结构的物质间的反应,亲核反应是负离子或富电子结构物质进攻正电性或是缺电子的物质间的反应,而其中最为重要的是碳正离子的形成和碳正离子的稳定性对有机反应机理的影响.因此,对碳正离子的稳定性等的考查成了化学奥赛、高考强基考试的必考考点.本文以化学奥赛真题为例讲解碳正离子的稳定性及碳正离子对反应机理的影响.
1 碳正离子的产生及其稳定性比较
1.1 碳正离子的产生
碳原子上连接有1个电负性较大的原子或者基团,如卤素原子(—X)、羟基(—OH)等,当这些电负性较大的原子或者基团离去时,会将碳原子的1个电子带走,从而形成碳正离子;也可以是碳碳双键中的π键断裂,碳与氢离子结合而形成碳正离子,如乙烯分子与HBr反应时π 键断裂,1 个碳原子先与H+结合,形成了乙基正离子.
比如(CH3)3C—I在硝酸银的存在下离去碘离子就可以形成(CH3)3C+,再如(CH3)3C—OH 在酸性条件下,羟基质子化后去水,也可以形成(CH3)3C+.
1.2 碳正离子的结构特征
碳正离子中最简单的是CH3+,其结构如图1 所示.由此可以看出碳正离子是1个缺电子结构(碳原子的最外层只有6个电子).从杂化角度来看碳正离子的碳原子是以sp2杂化形式存在的,其中3个杂化轨道分别与3个氢原子形成了3个σ键,还有1个垂直于sp2杂化轨道(或说垂直于3个氢原子形成的平面)的空的p轨道.由于H 原子没有孤对电子,所以甲基正离子中的正电荷集中而得不到分散,因此CH3+很不稳定.如果甲基正离子的氢原子被其他原子或原子团取代后,形成各种不同的碳正离子,可简单表示为如图2所示结构,其中x、y、z处于同一平面,碳原子的空轨道垂直于此平面,这些原子或原子团会对碳正离子的稳定性产生影响.

图1
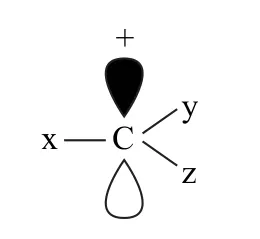
图2
1.3 碳正离子的稳定性
1)烷基与空的p轨道的超共轭效应.当x、y、z被烷基取代后,可以形成sp3杂化轨道,与碳原子的空的p轨道形成σ-p超共轭效应(之所以称为超共轭,是因为键所占轨道与空的p轨道不能完全平行并共面,所以形成的轨道重叠比较小,即超轭效应的强度低于共轭效应),使得碳正离子的电荷得到分散而更趋向于稳定.由此也可以得出,三级碳正离子(也称叔碳正离子)的稳定性强于二级碳正离子(也称仲碳正离子),强于一级碳正离子(也称伯碳正离子),强于甲基正离子,记为3°>2°>1°>甲基正离子.
2)碳碳双键与空的p轨道间的共轭效应.当x、y或z中有R—CH=CH—时,碳碳双键中的π键与空的p轨道相互平行,轨道间重叠相对较充分,从而能提高碳正离子的稳定性.我们可以通过书写共振式的方法对此进行验证.简单举例:π-p共轭对碳正离子的稳定性影响远比烷基的超共轭效应对碳正离子稳定性的影响大.
3)当x、y或z中有杂原子,如O、N 等时,由于其原子含有孤电子对,与碳正离子的空的p轨道可以形成p-p共轭,碳正离子的缺电子结构转化为符合八隅体的氧正离子或氮正离子等,从而更有效地分散碳正离子的正电荷,也就更好地稳定了碳正离子,我们对此也可用共振式表示,如图3所示.
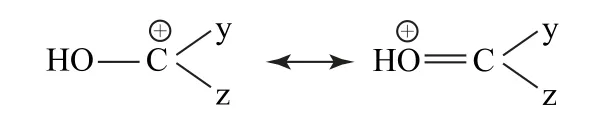
图3
这样的p-p共轭对稳定碳正离子的作用强于π-p共轭对稳定碳正离子所作的贡献,因此也会使碳正离子更为稳定.
另外,当碳正离子与杂原子间连接有π键时,可以形成更大的共轭体系,可以使碳正离子更加稳定.比如,苄基正离子与对甲氧基苄基正离子或者是邻甲氧基苄基正离子相比较,后者会比前者更为稳定,因为甲氧基中氧原子提供1对电子形成推电子共轭效应,更好分散碳正离子的正电荷;如果是间甲氧基苄基正离子时,甲氧基的氧原子就不能很好地与碳正离子形成推电子共轭效应,只能是因氧原子具有较大的电负性,对碳正离子起到的是吸电子诱导效应,这样就不利于稳定碳正离子,其稳定性将会弱于苄基正离子.
4)碳正离子的重排.碳正离子形成后,只要是结构允许,碳正离子就可以发生重排,使其转化成更为稳定的碳正离子.发生迁移的原子或原子团,可以是氢原子、甲基,甚至是苯基等.例如,
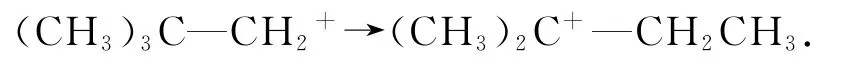
2 中学化学奥赛真题解析
例1(第32届中学生化学奥赛初赛第10题,有删减)以下正离子可以经过4π电子体系的电环化反应形成环戊烯正离子,该离子可以失去质子形成共轭烯烃(如图4).
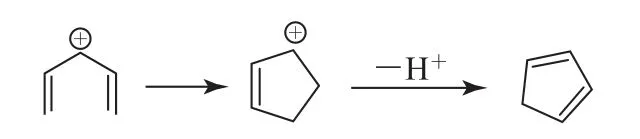
图4
根据以上信息,画出下列反应主要产物的结构简式(产物指经处理后得到的化合物).
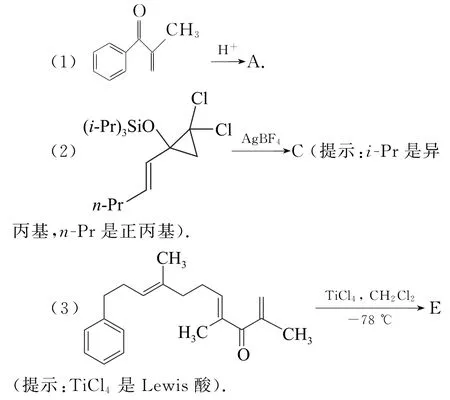
解析本题中的已知条件告诉我们“正离子可以经过4π 电子体系的电环化反应形成环戊烯正离子”,因此在解题时我们首先可以考虑的是能不能在所给条件下形成相应的2个特征结构:①形成(碳)正离子;②4π 电子体系的电环化反应形成环戊烯正离子.所以我们可以围绕特征结构的形成过程来分析和解决问题.
(1)该反应物是在酸性条件下反应的,即可以进行质子化得到相应的碳正离子,这里形成的碳正离子有2种可能:①氧原子质子化,再得到其共振结构;②碳碳双键的质子化形成碳正离子.但在2个变化中只有①的变化可以形成题给条件下的4π电子体系,其反应机理如图5所示.
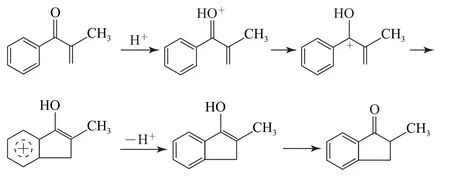
图5
(2)从反应条件可以看出,在银离子存在下,可以夺去1个氯离子,形成环丙基的碳正离子,由于三元环的角张力较大,因此引起了开环而形成新的碳正离子,这里我们要注意其开环的动力来自与碳相连的氧原子,可以利用氧原子的孤电子对与碳正离子的空轨道形成p-p共轭而使碳正离子的电荷分散,从而形成更为稳定的碳正离子.并且,此碳正离子正好符合题给条件提示的两大特征,从而即可得到相应的产物,其反应机理如图6所示.
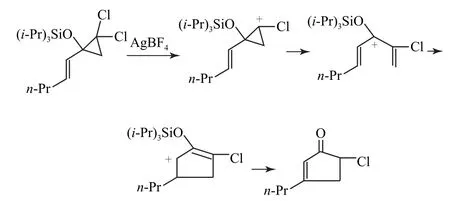
图6
(3)第(3)小题的第一步可以参考第(1)小题的经验,先是氧原子质子化,再写出其共振式就可以得到我们需要的目标碳正离子,即完成第一步反应,形成环戊烯正离子,而此时形成的碳正离子,与其左侧的碳碳双键发生亲电加成反应,形成比较稳定的六元环状碳正离子.该碳正离子与苯环又可以发生亲电取代(傅-克烷基化反应)的过程,形成稳定的六元环状化合物.其形成的机理如图7所示.
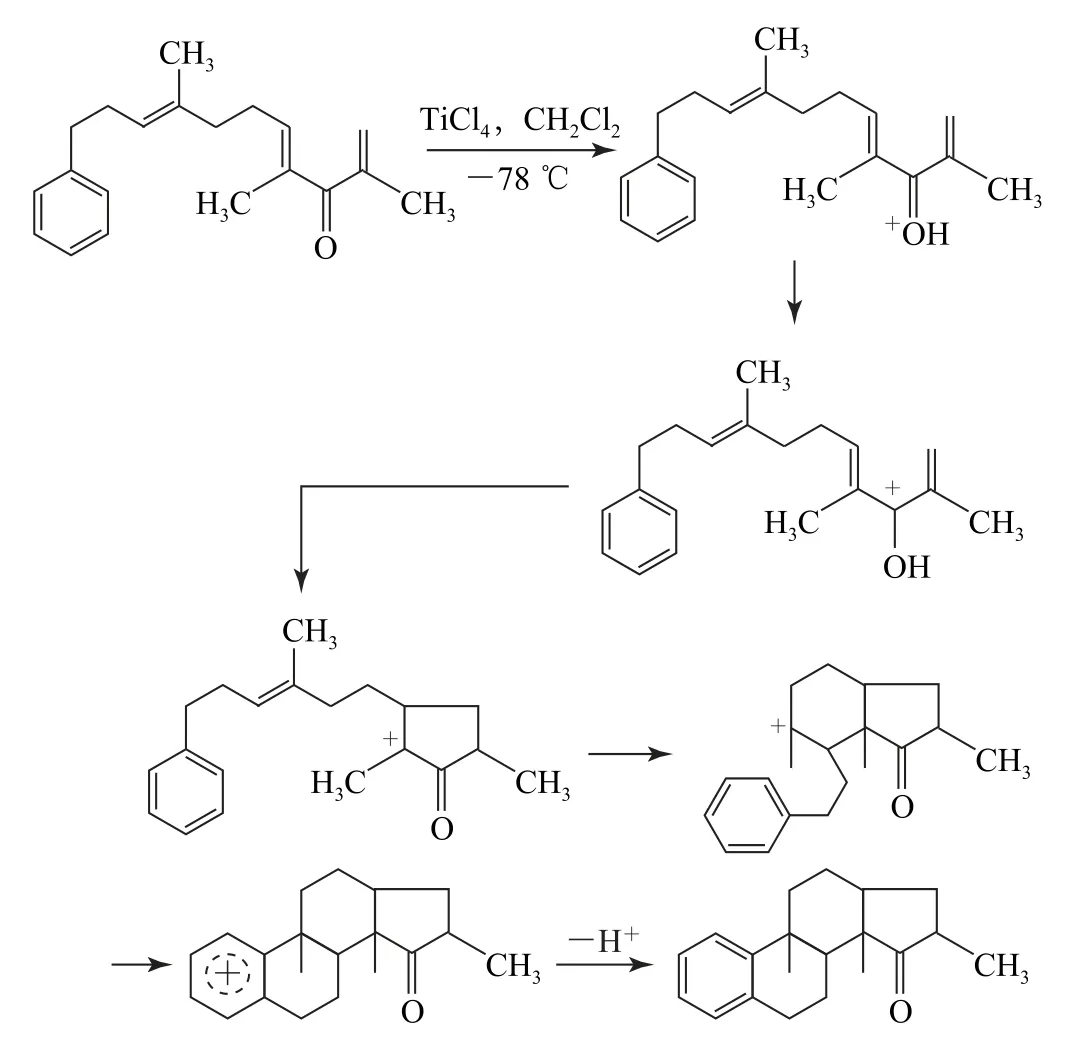
图7
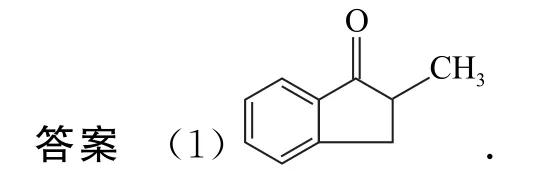

例2[第35 届中学生化学奥赛初赛(江苏赛区)第8题] 在酸性条件下,请按失水从易到难给以下化合物排序_________.

解析本题是醇在酸性条件下的失水过程.首先是羟基的质子化H2O+—R,然后脱水形成碳正离子,因此本题表面看是醇在酸性条件下的脱水反应,实质是形成碳正离子的过程.A、D 形成的碳正离子分别为,从这2个碳正离子可以看出,它们符合休克尔的“4n+2规则”,即可知两者都具有芳香性,但A 形成三元环状碳正离子的角张力比较大,稳定性弱于D 形成的七元环状碳正离子;而B形成的碳正离子,具有4n特征的环形结构,有反芳香性,不稳定;而C是苯酚,羟基与苯环直接相连,其氧原子的1对孤对电子与苯环间可以形成p-π共轭,即其碳氧键具有部分双键的性质,很难质子化脱水形成碳正离子,因此在4种物质中苯酚是最难质子化脱水形成苯正离子的物质.故在酸性条件下脱水由易到难的顺序为D>A>B>C.
答案D>A>B>C.
可以看出,以上2道试题表面上都不是直接比较碳正离子的稳定性,但其考查的实质就是在比较碳正离子的稳定性.比如在某过程中有多种碳正离子可以形成,但由于碳正离子稳定性的差异,从而就得到了其产物的唯一性.我们在学习中首先要了解碳正离子形成的方式或是过程,然后对可能形成的碳正离子进行比较,从而分析出一个更为稳定的碳正离子,这样就可以更好地解决问题.在掌握了碳正离子的形成、特征、稳定性的影响因素以后,再通过适当的变式训练,可以提升我们对碳正离子的理解,同时也可以提升我们对碳正离子在反应机理中的应用的理解.
(完)

