阿帕替尼联合紫杉醇二线治疗Her-2阴性晚期胃癌的效果分析
刘慈 段亚男 候月红
100036 北京水利医院1,北京
050000 河北石家庄市人民医院2,河北石家庄
胃癌是一种起源于胃黏膜上皮的恶性肿瘤,发病率仅次于肺癌,在我国居第二位,且有较高的死亡率[1]。胃癌好发于>50 周岁的人群,男性患病率明显高于女性,患病人群越来越年轻化,严重威胁我国人民身体健康和生命安全。胃癌的早期症状不典型,与胃炎等良性疾病无明显差异,胃镜普查率低,导致胃癌的早期诊断率<10%,发现时多是中晚期,5年存活率仅为27.4%[2]。
化疗是晚期胃癌的主要治疗方式。一线治疗耐药后,不可避免地进入二线治疗。紫杉醇为标准的二线化疗药物,在一定程度上能延长患者的生存期,但是单一治疗易耐药,远期疗效并不理想。二线抗血管治疗联合化疗可进一步延长患者生存期,阿帕替尼作为小分子血管内皮生长因子受体-酪氨酸激酶抑制剂,给胃癌患者带来新的希望[3]。本研究对阿帕替尼联合紫杉醇二线治疗Her-2阴性晚期胃癌的临床效果展开探讨,现报告如下。
资料与方法
选取2019年3月-2021年7月在石家庄市人民医院接受治疗的Her-2 阴性晚期胃癌患者78 例作为研究对象,按照随机数字表法分为对照组和研究组,每组39 例。对照组男26 例,女13 例;年龄38~75 岁,平均(63.18±3.26)岁。研究组男24 例,女15 例;年龄40~78 岁,平均(65.27±3.19)岁。两组患者基本资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批。
纳入标准:①经病理学诊断确诊,均符合Her-2阴性Ⅳ期患者;②一线氟尿嘧啶类联合铂类化疗后,出现病情进展者;③患者年龄>18 岁;④美国东部肿瘤协作组(ECOG)体能状态评分0~1 分者;⑤心、肝、肾功能正常;⑥生存期均>3 个月;⑦患者自愿参与本研究,家属知情并签署同意书。
排除标准:①合并其他恶性肿瘤者;②合并呕血、便血者;③预计生存期<3 个月者;④中途退出本研究者。
方法:对照组给予紫杉醇(生产厂家:亚宝药业集团股份有限公司;批准文号:国药准字H20084099)治疗,将135~175 mg/m2该药物溶于生理盐水或者500~1 000 mL 5%葡萄糖液中,静脉滴注,3 周为1个化疗周期,在化疗期前,常规采用地塞米松、苯海拉明预防过敏,每2个化疗周期后判定疗效。
研究组给予阿帕替尼联合紫杉醇治疗,紫杉醇的用法同对照组,阿帕替尼(生产厂家:江苏恒瑞医药股份有限公司;批准文号:国药准字H20140105),1次/d,500 mg/次,早餐后0.5 h 服用,3 周为1 个化疗周期,在化疗期前,常规采用地塞米松、苯海拉明预防过敏,每2个化疗周期后判定疗效。
观察指标:观察两组患者的客观缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)、生活质量和不良反应。①DCR 参照实体肿瘤的疗效评价标准1.1版(RESIST1.1),分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。a.CR:肿瘤基本消失,且维持时间≥1 个月;b.PR:肿瘤目标病灶直径总和缩小≥30%,并且维持时间≥1 个月;c.SD:肿瘤缩小<30%或增大<20%,且维持时间≥1个月;d.PD:肿瘤靶病灶直径之和增大≥20%或者出现新病灶。客观缓解率(ORR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。②PFS 表示从接受治疗开始到任何方面的病情进展,以时间作为计量单位。③生活质量采用ECOG 评分作为评价标准,分别于治疗前后进行评价,假如治疗后的ECOG 评分比治疗前提高≥1分,则表示改善;比治疗前减少<1分,则表示下降;治疗后ECOG 评分变化在提高1 分和减少1分之间,则表示稳定。④不良反应:参照常见不良事件评价标准进行分度,一般分为0~Ⅳ度。
统计学方法:数据应用SPSS 20.0 软件分析;计数资料以[n(%)]表示,采用χ2检验,P<0.05 为差异有统计学意义。
结 果
两组患者ORR、DCR 比较:两组患者的ORR、DCR比较,差异均无统计学意义(P>0.05)。见表1。
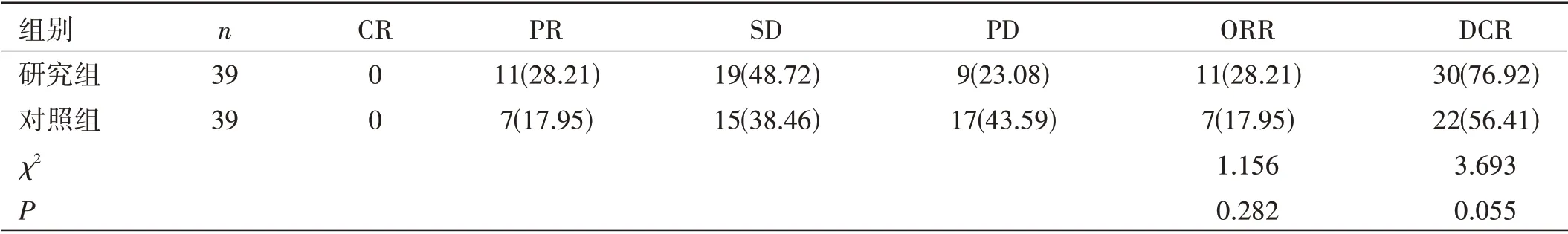
表1 两组患者ORR、DCR比较[n(%)]
两组患者中位PFS 比较:研究组PFS(4.43±0.47)个月,对照组(3.36±0.35)个月,差异有统计学意义(t=11.403,P<0.05)。
两组患者生活质量评分变化比较:两组患者的生活质量评分变化比较,差异无统计学意义(P>0.05)。见表2。
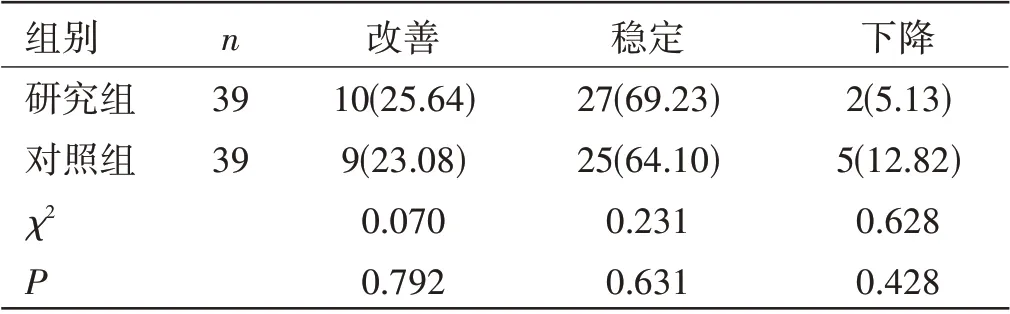
表2 两组患者生活质量评分变化比较[n(%)]
两组患者不良反应发生情况比较:两组患者的不良反应以白细胞减少、血小板减少、肝功能异常、高血压、乏力、恶心呕吐等较为常见,均集中于Ⅰ~Ⅱ度,Ⅲ~Ⅳ度非常少见,研究组高血压发生率与对照组比较,差异有统计学意义(χ2=7.341,P<0.05),这些不良反应经过对症治疗后,均可改善或者消失,未出现因不良反应而停止治疗或死亡的病例。见表3。
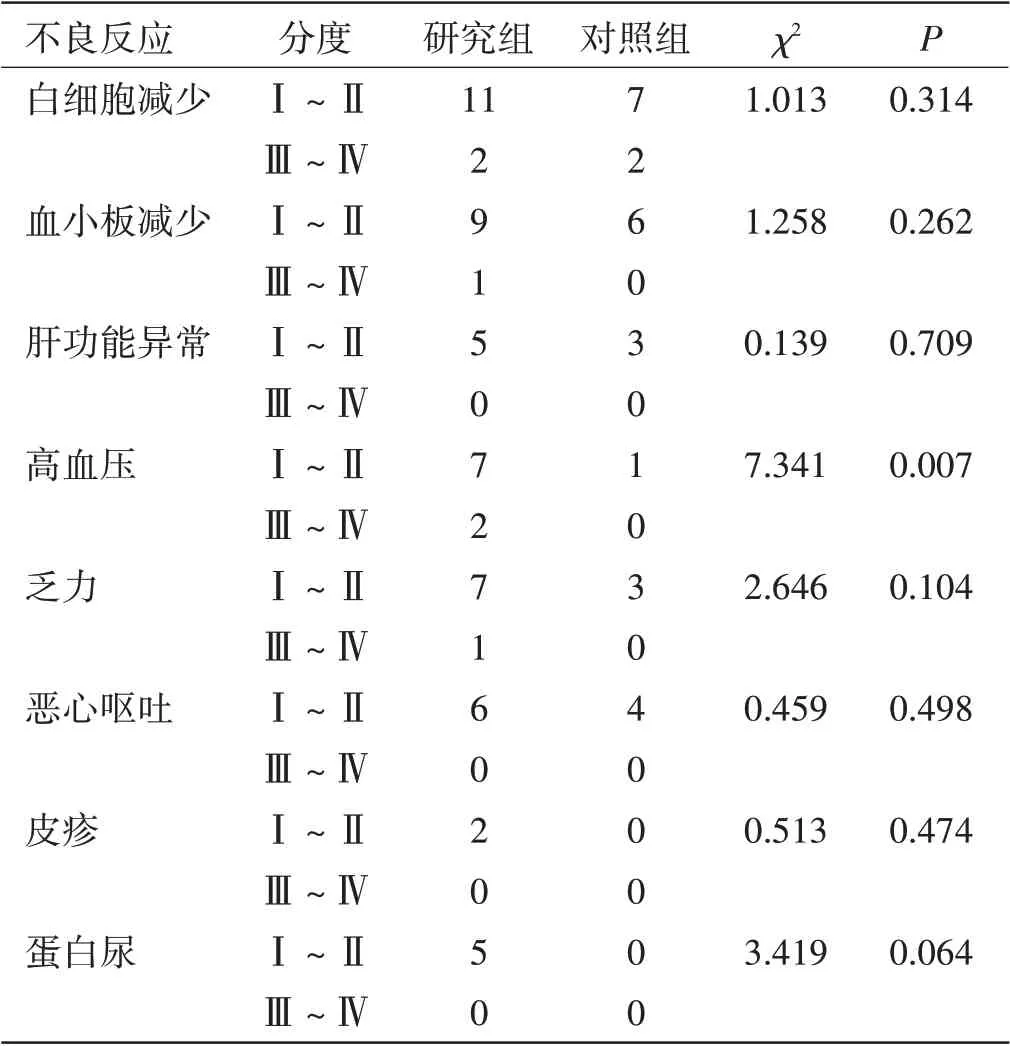
表3 两组患者不良反应发生情况比较
讨 论
临床上,化疗是治疗胃癌晚期的一种重要方法,其中一线治疗进展后,二线紫杉醇是一种标准的化疗方式。但二线化疗在3 个月后患者将再次面临进展。因此,寻求一种提高化疗效果、延长患者无进展生存期的治疗方式,成为临床工作者研究的重点和难点。随着检测技术的进步以及肿瘤生物学的深入研究,抗肿瘤血管生成靶向药物治疗晚期胃癌中有新的突破[4-5]。基于全球性Ⅲ期跨中心随机双盲试验(REGARD)和全球性的Ⅲ期、多中心、随机性双盲试验(RAINBOW)研究发现,血管内皮生长因子受体-2(VEGFR-2)联合紫杉醇治疗晚期胃癌的效果明显优于单一紫杉醇治疗,其于2015年进入美国胃癌NCCN 晚期二线治疗[6]。这就充分说明抗VEGFR-2治疗晚期胃癌具有有效性及可行性。
血管是为肿瘤生长提供营养的重要途径,也是肿瘤转移的通道,通过阻断血管就能达到杀死肿瘤的目的。抗血管生成靶向药物是通过与VEGFR 结合阻断血管生成,来抑制肿瘤细胞的增殖和转移[7]。阿帕替尼是常见的抗血管生成药物,在晚期胃癌的治疗中发挥着重要的作用。该药物也是我国自主研发的一种小分子VEGFR-2 的酪氨酸激酶抑制剂,主要机制是竞争性地与VEGFR-2受体胞内段酪氨酸激酶ATP结合,抑制其活性,从而阻断下游信号传导,抑制肿瘤血管生成,达到抗肿瘤的目的[8]。
在本文研究中,通过阿帕替尼联合紫杉醇二线治疗Her-2阴性晚期胃癌患者,同时与单一的紫杉醇治疗效果相比,研究组患者ORR、DCR 均高于对照组,但差异无统计学意义(P>0.05),同时两组的生活质量稳定率相比较,差异无统计学意义(P>0.05),提示联合治疗组并未降低生活质量。但研究组中位PFS长于对照组,差异有统计学意义(P<0.05),在不良反应方面,两组只有在高血压发生率方面有差异(P<0.05);在其他不良反应方面,差异并不明显,说明两药联合治疗可延长患者的无进展生存期,且患者不良反应耐受性好,安全性高。
综上所述,采用阿帕替尼联合紫杉醇二线治疗Her-2 阴性晚期胃癌,能延长患者无进展生存期,且不良反应大多可耐受,可为患者的下一步治疗赢得时间。

