五味子酯甲通过TLR4/NF-κB 通路对肝纤维化的保护作用研究
王春梅,车金营,崔 凯,徐 博,庄文越,李 贺,王海莉
(1.北华大学药学院,吉林 吉林 132013;2.北华大学附属医院,吉林 吉林 132011;3.吉林医药学院基础医学院,吉林 吉林 132013;4.北华大学医学技术学院,吉林 吉林 132013)
肝纤维化是慢性肝病的主要病理学特征,是肝脏对损伤及炎症的一种持续修复反应,晚期肝纤维化可发展为肝硬化、肝癌甚至死亡.2015年,ESLAM M等[1]研究显示:组织纤维化疾病与约45%人群的死亡有关,其中肝纤维化是主要原因之一.有研究[2]表明:当正常肝细胞受损时,邻近的肝细胞、Kupffer细胞等通过旁分泌作用分泌多种炎性介质及细胞因子,激活肝星状细胞(hepatic stellate cells,HSCs),被激活的HSCs又受到自分泌及旁分泌的双重调节进一步活化.然而,HSCs发生细胞增殖、活化并分化为肌成纤维细胞(myofibroblasts,MFB)是肝纤维化发生、发展的重要环节[3].因此,有效抑制HSCs活化及肝脏炎症反应可能减缓甚至逆转肝纤维化的发展.
五味子酯甲(Schisantherin A,SCA)是木兰科植物五味子(Schisandrachinensis(Turcz.) baill)木脂素单体化合物之一,具有显著的护肝、抗炎、抗细胞凋亡及保护心肌细胞等多种药理活性[4].有研究[5-7]表明:SCA抗炎作用显著,对脂多糖(Lipopolysaccharide,LPS)、IL-1β及缺血再灌注损伤等诱导的体内、体外炎症反应中相关炎症因子均具有显著抑制作用.课题组的前期研究[8]发现:SCA小剂量应用对转化生长因子-β1(transfor ming growth factor-β1,TGF-β1)诱导的人肝星状细胞(LX2)增殖、活化具有良好抑制作用,推测其可能具有抗肝纤维化作用.因此,本研究拟采用硫代乙酰胺(thioacetamide,TAA)渐进性给药建立小鼠肝纤维化模型,明确SCA的抗肝纤维化作用,并通过TGF-β1诱导LX2细胞增殖、活化模型,进一步探讨SCA是否通过TLR4/NF-κB通路调控炎症反应而发挥抗肝纤维化作用,为五味子酯甲的开发利用提供理论依据.
1 材料与方法
1.1 实验动物、主要试剂和仪器
选取体质量为20~22 g清洁级雄性ICR小鼠(长春亿斯实验动物技术有限公司,合格证编号:SCXK(吉)2016-0003),分笼饲养,室内温度保持在18~22 ℃,相对湿度40%~60%,自由饮食水.适应性喂养5 d后进行实验;人肝星状细胞LX2细胞系(吉林大学白求恩医学院药理学实验室赠予).
五味子酯甲(成都普菲德生物技术有限公司),纯度>98%;胎牛血清(GEminI公司,美国);0.25%胰蛋白酶(Gibco公司,美国);高糖DMEM培养液(HyClone公司,美国);TGF-β1(Pepro Tech公司,美国);TAA(Sigma公司,美国);谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate a minotransferase,AST)、羟脯氨酸(hydroxyproline,Hyp)检测试剂盒(南京建成生物工程研究所);肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白介素-6 (interleukin-6,IL-6)、白介素-1 β(interleukin-1 β,IL-1 β)ELISA 检测试剂盒 (上海朗顿生物技术有限公司);α-平滑肌动蛋白(α-smooth muscle actin,α-SMA)、Toll样受体4(toll-like receptor 4,TLR4)、核因子-κB (nuclear factor-κB,NF-κB)等多克隆抗体(武汉ABclonal有限公司);细胞超净工作台(苏州净化设备有限公司);CO2恒温细胞培养箱(艾本德公司,德国);Infinite M200酶标仪(Tecan集团公司,瑞士);Nikon Eclipse Ti-SR倒置荧光显微镜(Nikon公司,日本);超高速冷冻离心机(Thermo公司,美国).
1.2 肝纤维化小鼠模型的建立、分组及给药
将40只雄性ICR小鼠随机分为空白对照(CON)组、空白对照+SCA(CON+SCA)组、肝纤维化模型(MOD)组、肝纤维化模型+SCA(MOD+SCA)组,每组10只.MOD和MOD+SCA组小鼠采用TAA渐进性腹腔注射方法诱导肝纤维化模型[9],3次/周,连续注射9周.第1周注射剂量为50 mg/kg,第2~3周为100 mg/kg,第4~9周为150 mg/kg.从第5周开始SCA给药组小鼠灌胃给予4 mg/kg的SCA,CON组及MOD组给予等体积生理盐水灌胃.
1.3 样本采集
给药结束后,各组小鼠采用乙醚麻醉,眼球取血,4 ℃离心分离血清(3 500 r/min,10 min),分装于EP管中,用于生化指标检测.采血后迅速取出小鼠肝脏,一部分置于10%中性福尔马林溶液中,用于组织病理学检测,另一部分制备肝组织匀浆,用于Hyp和炎症因子的检测.
1.4 各组小鼠血清中转氨酶活性检测
采用酶学方法检测小鼠血清中ALT和AST活性,具体操作严格按照试剂盒说明书进行.
1.5 各组小鼠肝组织中Hyp、炎症因子含量检测
取100 mg肝组织制成10%肝匀浆,Hyp含量采用酶学方法检测,TNF-ɑ、IL-6和IL-1β含量采用ELISA方法检测,具体操作严格按照试剂盒说明书进行.
1.6 各组小鼠组织病理学观察
取经10%中性福尔马林溶液固定24 h后的肝组织,经石蜡包埋,切5 μm厚切片.二甲苯脱蜡、梯度乙醇复水后,一部分切片经苏木精-伊红(H&E)染色,另一部分经Masson染色,梯度乙醇脱水,二甲苯置换乙醇,最后滴加中性树胶封片.光学显微镜下观察、拍照,用于组织病理学分析.
1.7 细胞培养
将人肝星形细胞系LX2接种于含10%胎牛血清的高糖DMEM培养基中,培养基中添加100 U/mL的青霉素和链霉素,置于37 ℃、5% CO2的恒温培养箱中进行培养.当细胞生长至80%融合时,用0.25%胰蛋白酶消化,2~3 d传代一次.
1.8 SCA药物筛选及TGF-β1诱导LX2细胞增殖模型
SCA浓度筛选及TGF-β1诱导LX2细胞增殖模型方法参考文献[8].取生长状态良好的LX2细胞,调整细胞密度为6×104个/mL接种至96孔板中,将细胞分别与0、0.625、1.25、2.5、5.0、10.0、20.0、40.0、80.0和160.0 μmol/L的SCA共培养24 h,采用MTT法评价SCA对细胞存活率的影响.结果提示:SCA在浓度小于5 μmol/L时,对LX2细胞存活率无明显影响.选用5 ng/mL TGF-β1诱导LX2细胞增殖模型,将生长状态良好的细胞随机设为空白对照组、TGF-β1组以及0.625、1.25、2.5和5.0 μmol/L SCA给药组,SCA给药组采用TGF-β1与SCA共孵育,培养24 h.SCA及TGF-β1均溶解于含有2% FBS的DMEM培养基中.
1.9 Western blotting分析
收集1.8中培养的细胞,加入RIPA裂解液提取总蛋白.将蛋白样品在10% SDS-聚丙烯酰胺凝胶上分离目标蛋白,并转移至PVDF膜上;随后用5%脱脂牛奶室温封闭1 h;洗膜后孵育一抗,分别加入α-SMA、TLR4、Myd88、NF-κB抗体(按1∶1 000比例稀释),4 ℃ 反应过夜;次日用TBST洗膜,室温孵育二抗1 h;最后用ECL化学发光法显影,并用Image J软件进行半定量分析.
1.10 统计学分析

2 结 果
2.1 各组小鼠血清中转氨酶活性及肝组织中Hyp含量
与CON组和CON+SCA组比较,MOD组小鼠血清中ALT、AST活性明显升高(P<0.01),肝组织中肝纤维化标志物Hyp含量明显增加(P<0.01),提示渐进性腹腔注射TAA可以导致小鼠肝细胞损伤及纤维化;与MOD组比较,MOD+SCA组小鼠血清中ALT、AST活性及肝组织中Hyp含量均显著下降(P<0.01),提示SCA可以减轻TAA诱导的肝组织损伤及纤维化反应.SCA对正常组小鼠血清转氨酶及肝组织中Hyp无明显影响.见图1.

##.与CON组和CON+SCA组比较P<0.01;**.与MOD组比较P<0.01.图1各组小鼠血清中转氨酶活性及肝组织中Hyp含量Fig.1Serum transaminase activity and Hyp content in liver of mice in each
2.2 各组小鼠肝组织中炎症因子含量
与CON组和CON+SCA组比较,MOD组小鼠肝组织中炎症因子TNF-α、IL-6及IL-1β含量显著增加(P<0.01),提示渐进性腹腔注射TAA可以导致小鼠肝组织炎症反应;与MOD组比较,MOD+SCA组小鼠肝组织中TNF-α、IL-6及IL-1β均明显下降(P<0.01),说明SCA可以缓解TAA引起的机体炎症反应.SCA对正常组小鼠肝组织中炎症因子含量无明显影响.

##.与CON组和CON+SCA组比较P<0.01;**.与MOD组比较P<0.01.图2各组小鼠肝组织中炎症因子含量Fig.2Inflammatory factor contents in liver of mice in each
2.3 各组小鼠肝组织病理学变化
H&E染色结果显示:CON组小鼠肝小叶结构清晰,肝索以中央静脉为中心向四周整齐排列,核质均匀分布,形态正常.与CON组比较,MOD组小鼠肝组织结构紊乱,肝细胞排列不规则,肝小叶周围出现大量成纤维细胞及炎性细胞浸润,汇管区胶原纤维沉积,小叶周围的胆管增生及胆汁淤积,细胞团内有疏松变性的肝细胞,肝细胞出现水肿及点状坏死,部分细胞核碎裂或消失,说明TAA渐进性给药可诱导肝纤维化小鼠模型;与MOD组比较,MOD+SCA组小鼠肝组织的上述病理变化显著改善,炎性浸润几乎消失,并出现巨噬细胞吞噬,提示SCA能够改善TAA诱导的小鼠肝损伤,减轻炎症反应.见图3.
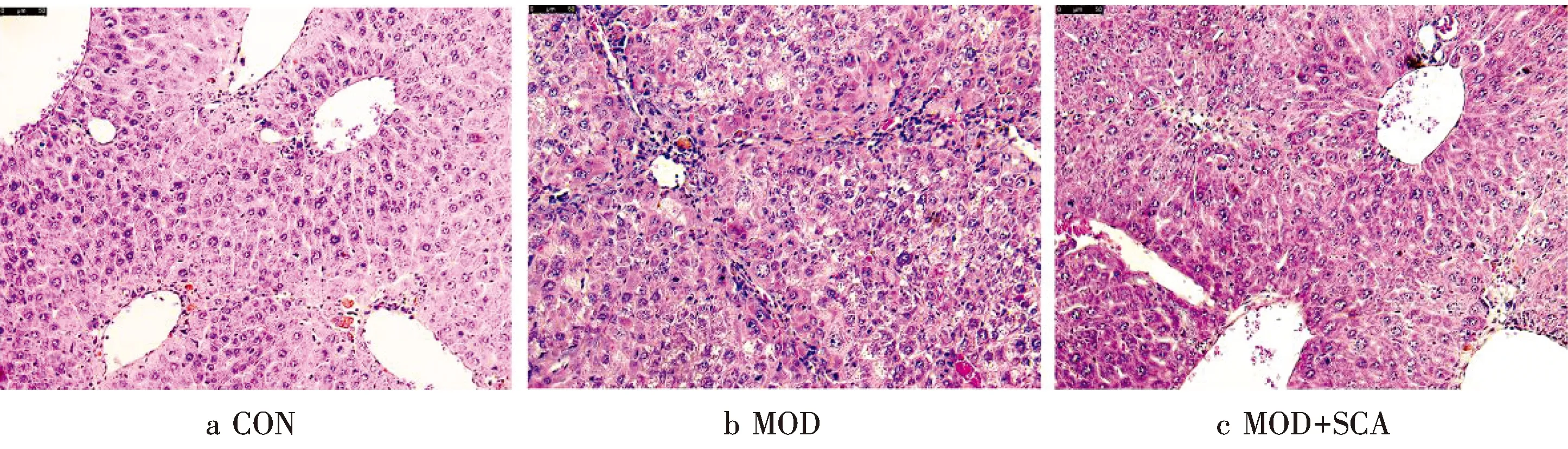
图3各组小鼠肝组织病理形态表现(H&E,×200)Fig.3Pathological morphology of mouse liver in each group(H&E,×200)
2.4 各组小鼠肝组织纤维化程度
应用Masson染色鉴定胶原纤维评估肝组织纤维化程度,结果显示:CON组小鼠肝小叶结构完整,仅在汇管区与中央静脉区血管壁附着些许蓝色,无胶原增生.与CON组比较,MOD组小鼠肝组织中观察到围绕中央静脉周围高密度的胶原纤维染色和纤维化间隔,胶原纤维增生明显,在汇管区与汇管区及中央静脉与汇管区之间相互连接,提示TAA可诱导肝组织发生纤维化;与MOD组比较,MOD+SCA组小鼠肝组织纤维化程度减轻,胶原纤维的范围和面积明显减少,提示SCA能够减轻TAA诱导的肝纤维化.见图4.

图4各组小鼠肝组织纤维化程度(Masson,×200)Fig.4Fibrosis degree of mouse liver tissue in each group(Masson,×200)

1.CON group;2.TGF-β1 group;3.SCA(0.625 μmol/L)group;4.SCA(1.25 μmol/L)group;5.SCA(2.5 μmol/L)group;6.SCA (5.0 μmol/L) group. 图5Western blotting 法检测各组LX2细胞中α-SMA、TLR4、Myd88、NF-κB蛋白表达电泳 Fig.5Electrophoregram of expressions of α-SMA,TLR4,Myd88 and NF-κB proteins in LX2 cells in various groups detected by Western blotting method
2.5 LX2细胞增殖模型中α-SMA、TLR4、Myd88、NF-κB的蛋白表达水平
为进一步探讨SCA是否抑制肝星状细胞的活化,我们检测了LX2细胞增殖模型中α-SMA的蛋白表达.结果表明:与CON组比较,给予TGF-β1(5 ng/mL) 刺激后,LX2细胞中α-SMA蛋白表达水平显著升高(P<0.01),而SCA(2.5 μmol/L和5.0 μmol/L)可明显抑制α-SMA的表达(P<0.05).此外,与CON组比较,TGF-β1刺激显著增加了LX2细胞中TLR4、Myd88、NF-κB p65的蛋白表达(P<0.05).与TGF-β1组比较,SCA显著抑制了TGF-β1诱导的TLR4、Myd88及NF-κB p65蛋白表达(P<0.05),提示SCA可能通过调节TLR4/Myd88/NF-κB信号通路而发挥抗肝纤维化作用.见图5.
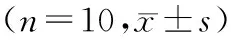
表1 各组LX2细胞中α-SMA、TLR4、Myd88、NF-κB蛋白表达水平Tab.1 Expression levels of α-SMA,TLR4,Myd88 and NF-κB proteins in LX2 cells in each group
3 讨 论
肝纤维化是肝脏慢性炎症向肝硬化发展的过渡性阶段,病理演变过程被认为是可逆的,因此,肝纤维化治疗具有理论的可行性和重要的临床意义.近几年来,从药用植物中提取高效低毒的活性成分用于缓解肝纤维化日益受到关注.五味子为吉林省道地药材,越来越多的研究[9-10]表明五味子具有抗纤维化作用.含有五味子成分的养肺活血汤可显著抑制大鼠肺纤维化,五味子复方乙醇提取物能够抑制链脲佐菌素诱导的糖尿病肾病小鼠肾小球、肾小管间质纤维化[8-9],五味子及华中五味子分离出的新型木脂素具有明显的抗肝纤维化作用[10].然而,目前五味子中具体哪种成分发挥抗组织纤维化作用尚不清楚.SCA是五味子木脂素中活性较强的单体化合物之一,课题组前期研究[8]发现,小剂量SCA即可抑制TGF-β1诱导的LX2增殖和活化,提示SCA可能具有抗肝纤维化作用.因此,在本研究中我们进一步采用TAA渐进性给药诱导小鼠肝纤维化模型,以明确SCA的抗肝纤维化作用.TAA诱导的肝纤维化模型在形态和功能上与人类肝纤维化高度相似,且会造成肝组织氧化应激、炎症反应及HSCs的激活[11-13].本研究结果显示:连续注射9周TAA,小鼠肝脏出现了典型的纤维化改变,血清转氨酶升高,肝组织中Hyp含量增加,应用SCA治疗后,能够明显缓解肝纤维化小鼠的这些症状及病理改变,提示SCA具有一定的抗肝纤维化作用.
当肝脏受到各种致病因素刺激后,静息状态下的HSCs迅速增殖、活化转化为MFB表型,高度表达的α-SMA引起ECM过度沉积,导致肝纤维化[14].其中,炎症是肝纤维化进展的关键诱因[15].肝损伤诱导肝细胞、Kupffer细胞、炎症细胞和HSCs之间相互刺激,使HSCs持续保持活化表型,加速炎症细胞向受损肝脏的募集,伴随大量的炎性介质分泌,如TNF-α、IL及TGF-β1等,参与或介导炎症反应,进一步促进纤维化进程[16].有研究[16-17]报道,SCA的抗炎活性作用显著.本研究结果也表明:SCA能够降低肝纤维化小鼠肝组织中TNF-α、IL-6及IL-1β的含量,减少肝组织中的炎性细胞浸润,提示SCA可能通过抑制HSCs活化及炎症反应而发挥抗肝纤维化作用.
TLR4/NF-κB信号通路与炎症反应及纤维化形成关系紧密,在肝纤维化过程中发挥重要作用.有研究[18]表明:活化的HSCs能够表达完整的TLR4/NF-κB信号通路.TLR4激活后可通过转接蛋白MyD88 激活TAK1,TAK1又作用于NF-κB诱导激酶,导致IκB激酶 (IκB kinases,IKK)被激活,进而使NF-κB 活化[19].活化的NF-κB转位进入细胞核参与调控炎症因子的表达,使大量炎症介质如TNF-α、IL-6、IL-1β等被释放,而这些炎症介质的产生又反过来激活NF-κB,引起炎症级联反应,调控肝纤维化进程[20].可见,TLR4/NF-κB通路是连接肝炎症反应与肝纤维化的重要枢纽,可抑制TLR4/NF-κB介导的炎性反应,改善肝纤维化[21].本研究结果显示:SCA显著抑制了TGF-β1诱导活化的LX细胞中TLR4、MyD88及NF-κB的表达,提示SCA可能通过抑制TGF-β1诱导的TLR4的激活,抑制下游NF-κB通路,减轻炎症反应,发挥抗肝纤维化作用.
综上所述,本研究证实了SCA具有抗肝纤维化作用,并发现其作用机制可能与抑制TLR4/NF-κB 信号通路进而抑制HSCs活化及炎症反应有关.本研究可为五味子酯甲抗肝纤维化的开发应用提供一定的理论基础.

