氯化石蜡的毒代动力学研究进展
陈双双,耿柠波,曹蓉,高媛,张海军,陈吉平
1. 大连海事大学环境科学与工程学院,大连 116026 2. 中国科学院大连化学物理研究所,大连 116023
氯化石蜡(chlorinated paraffins, CPs)是氯代正构烷烃混合物,其分子式为CnH2n+2-xClx,氯含量在30%~70%之间。根据碳链长度,CPs可分为短链氯化石蜡(SCCPs, C10~13)、中链氯化石蜡(MCCPs, C14~17)和长链氯化石蜡(LCCPs, C18~30)。CPs具有化学稳定性、阻燃性和低挥发性等优点,至今已有数百种含有CPs的产品被开发、生产并大规模应用,如金属加工润滑剂、塑料增塑剂、阻燃剂、涂料添加剂、皮革加脂剂和密封剂等[1-2]。由于广泛的工业应用,在环境中和生物体内能普遍检测到CPs,这对野生动植物和人类构成了潜在危害[3-6]。近年来,国内外学者和监管机构对CPs的关注增多,针对CPs的生态风险和人体健康风险已有了一些工作进展。SCCPs因具有长距离迁移能力、环境持久性和生物累积性等特性[7-10],于2017年被列入《关于持久性有机污染物的斯德哥尔摩公约》附件A的受控清单[11],预计未来SCCPs的生产和使用将减少,大部分应用将被取代,有建议将MCCPs作为SCCPs生产使用的主要替代品,但MCCPs也于2021年被欧洲化学品管理局列入高关注度物质清单(SVHC list)中[12-13]。考虑到CPs庞大的生产量和其替代品的潜在风险,开展CPs的生物转化和毒代动力学研究能够推动其毒理学发展和替代品的健康风险评估。
毒代动力学是通过研究外源性化合物在生物体内吸收、分布、代谢以及排泄的过程和特点,探讨毒性发生和发展的规律性,从而为毒物安全性评价提供科学依据。目前有关CPs在动物体内的毒代动力学研究已取得了一些进展,以大鼠为模式动物,系统揭示了SCCPs的半衰期、组织分布和消除动力学。另外还有研究阐述了CPs在两栖和爬行动物以及鸟类体内的组织分布特征,探索了SCCPs在植物中的吸收途径、双向迁移和代谢过程以及在微生物中的降解过程。借助毒代动力学研究能够掌握CPs在生物体内的组织分布和消除规律,还能够在此基础上比较CPs及其代谢产物对生物体的毒性。目前CPs在生物体内的代谢途径和中间代谢产物还不清楚,尚没有CPs毒代动力学的综述性文章。本文系统地总结了CPs在动物体内的吸收、分布、代谢以及排泄规律,归纳了CPs在植物中的代谢转化和经微生物的代谢降解途径,并对未来的研究重点进行了展望。
1 CPs在生物体内的吸收与分布(Absorption and distribution of CPs in organisms)
CPs进入生物体的途径主要有2类,一为从环境介质中经呼吸道吸入或随皮肤接触吸收,二为通过摄食经胃肠道吸收,目前,CPs已在多种生物中被检测到[2,14-16]。一旦被吸收,CPs在生物体中经血液被分配到不同器官,从而实现在生物体内的积累,而且CPs在不同器官的分布水平呈现显著差异。已经开展的研究工作评价了水生生物对CPs的生物富集和生物放大能力,研究了CPs在两栖、爬行动物和鸟类体内的组织特异性分布特征。近期,在两栖、爬行动物和鸟类,甚至人体内发现了CPs的母体转移途径,还深入探索了碳链长度、氯化度对母体转移的影响。
1.1 水生生物
CPs普遍存在于水生生态系统中,在环境水体中SCCPs的浓度范围为15~4 000 ng·L-1[17-21],MCCPs的浓度范围为40~3 870 ng·L-1[17]。CPs能够从水生生态系统中转移并富集于水生生物体内,甚至可能在食物网中沿营养级放大。其生物富集和生物放大作用分别可以用生物富集因子(BAF)和营养级放大因子(TMF)来衡量。Castro等[22]基于实验室生物富集和生物累积实验研究了大型水蚤(Daphniamagna)对SCCPs、MCCPs和LCCPs的生物积累潜力。结果表明,CPs在大型水蚤中log BAF在6.5~7.0之间,随着碳链长度或氯化度的增加而增加,这表明CPs在大型水蚤中具有很强的生物富集性。水生生物对CPs的生物富集能力在不同物种中表现出显著差异。Houde等[23]测得安大略湖的湖红点鲑(lake trout)对SCCPs和MCCPs的log BAF分别为4.1~7.0和6.3~6.8,表现出生物富集性。值得注意的是,该数据计算基于Gobas的食物网模型,而该模型可能倾向于高估CPs的水平[24]。Ma等[8]测得辽东湾无脊椎动物和鱼类对SCCPs的log BAF在4.5~5.6之间。其中,鱼类的log BAF为4.7~5.6,低于安大略湖的数值。浮游动物(zooplankton)的log BAF为4.5,显示出相对较低的生物富集性,而一些双壳类底栖生物则较高,如短颈蛤(short necked clam)、扇贝(Chinese scallop)和文蛤(Mactraquadrangularis)的log BAF分别为5.5、5.1和5.2。这可能是由于底栖生物生活在靠近沉积物的水中,其CPs浓度相对较高。Zeng等[3]测得北京某污水处理厂出水口鱼类对SCCPs的log BAF在4.7~5.4之间,表明具有一定的生物富集能力。BAF随SCCPs氯化度的增加而显著增加,但与碳链长度之间没有显著的线性关系(P>0.05)。
CPs的生物富集潜能与其辛醇-水分配系数(logKow)密切相关,但在不同种类的生物体中表现出的趋势却不尽相同。Sun等[25]在电子垃圾污染的淡水中采集的鲮鱼(small mud carp)、鲫鱼(crucian carp)、黑鱼(snakehead)和鲶鱼(catfish)、对虾(oriental river prawns)和中华绒螯蟹(Chinese mitten crabs)对SCCPs的log BAF在2.46~3.49之间。对于杂食性鱼类(鲮鱼和鲫鱼),SCCPs的log BAF随着logKow的增加而增加;对于肉食性鱼类(黑鱼和鲶鱼),log BAF与logKow之间没有相关性。对于底栖甲壳动物(对虾和中华绒螯蟹),log BAF却随着logKow的增加而减小。这表明不同水生生物由于生活习性不同,富集SCCPs的途径除了水体,还包括了食物、沉积物或其他途径。因此,该研究认为BAF不能作为后4个物种通过水体对SCCPs生物富集的良好指标。然而,Huang等[21]发现底栖贝壳动物牡蛎(oysters)的log BAF随着logKow的增加而显著增加。综合分析,吸收途径对水生生物富集SCCPs的重要性仍需要更深入的研究。
TMF>1表明污染物在食物网中具有生物放大的潜力,反之为营养级稀释。由于CPs包含了不同碳链长度和氯含量的同族体,有关CPs的TMF的研究结果差异较大。在辽东湾“浮游动物-虾-鱼”食物网中SCCPs的TMF为2.38[8];中国北方高碑店湖水生食物链中SCCPs的TMF为1.60[3]。然而,在加拿大安大略湖“无脊椎动物-饲料鱼-湖红点鲑”食物网中SCCPs和MCCPs的TMF分别为0.47~1.50和0.06~0.36,美国密歇根湖食物网中SCCPs的TMF为0.41~2.40,其中SCCPs(Cl8~9)的TMF>1,表明高氯含量的SCCPs容易在水生食物网中沿营养级生物放大[23];Sun等[25]研究了SCCPs在受电子垃圾污染的淡水食物网“大闸蟹-对虾-鲶鱼-蛇”中的污染特征,发现SCCPs在该水生食物网中TMF为0.17,表现为营养稀释效应。SCCPs在水生环境中沿营养级传递的过程受许多因素的影响,如食物链的结构、SCCPs的污染水平和同组体分布特征、生物的吸收和代谢速率、环境微生物转化、甚至是水温、溶解有机物、悬浮颗粒等环境参数都可能是造成这种差异的原因。
1.2 两栖和爬行动物
两栖和爬行动物是生态系统的重要组成部分,但目前国内外其生物富集和生物放大作用数据比较有限。在持久性污染物发生生物富集和生物放大效应的研究中,蛙类和蛇类在食物网中通常处于高营养级位置,因此是需要优先考虑的生物。此外,蛙类和蛇类比较常见并且易于捕捉,为比较理想的研究生物。Liu等[2]报道了华南某电子垃圾回收站食物网“昆虫-两栖动物”对SCCPs和MCCPs的TMF分别为2.08和2.45,存在显著的生物放大作用。生物放大因子(BMF)与TMF类似,BMF>1表明污染物在食物链中具有生物放大的潜力,Guan等[26]测得华南某电子垃圾污染池塘“鱼-水蛇”食物链对SCCPs和MCCPs的BMF分别为2.9和2.95,并且与氯化度呈显著正相关,具有生物放大的能力。Du等[27]测得超短链氯化石蜡(vSCCPs, C6~9)、SCCPs、MCCPs和LCCPs在长江三角洲“蛙-蛇”食物链的BMFs分别为2.2、1.9、1.8和1.7,表现为不同程度的生物放大作用。
在短尾腹蛇(Gloydiusbrevicaudus)和红点锦蛇(Elapherufodorsata)中,vSCCPs和SCCPs的组织特异性贡献模式相似,均优先分布于蛇肝,而脂肪是MCCPs和LCCPs的重要储存部位[27]。CPs主要表现出脂溶性分布规律,即主要积累于动物体的脂肪中。SCCPs、MCCPs和LCCPs在黑斑蛙(Pelophylaxnigromaculatus)体内的组织特异性分布存在性别差异,主要表现在雄蛙肌肉组织中3种CPs的浓度是雌蛙的3.3倍~7.6倍[28]。Du等[28]提出了CPs的母体转移途径,即雌蛙在产卵过程中将污染物转移到卵中从而降低母体肌肉中CPs浓度,并发现母体转移与化学物质的亲脂性有关。卵壳对早期生命具有一定保护作用,孵化前胚胎主要依靠自身卵黄囊来维持生命,与环境既不发生能量交换也不发生物质交换,这种方式能够阻止环境污染物进入卵中,然而,母体转移途径打破了该壁垒,大大加剧了环境污染物对生命早期的健康风险。Guan等[26]进一步评估了SCCPs和MCCPs在水蛇体内的母体转移潜力,发现由于卵中的脂肪含量比母体中高,CPs倾向于在卵中积累,尽管CPs对母体肌肉中脂类的亲和力更高。
1.3 哺乳动物
在Zeng等[29]的研究调查中,近10年来江豚和海豚样品中SCCPs和MCCPs浓度在两性间无显著差异。这与在两栖和爬行动物中发现的CPs在生物体内的分布存在性别差异现象不同[28],所以关于性别差异是否具有普遍性仍有待更进一步的研究。然而,与两栖和爬行动物的母体转移类似,CPs在人体中存在通过胎盘的母婴转移途径,以及哺乳动物特有的通过母乳的母婴转移途径[28,30-33]。虽然胎盘可以过滤掉母体中的一些外源物质,对胎儿起着屏障的作用[34],但还是有很多污染物能够穿过胎盘屏障,对胎儿健康具有潜在风险。Aamir等[30]研究了SCCPs和MCCPs通过胎盘的母婴转移,发现低氯含量和较短链的CPs通过胎盘转移的能力更强。MCCPs的胎盘与母体浓度比值显著高于SCCPs,表明MCCPs更容易保留在胎盘组织中。碳链长度为10~14的CPs在脐带血和母体中的浓度比值相似,碳链长度>15的CPs,该比值随着碳链长度的增长而降低。这可能是由于较长链同系物基团与胎盘蛋白具有更大的结合亲和力。同时,主动转运也可能影响胎盘运输,而主动转运与转运蛋白关系密切[35]。这表明了CPs与蛋白结合的亲和力在很大程度上决定了CPs在母亲和胎儿之间的分布模式。但在另一项研究中发现SCCPs或MCCPs穿过胎盘的比率随着碳链长度的增加而增加[31]。此外,关于CPs氯化度对胎盘转移影响的研究中,Aamir等[30]发现低氯化度的CPs通过胎盘转移的能力更强,而Qiao等[31]发现CPs通过胎盘转移的能力似乎随着氯化度的增加而增加,这可能是由于CPs的同组体众多,而以人群为研究对象个体差异较大导致的。所以对于CPs碳链长度和氯含量对胎盘转移的影响可能需要进一步借助动物实验获得确切的结论。在Zhang等[36]的综述中,归纳了包括CPs在内的多种持久性卤代有机污染物(HOP)经胎盘转移效率的影响因素以及可能的转移机制。在进一步的研究中,Aamir团队比较了母乳转移与胎盘转移对人类胎儿的影响,结果显示,SCCPs或MCCPs在母乳中的浓度远高于脐带或胎盘的浓度,这表明产后的母乳暴露具有潜在健康风险。但是,还应该注意产前暴露正处于胚胎发育早期,其健康风险不容忽视[33]。
CPs在啮齿类动物体内表现出快吸收、在脂肪滞留的特点。大鼠经口单次暴露SCCPs后,其吸收和分布半衰期分别为1.0 d和1.7 d,血药浓度峰值在第2.8天出现[37]。Darnerud等[38]和Biessmann等[39]通过同位素标记法探究了CPs在C57B1小鼠体内的分布,结果表明C12-CPs和C16-CPs在12 h内易分布在细胞增殖旺盛、代谢能力较强的组织(如肠粘膜、骨髓、胸腺和唾液腺等);C12-CPs在12 d后主要在肝脏和白色脂肪组织分布,在30 d后能够到达中枢神经系统。由于中枢神经系统还包括了具有抑制剂和镇静剂作用的物质,其损伤不仅会抑制运动能力,还表现在直肠温度的调节[40]。总之,该研究中SCCPs到达中枢神经系统的现象应当予以重视[41]。CPs在啮齿类动物中同样表现出易在脂肪中滞留的特点。这可能是由于CPs具有较强的亲脂性。SCCPs、MCCPs和LCCPs的logKow分别为4.48~8.69、6.83~8.96和8.70~12.70,而当化合物的logKow>5时,其亲脂性较强。
1.4 鸟类
C16-CPs在日本鹌鹑体内的分布与C57B1小鼠有类似的规律,在饲喂4 h后,C16-CPs主要分布于肝、肠、胆、蛋黄、肾、卵巢、血液、垂体和视网膜中;1 d后,只有血液中的含量显著下降;12 d后,仅分布于尾咽腺、白色脂肪、肝脏和蛋黄中[39]。Ueberschär等[42]研究了母鸡体内SCCPs(60% Cl)的组织分布特征。饲喂SCCPs后,母鸡吸收的SCCPs先到达肝脏,后其中的大部分被转移到蛋黄中。SCCPs在各组织中的含量与喂食量成正比,只有在胆汁中的含量有一个极低的饱和值。经100 mg·kg-1SCCPs喂食8周后,SCCPs在母鸡的粪便、蛋黄和腹部脂肪组织中含量最高;少量存在于肌肉、蛋清和胆汁中。SCCPs在肉鸡体内也发现了类似的分布[43]。总之,CPs在鸟类体内的分布同样表现出脂溶性规律。Mézière等[44]研究了母鸡饲喂添加了200 ng·g-1SCCPs、MCCPs或LCCPs的饲料后,母体向鸡蛋转移CPs的规律。结果表明,高亲脂性CPs更倾向于在鸡蛋中累积,CPs的亲脂性随着碳链长度和氯化度的增加而增加,但当高氯化度LCCPs的分子量>1 000 g·mol-1时,尽管其亲脂性仍然增加,但不太容易通过肠道屏障被吸收进而转移到鸡蛋中,而是通过粪便直接排泄。在自然实验环境下,由于鸡对不同碳链长度的CPs的摄入量是不确定的,不可能准确计算吸收、代谢和排泄速率,但这一研究有助于评估家禽由CPs暴露引起的食品安全风险。Huang等[45]研究了SCCPs、MCCPs和LCCPs对散养在电子废物回收区的母鸡的吸收影响。结果表明,小肠是吸收CPs的主要部位,但不同碳链长度和氯化度的CPs对小肠吸收没有产生显著影响。这可能是由于较长碳链和较高氯化度的CPs的疏水性增加,部分抵消了其分子尺寸的增加所造成的不利影响。母鸡通过产蛋转移CPs的规律与Mézière等[44]的研究结果类似,疏水性强的CPs更倾向于富集到鸡蛋中。此外,CPs通过母鸡母体转移途径的亲脂性相关性研究结果,对两栖动物具有参考意义。
1.5 植物
植物作为生态系统的生产者,与有机污染物的交互作用是其环境过程和归趋研究的一个重要领域。但目前仅以大豆和南瓜幼苗为受试生物,研究了CPs被吸收、迁移和富集的规律[46]。幼苗可以通过根和叶分别从土壤溶液和空气中吸收SCCPs,能将富集在体内的SCCPs通过植物挥发作用经叶片释放到大气中,蒸气压和溶解度越高则越容易挥发。SCCPs在大豆幼苗中的迁移为双向迁移过程,表现为根部从水溶液中吸收SCCPs向上迁移到叶,以及叶吸收大气中的SCCPs向下迁移到根部。迁移受碳链长度和氯化度的影响,链长较短、氯化度较低的SCCPs更容易向上迁移,在叶中富集;反之,则更容易在根部富集。其中,氯化度的影响强于碳原子数。此外,SCCPs在南瓜幼苗中也存在类似的规律,且迁移能力比大豆更强[47]。
2 CPs在生物体内的代谢与排泄(Metabolism and excretion of CPs in organisms)
外源性化合物在生物体内的消除过程通常包括代谢和排泄2种形式,代谢是指外源性化合物在酶的生物转化下,化学结构发生改变;排泄是外源性化合物经肠道随粪便或经肾脏随尿液排出体外的过程。
2.1 在动物体内的代谢与排泄过程
2.1.1 消除途径
已有研究表明,CPs在动物内的消除途径主要有2种:一是通过β-氧化途径被代谢为CO2,二为CPs及其Ⅱ相代谢物经粪尿排泄。不同氯化度C12-CPs的代谢方式不同,在12 h内,C12-CPs(68.5% Cl)在小鼠体内主要的代谢方式是粪便,C12-CPs(55.9% Cl)主要的代谢方式是尿液和代谢为CO2,C12-CPs(17.4% Cl)主要通过呼吸系统代谢为CO2[38]。这一结果与C16-CPs的消除规律一致,表明CPs的氯化度与代谢为CO2的程度成反比。高氯化度的CPs主要通过粪便排出,通过尿液和呼气排出的比例极低,这可能是由于其低水溶性和低蒸气压所导致的[39]。在Ueberschär等[42]的研究中,停止喂食含SCCPs(60% Cl)的饲料6周后,约有1%的SCCPs留在体内,约1.5%的SCCPs储存在蛋黄中,约30%的SCCPs随尿液和粪便排出体外。但未解释其余67.5% SCCPs的去向,推测代谢为CO2或Ⅱ相代谢物通过粪尿排泄。在Geng等[37]的研究中,给药后的28 d里,大鼠中约27.9%和3.5% SCCPs(56.5% Cl)分别通过粪便和尿液排出体外,该结果与Ueberschär等[42]的结论相符。在Dong等[48]的基于生理药代动力学(PBPK)模型的研究中,给药后2周里,大鼠中有78%~95%、84%~99%和87%~98%的SCCPs(55.5% Cl)、MCCPs(52.0% Cl)和LCCPs(49% Cl)及其代谢物通过粪便排泄。该结果通过模型计算,间接证明了通过代谢为Ⅱ相代谢物经粪便排泄属于Ueberschär等[42]的研究中的空白途径。肝脏是主要的代谢器官,其代谢能力随着CPs碳链长度和氯化度的增加而下降。这可能是由于更长碳链和更高氯化度的CPs对空间的需求更大,不利于共价加合物的形成,表现为阻碍它们与代谢酶的相互作用而形成代谢差异[45]。这与Dong等[48]经模型计算的结果相符[48],SCCPs、MCCPs和LCCPs在大鼠肝微粒体中的代谢速率分别为1.31×10-6、2.54×10-6和3.55×10-6h-1,在人体中分别为3.00×10-6、4.47×10-6和5.56×10-6h-1。综上对较高氯化度CPs的研究符合C12-CPs和C16-CPs的代谢规律,然而,现有的研究并未对低氯化度的CPs进行探讨。
CPs的半衰期在不同生物体内差异显著,但具有慢消除的共性。如在大鼠的血液中,SCCPs的消除半衰期为6.6 d[37];在虹鳟鱼中SCCPs的半衰期为7~37 d,C14-CPs的半衰期为29~53 d,与Kow、碳链长度和氯含量呈正相关[49];在大型水蚤中SCCPs、MCCPs和LCCPs的半衰期分别为10、2和7 h[22]。另外,Dong等[48]基于大鼠对CPs的暴露数据和深圳某地区人体CPs暴露数据,建立了SCCPs、MCCPs和LCCPs在大鼠和人体内的PBPK模型,验证了胆汁排泄为影响半衰期的重要过程。胆汁排泄是指肝脏中的外源性化合物或其代谢物与胆汁一起分泌至肠道,再随粪便排出体外的过程。在Darnerud等[38]对小鼠的研究中发现CPs经历胆汁排泄的可能性,后来Ueberschär等[42]在母鸡体内也发现类似可能性[38,42]。Dong等[48]对此进行了进一步的探究,发现分子量>325 g·mol-1的化合物可以通过胆汁排泄。敏感性分析和模型预测表明,CPs大部分被转移到肝脏和脂肪,CPs在肝脏中对新陈代谢具有抵抗力,在胃肠道中也会经历缓慢的生物转化,因此代谢抗性化合物主要通过胆汁排泄进入粪便而排到体外。胆汁排泄是影响生物体内CPs组织水平和半衰期的重要过程,研究发现,较长链的氯化石蜡(MCCPs和LCCPs)更容易通过胆汁排出。CPs在人体胆汁中的排泄率比大鼠低约2个数量级,导致CPs在人体半衰期较长。经计算,SCCPs、MCCPs和LCCPs在大鼠体内半衰期分别为6.2、5.4和4.5 d,在人体内的半衰期分别为5.1、1.2和0.6 a。毒代动力学结果显示,在暴露水平相似的情况下MCCPs和LCCPs在血液、肝脏和脂肪中的负荷为SCCPs的10%~20%。Åhlman等[50]基于同位素标记,研究了C16-CPs(65% Cl)在大鼠胆汁中的代谢。14C16-CPs在大鼠体内有广泛的代谢,胆汁中未改变的14C16-CPs<3%。并且在大鼠胆汁中检测到了N-乙酰半胱氨酸(巯基尿酸)和谷胱甘肽与14C16-CPs的共轭产物,这说明14C16-CPs可能经历了巯基尿酸途径和谷胱甘肽共轭途径。
2.1.2 代谢途径及其代谢产物
污染物作为外源化合物进入动物体内,在一系列相关的非特异性酶作用下进行Ⅰ相和Ⅱ相代谢。Ⅰ相代谢通常是在细胞色素P450酶、过氧化物酶等代谢酶的作用下发生氧化和水解反应,使污染物生成分子量更低(如脱卤作用、裂解作用)或极性更强的物质(如羟基化作用等)。经过Ⅰ相代谢生成的带有羟基、羧基等极性基团的产物,作为底物在Ⅱ相代谢酶的作用下,进一步与硫酸盐、糖苷和谷胱甘肽等内源性化合物发生结合,即Ⅱ相代谢。大多数情况下,Ⅱ相代谢得到的结合产物与母体化合物相比,毒性更低,极性更强,易于排出体外。但在少数特殊情况下,一些中间或最终产物毒性反而增强,这被称为外源化合物的激活。
目前,CPs经代谢转化为最终产物CO2的具体途径研究还未有报道。借鉴于一般氯代脂肪烃的生物转化过程:烷烃水解为醇,醇氧化为酸/醛,再分解为CO2和H2O。Darnerud[51]研究了14C12-CPs在C57Bl小鼠体内代谢为14CO2的过程中起调控作用的酶,发现抑制细胞色素P450酶活性会显著降低CPs向14CO2转化的速率,而加入细胞色素P450酶后能够促进14CO2的形成,表明CPs在大鼠体内的代谢是由细胞色素P450酶介导的。其中,高氯化度的C12-CPs更多地依赖细胞色素P450酶代谢为14CO2,但尚未对C12-CPs的代谢过程和转化机制进行研究。Wang等[52]采用密度泛函理论,以1-氯代癸烷为目标化合物,探讨了细胞色素P450酶对SCCPs的代谢机制和代谢物毒性。结果表明,1-氯癸烷易被细胞色素P450酶代谢,在人体内的速率常数高达42.3 s-1。1-氯代癸烷在Ⅰ相代谢中不太可能发生脱氯,羟基化是其主要的代谢途径,特别是1-氯代癸烷的中间碳原子最容易被羟基化。毒性评估表明,1-氯代癸烷通过代谢激活,它的2种中间代谢产物(10-氯癸烷-5-醇和1-氯癸烷醇)表现出更高的生物累积性、致癌性以及对心血管系统的毒性。He等[53]研究了人肝组织对CPs的体外生物转化作用,并基于高分辨质谱测定了CPs及其代谢产物的浓度,推测潜在代谢产物为vSCCPs、醇(OH-CPs)、酮(CO-CPs)和羧酸(COOH-CPs)。人肝组织中的细胞色素P450是转化CPs最有效的酶系。与细胞色素P450共同作用2 h后,SCCPs、MCCPs和LCCPs含量分别比对照组下降了85%、98%和73%。C—C键的断裂是CPs的一种相关代谢途径,CO-CPs是重要代谢产物,而OH-CPs和COOH-CPs是CPs代谢的中间体。综上,CPs在动物体内可能的代谢途径如图1所示。
2.2 在植物中的代谢过程
由于植物和动物肝脏具有互补的脱氧核糖核酸序列和相似的酶体系,对外源化合物也具有相似的代谢作用,因而植物有“绿色肝脏”之称。外源化合物在植物体内的代谢过程一般包括Ⅰ相、Ⅱ相和Ⅲ相代谢。Ⅰ相和Ⅱ相代谢与动物类似,Ⅲ相反应是指其代谢产物被细胞壁固定或者液泡隔离的过程。Chen等[54]研究了悬浮水稻细胞对SCCPs和MCCPs的代谢过程。结果显示悬浮水稻细胞对SCCPs和MCCPs的代谢率分别为79.53%和40.70%,可鉴别代谢产物分别为45种和25种,包括Ⅰ相代谢产物(脱氯/加氢-(多)羟化、脱HCl-(多)羟化)和Ⅱ相代谢产物(硫酸化、糖基化),总结了CPs在植物体内可能的代谢产物与反应途径,如图2所示。
Li等[47]进一步基于电子捕获负化学源-质谱法(ECNI-MS)检测到1,2,5,5,6,9,10-七氯癸烷在南瓜幼苗中的脱氯和氯重排转化产物,包括C10H17Cl5、C10H16Cl6和C10H15Cl7,由于低氯取代的化合物在ECNI源下响应较弱,进一步脱氯产物(Cl<5)无法检测。该研究提出在以南瓜为受试植物的暴露系统中,同时存在2种SCCPs的转化过程,除了在植物体内的直接转化,还存在空气中的间接转化,即部分易挥发的SCCPs母体及其转化产物释放到体外的空气中,在植物释放的挥发性有机物(VOCs)和空气中的·OH的诱导作用下发生转化[55]。Li等[55]进一步比较了南瓜和大豆幼苗对SCCPs的代谢产物和转化时间变化趋势。两者中不同母体的转化产物相似,除了脱氯和氯重排产物,在南瓜和大豆幼苗中还发现了SCCPs的碳键断裂产物。母体化合物中所含碳原子数分别为10、11和13,然而却在暴露体系中检测到了碳原子数为12的代谢产物。南瓜幼苗不同组织中代谢产物的总量随时间先增加后减少。叶、茎和根部代谢产物最高值分别出现在第4天、第6天和第10天。暴露前4天,代谢产物富集于根部,其次为叶,茎中最低。暴露第6天和第10天,转化产物分布量分别为根>茎>叶和茎>根>叶。SCCPs暴露10天后在大豆幼苗中的转化产物在组织中的分布与南瓜幼苗类似,但代谢产物是南瓜幼苗中的3.9倍。所以虽然大豆幼苗对SCCPs的迁移能力比南瓜幼苗低,但生物转化能力大于南瓜幼苗。

图1 氯化石蜡(CPs)在动物体内可能代谢产物和反应途径注:SCCPs表示短链氯化石蜡,MCCPs表示中链氯化石蜡,LCCPs表示长链氯化石蜡,vSCCPs表示超短链氯化石蜡;红色框内为SCCPs的羟基化反应。Fig. 1 Reaction pathway and possible metabolites of chlorinated paraffins (CPs) in animalsNote: SCCPs means short-chain chlorinated paraffins, MCCPs means medium-chain chlorinated paraffins, LCCPs means long-chain chlorinated paraffins, and vSCCPs means very short-chain chlorinated paraffins; the hydroxylation of SCCPs was highlighted in the red box.
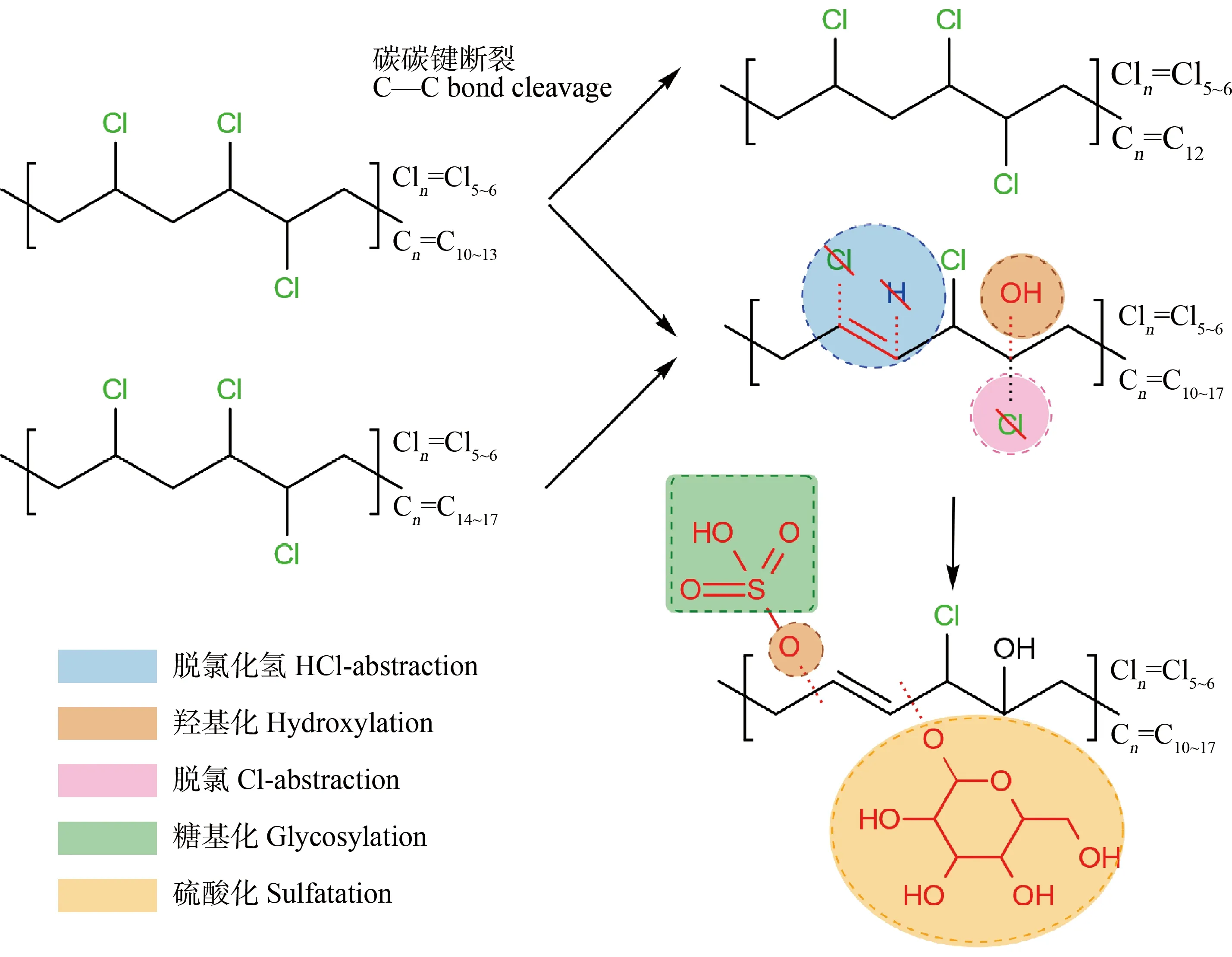
图2 CPs在植物体内可能的代谢产物与反应途径Fig. 2 Reaction pathways and possible metabolites of CPs in plants
2.3 在微生物中的降解
CPs可以在水、土壤和沉积物中通过微生物发生降解,目前已有研究探讨了鞘氨醇单胞菌对SCCPs的生物转化作用。但尚缺少关于MCCPs在各介质中经微生物降解的研究。Heeb等[56]研究了卤代烷烃脱氢酶LinA2催化SCCPs的生物转化作用,发现LinA2可以催化SCCPs发生HCl消除(E2)反应,形成氯化烯烃(COs),LinA2对SCCPs的转化与其氯取代度有关,较低氯化度的同系物不易被LinA2转化,易在生物体内累积,而较高氯化度的同系物易被转化。但由于SCCPs是混合物,其中既包含容易被LinA2转化的同系物,也包含不易转化的同系物,难以确定代谢中间产物。Knobloch等[57]使用卤代烷脱卤酶LinB催化C13-CPs混合物,包含氯代十三烷、氯代十三烯烃和二烯烃。结果发现,LinB可以催化C13-CPs混合物发生脱卤羟基化(SN2)反应,形成羟基化产物。但并不影响烷烃、单烯烃和双烯烃的比例,说明LinB不催化E2反应,CPs在微生物体内可能的代谢产物如图3所示。在进一步的研究中,Knobloch等[58-59]采用一级双峰动力学模型模拟了C11-CPs、C12-CPs和C13-CPs以及C11-COs、C12-COs和C13-COs的脱氯动力学,结果表明,LinB优先代谢较低碳链长度、低氯化度的物质,较高碳链长度、高氯化度的物质的转化速度较慢,在该体系中更持久。因此,基于微生物对CPs的代谢来看,禁止使用SCCPs并建议使用长链的CPs,可能会带来CPs更持久的环境存在。
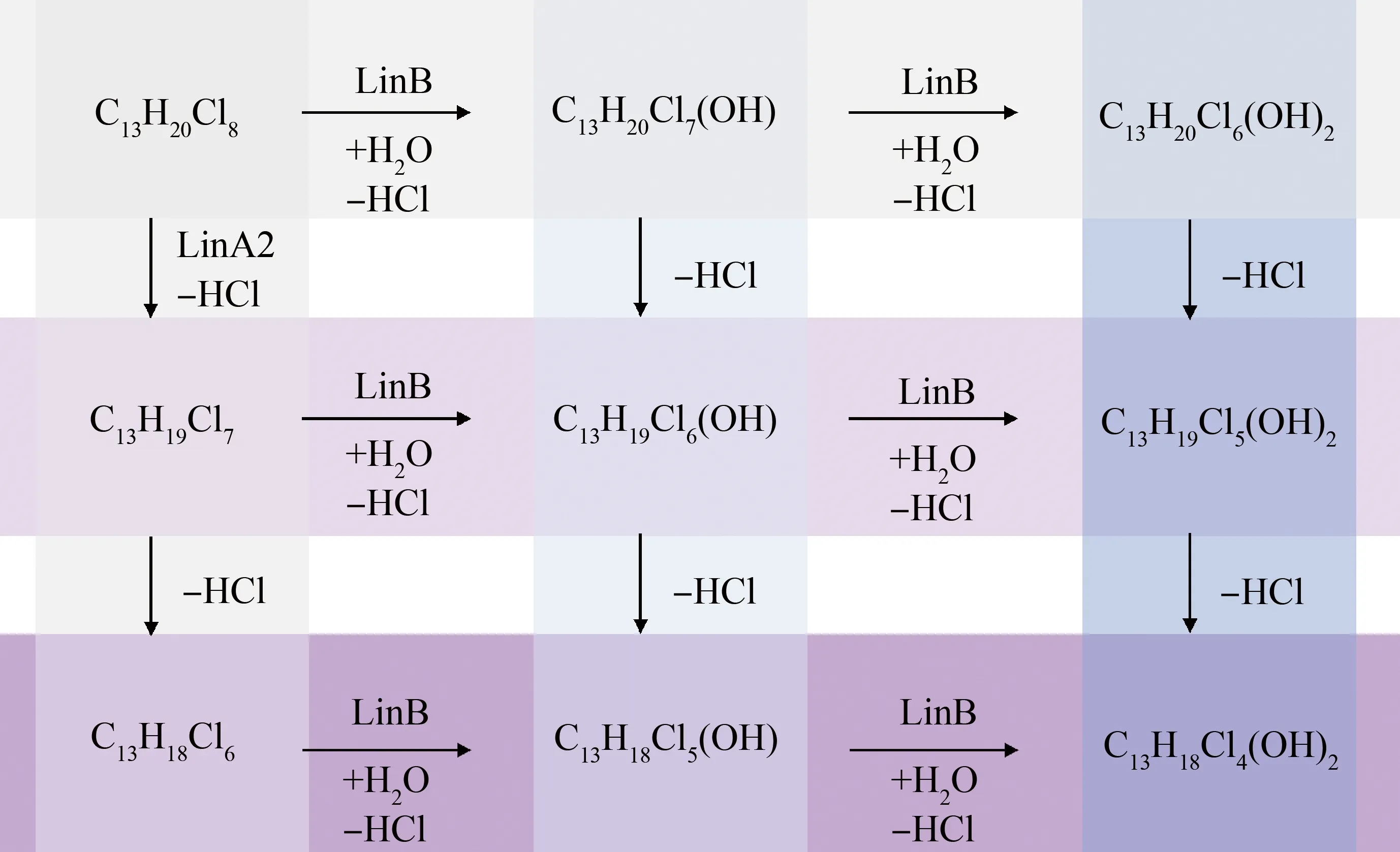
图3 CPs经微生物转化的潜在反应途径Fig. 3 Potential reaction pathway of microbial transformation of CPs
3 结论与展望(Conclusion and prospect)
毒代动力学是污染物健康风险评估的重要内容,CPs赋存于包括水体、土壤、空气和生物体等在内的许多介质中,通过皮肤、呼吸道和胃肠道被生物体吸收。其中,CPs在水生和陆生食物链中能够沿营养级放大,具有潜在的危害,应当予以重视。CPs进入生物体后经血液分配到不同器官,特异性分布于不同组织,在组织分布特征方面,CPs主要表现出脂溶性化合物分布规律,即主要积累于动物体的脂肪中;在分布速率方面,表现出吸收快、消除慢的特点。近期,CPs经母体转移的特征引起了广泛的关注。在两栖、爬行和鸟类动物中,具有高亲脂性的CPs更倾向于在卵中累积。在人体中,CPs的母婴转移受到其碳链长度和氯化度的影响。生物体对CPs也表现出一定的消除作用,但其代谢过程尚不清楚。目前仅以同位素标记的方式通过监测SCCPs的代谢终产物CO2研究了SCCPs在动物中的代谢转化;从理论计算方面推测某个SCCPs单体在体内可能的代谢途径;或者基于高分辨质谱测定了CPs的Ⅰ相代谢产物。研究发现CPs在动物体内的代谢途径主要由细胞色素P450介导,但CPs代谢为易排泄的Ⅱ相代谢产物和呼吸系统的最终产物CO2的途径尚不清楚,CPs在动物体内代谢的中间产物和代谢途径尚需进一步深入研究。SCCPs在植物中的代谢途径为脱氯、氯重排以及碳碳键断裂。SCCPs经微生物降解主要是发生了HCl消除和脱卤羟基化反应。总之,国内外有关CPs的毒代动力学研究已取得一些进展,但仍有一些问题需要进一步深入研究。
首先,随着CPs在不同环境基质甚至人体中的检出[60-63],研究人员积极开展了CPs的风险评价工作,但主要集中在SCCPs的研究上。考虑到SCCPs的毒性效应和环境持久性,联合国环境署在SCCPs风险管理评估报告中,推荐将MCCPs作为SCCPs的代替物,但二者高度相似的化学结构、理化性质与毒理学性质,目前还没有足够证据表明MCCPs是SCCPs的安全替代品,其可行性仍有待进一步评估。研究人员提出氯含量超过46%的MCCPs同系物应视为持久性物质[64],近年来有关食品中MCCPs含量高于SCCPs的报道,更对其可行性提出了挑战,因此对MCCPs的毒代动力学和健康风险进行系统评估是毒理学领域未来的研究重点。
其次,目前对CPs在动植物以及微生物中的代谢研究较少,同时由于CPs是一类混合物,同族体众多,受技术手段和检测工具的限制,使得CPs在生物体中的代谢途径和代谢产物尚不清晰。针对动物体内的代谢过程,研究仍停留在检测Ⅰ相代谢产物的阶段,Ⅱ相代谢产物的研究尚属空白。更匮乏的是,CPs代谢转化为CO2的研究,除了其中起调控作用的细胞色素P450酶,没有对具体途径进行研究。在植物体内的代谢过程中,可知现代的研究技术对其代谢途径的发现起着至关重要的作用。因此,在未来的研究中,结合先进的分析技术,全面探究CPs的代谢过程是可能实现的。
再次,CPs作为环境新污染物,具有低水平长期暴露的特点。通过胎盘的产前暴露正处于胚胎的发育早期,通过母乳的产后暴露则具有更高的暴露水平,对早期生命产生不利影响。然而,CPs的碳链长度和氯化度对人体中母婴转移途径的影响仍没有普遍结论,因此迫切需要对CPs的影响规律进行进一步的研究和确认。另外,CPs在黑斑蛙体内的性别差异性分布特征是否意味着CPs的毒性效应具有性别差异还未可知,仍有待进一步探索。

