膀胱感染性结石大鼠的模型构建
倪永梁,刘娟娟,赵孝晓,叶丹丹,刘 霞,李丽华,张 恒,蒋德启
(山东省立第三医院泌尿外科,山东省结石病防治中心,山东济南 250031)
感染性结石是泌尿系结石中的“恶性结石”,感染性结石具有复发率高、复发时间短、生长速度快、对肾脏功能损害大等特点。感染性结石与尿液中的解脲酶细菌有直接关系,解脲酶细菌通过分解尿液中尿素、细菌生物膜以及细菌自身的粘附功能促进了感染性结石的形成,遗憾的是目前泌尿系结石基础研究方面缺乏公认的动物模型,尤其是感染性结石动物模型,很大程度上阻碍了泌尿系结石基础研究的发展,因此探索合适的泌尿系结石动物模型仍然是急需解决的重要问题。我们在前期临床研究中发现拟杆菌属是人输尿管支架管结壳中差异性表达的主要菌属,而脆弱拟杆菌为该菌属中最常见的细菌[1],基于此本研究选择用脆弱拟杆菌进行灌注,并尝试建立无创的膀胱感染性结石动物模型。
1 材料与方法
1.1 实验动物本实验选取健康雌性SD大鼠34只,6~8周龄,体重224~272 g,购买于山东省济南市朋悦实验动物繁育有限公司,饲养在山东大学实验动物中心,所有大鼠均适应性饲养1周,饲养在25 ℃的恒温室内,12 h白天,12 h黑夜,给予正常饮食。每个鼠笼3~4只大鼠。所有动物实验按照美国国立卫生研究院实验动物护理和使用指南(NIH出版物编号8023,1978年修订)进行,并获得山东省立第三医院医学伦理委员会的批准。
1.2 异物制作及放置过程膀胱内异物管为聚乙烯管(型号PE-50),购于上海红叶塑料制品有限公司。尿道内引导棒选择硬膜外麻醉导管内的金属导芯,直径0.4 mm,购于河南驮人医疗器械有限公司,异物制作过程如图1所示,另外截取长度约5 cm的PE-50管作为推管使用。实验前30 min对操作间进行紫外线照射杀菌,麻醉前禁食6 h,所有大鼠称重,采用抽签的方式随机排序确定编号,鼠尾标记编号,将体积分数为10%的水合氯醛按照0.3 mL/100 g腹腔注射,麻醉满意后,操作台铺设棉垫,将大鼠置于台面,仰卧位,充分暴露会阴部,四肢固定于操作台四角,酒精喷雾消毒,手消毒,穿隔离衣,佩戴口罩及无菌手套,碘伏液消毒会阴部,无菌纱布覆盖会阴部周边,非无菌操作器械均提前置于体积分数为75%的酒精内浸泡24 h杀菌,置管过程如图2所示。触摸耻骨上膀胱区隐约可触及质硬异物证实膀胱内螺旋管置入成功。

A:将PE-50管紧密缠绕在5 mL注射器针头上;B:100 ℃热水浇灌在PE-50管上,加热时间约15 s;C:绷紧PE-50管约1 min;D:连续制作多段螺旋管;E:裁剪螺旋管,每个螺旋管长约15 mm;F:螺旋管放入酒精溶液塑料管备用。
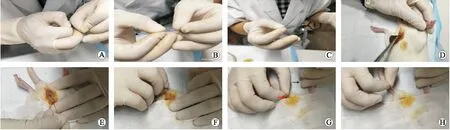
A:将螺旋管套入金属导丝;B:螺旋管已完全套入金属导丝外;C:将推管从金属导丝末端套入,推管靠近螺旋管;D:碘伏棉球消毒大鼠会阴部;E:金属导丝与腹部呈60°角进入尿道前部;F:金属导丝经尿道推入大鼠膀胱内;G:缓慢拔出金属导丝,继续向内推入推管,黑色箭头所指为金属导丝,红色箭头所指为推管;H:拔出推管,置管过程结束。
1.3 实验分组雌性SD大鼠34只分为3组。模型组:大鼠14只,适应性饲养1周后,在麻醉状态下通过金属导丝、推杆将加热塑形的螺旋状异物(聚乙烯材料)置入大鼠膀胱内,其后给予膀胱灌注脆弱拟杆菌液1×106个/mL约1.5 mL,菌液灌注,隔天1次,灌注3周(图3A)。脆弱拟杆菌菌种购买自美国典型菌种保藏中心,产品名称脆弱拟杆菌(ATCC®25285TM)(菌株型号: VPI 2553),由济南雅博生物技术有限公司储存和制备。无菌水对照组:大鼠10只,适应性饲养1周后,用模型组相同方法放置膀胱异物,其后给予灌注无菌注射用水约1.5 mL,灌注方案同模型组。空白对照组:大鼠10只,适应性饲养1周后,按照模型组相同方法放置膀胱异物,不进行灌注,正常饲养3周。
1.4 尿斑实验选取模型组大鼠进行尿斑实验,另选取10只健康成年SD雌鼠作为健康对照组进行实验结果的对比分析。在检测之前,正常饮水进食,检测当天13时放置于标准代谢笼中,在放入或取回大鼠的过程中,动作轻柔,避免大鼠引起排尿反射,代谢笼下面铺有滤纸,长40 cm,宽27 cm,禁饮水4 h,以防止水污染尿斑或者引起尿斑扩散。检测之后,大鼠放回饲养笼中,收集印有尿斑(美国Whatman公司)的滤纸。晾干后,滤纸放置于紫外线灯下观察并进行拍照。尿斑实验分析如文献所述[2-3]。
1.5 标本获取及成分分析实验结束后,颈部脱臼处死大鼠,切开膀胱组织,观察膀胱内异物形态及有无结石,将异物或结石放入5 mL冻存管内室温下保存,采用智能结石分析仪(型号SUN-3G,济南鼎舜医疗器械有限公司),采用傅里叶变换红外光谱法进行结石成分分析。切除的膀胱三角区上皮组织,部分放入体积分数为10%的中性甲醛溶液内4 ℃保存,部分置于冻存管内-80 ℃保存。
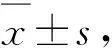
2 结 果
2.1 大鼠膀胱结石情况模型组在实验结束后存活12(12/14,85.7%)只,模型组在实验结束后12(100.0%)例存活大鼠均可见膀胱结石(图3);无菌水对照组无大鼠死亡,实验结束后有3(30.0%)只大鼠存在膀胱结石;空白对照组无大鼠死亡,实验结束后有2只大鼠存在膀胱结石,结石率20%。模型组的结石率与两个对照组之间差异存在统计学意义(P<0.05)。
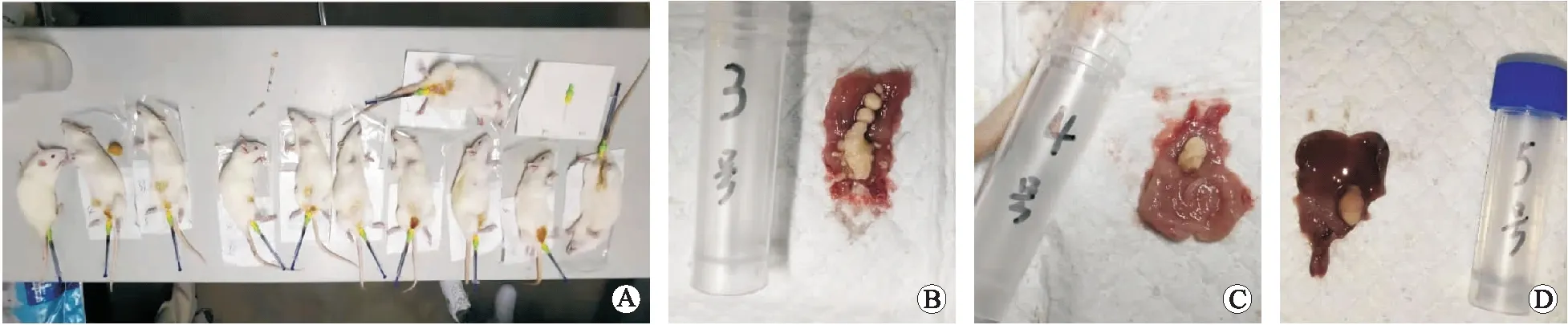
A:大鼠膀胱灌注后留置导管,保证灌注菌液在膀胱内存留;B~D:模型组大鼠所形成的膀胱结石大体观。
2.2 膀胱结石成分模型组的12只大鼠膀胱结石成分中,9只为碳酸磷灰石,3只为磷酸铵镁和碳酸磷灰石的混合结石。两个对照组的膀胱结石成分均为碳酸磷灰石。
2.3 大鼠排尿行为模型组大鼠在实验结束前进行尿斑实验,实验结果显示,与健康大鼠相比,模型组大鼠尿斑点数量较多,且在滤纸中央区域出现多个尿斑点,主尿斑所占百分比减少,提示模型大鼠存在尿频症状。模型组大鼠在滤纸中央区域的估测尿量多于健康大鼠,根据正常大鼠通常存在的趋触性特征,提示模型大鼠存在尿急症状(图4)。
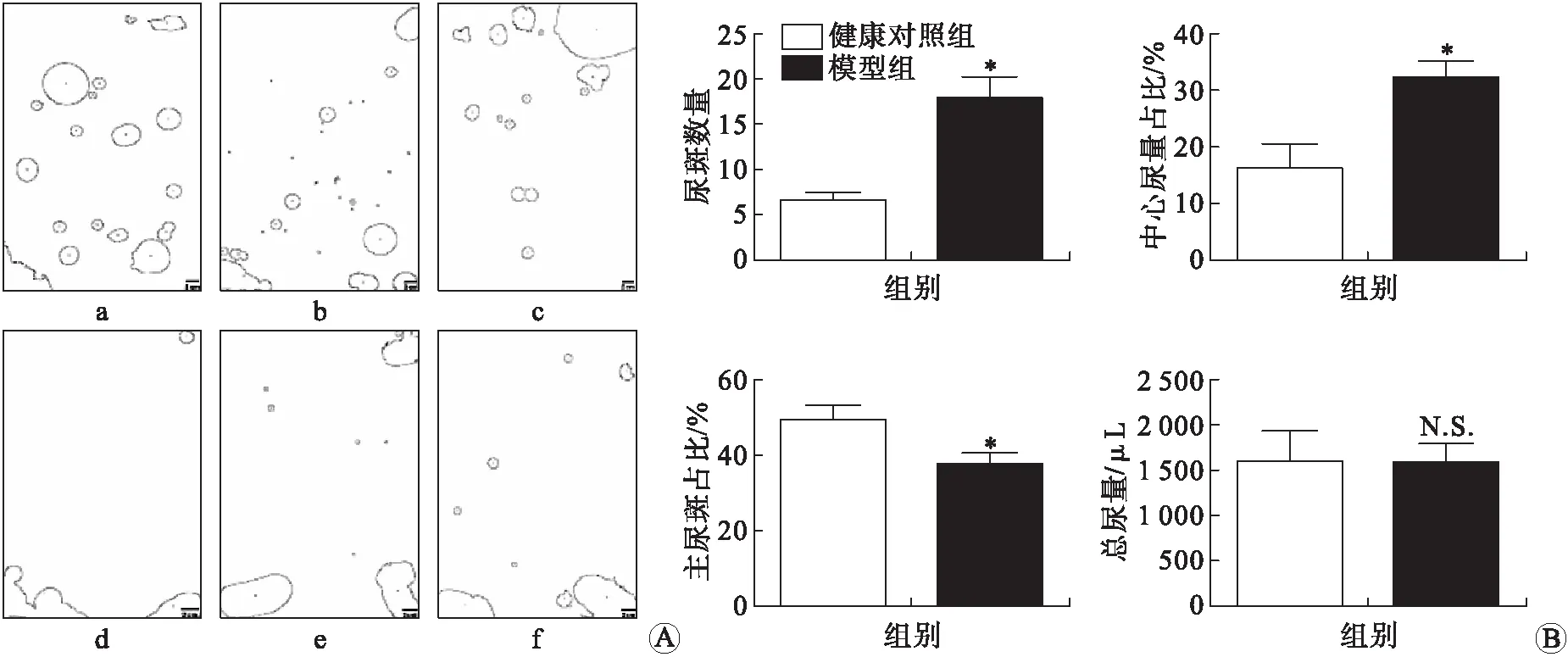
A: 模型组和健康对照组大鼠尿斑实验结果对照图(a~c为模型组大鼠尿斑图,可见尿斑点数量较多且在滤纸中央区域出现多个尿斑点,d~e为健康对照组大鼠尿斑图,尿斑点数量较少,且尿斑主要集中在滤纸边缘或角落);B: 模型组和健康对照组的尿斑数据分析。*P < 0.05;N.S:差异无统计学意义。
2.4 结石的电镜观察选取模型组大鼠膀胱结石进行扫描电镜检查,可见结石表面存在大量结晶体,纵横排列,在结晶体表面及内部可见细菌相关的生物膜以及大量杆菌存在,杆菌形态不一,处于不同的生长时期(图5)。

A、B、D:放大1万倍下可见结晶体、生物膜以及杆菌;C、E、F:放大2万倍可见生物膜上杆菌形态各异,处于不同生长时期。
3 讨 论
膀胱内异物、局部感染及下尿路梗阻是膀胱感染性结石的常见诱因,但是目前利用膀胱异物构建感染性结石的动物研究并不多见,LINSENMEYER等[4]认为将SD大鼠作为此类研究的动物模型是一种较好选择。本研究显示由膀胱异物联合脆弱拟杆菌液灌注诱导出的结石成分包括碳酸磷灰石和磷酸铵镁,前者较多见,两者均属于感染性结石,因此本次研究的动物模型形成的感染性结石是以碳酸磷灰石为主的。感染性结石的形成与解脲酶细菌感染、细菌生物膜、细菌拓殖以及尿液中的磷酸铵镁结晶等因素有关,在此次实验中,膀胱内异物为灌注的细菌提供了拓殖的空间,其后在异物表面形成细菌生物膜,有利于尿液中磷酸铵镁结晶的附着和聚集。
目前感染性结石动物模型多采用奇异变形杆菌作为灌注菌液,该细菌为解脲酶细菌,且在人类感染性结石患者的尿液细菌培养中有较高的检出率,本次研究选择灌注的脆弱拟杆菌是本课题组团队在前期研究中发现的支架管结壳患者尿液菌群中丰度占比最大的菌属——拟杆菌属的常见细菌,该菌是一种厌氧菌,常见于人类呼吸道、肠道和生殖道,是拟杆菌属的代表菌株,在本次实验中我们给大鼠膀胱内灌注脆弱拟杆菌后,围绕膀胱异物的感染性结石发生率明显增高,这说明脆弱拟杆菌的生物学功能有利于支架管结壳事件的发生,从以下两方面进行合理推理:①脆弱拟杆菌可以结合尿液中的钙离子。有文献报道,与其他细菌不同的是,拟杆菌属细菌的脂质A上的酰基转移酶LpxA含有3个钙离子结合位点,在碱基序列Asn89的调控下,能结合3个钙离子,且其中1个钙离子位于呈三重轴空间构象的LpxA的中心区域,但钙离子发挥的作用尚不明确[5]。②脆弱拟杆菌细胞膜具多种特性,可通过分泌特殊蛋白并改变细胞膜超微结构形态,参与生物膜的形成[6]。PUMBWE等[7]的研究也显示脆弱拟杆菌在不同的人体环境中,如血液、脓液及粪便中,其胞膜都表现出不同的超微结构和表达不同外排功能的外排泵作为对周围环境的反应,推测其释放的物质可能参与了支架管结壳事件的发生。另外,在体外实验中发现脆弱拟杆菌可以释放黏蛋白凝胶,有利于生物膜的形成[8]。
既往研究显示,有多种方式可以实现在大鼠膀胱内放置异物,例如进行腹部手术切开膀胱后放置异物,也可以经过腹部穿刺将异物置入膀胱内,或者采用和本研究类似的无创方法将异物经尿道置入膀胱内[4,9-11]。对于采用有创操作将异物放入膀胱内的方式,创伤以及相关并发症可能会显著影响大鼠生存以及生理功能,对进一步的深入研究造成影响[12]。采用无创办法将螺旋管置入大鼠膀胱,可最大限度的避免操作本身对大鼠模型的影响,实现模型大鼠的长期生存,因此本课题组采用与LINSENMEYER[4]、KUROSAKA[9]等相似的无创办法将异物置入大鼠膀胱内,但我们在螺旋管制作工艺上进行改进,我们使用5号注射器针头而不是18号注射器针头,增大螺旋管弧度,减少异物在膀胱内容积,减少尿潴留发生的几率。
评估啮齿类动物排尿行为的主要检测手段包括尿斑实验、膀胱测压和尿流率测定,本研究采用尿斑实验方法来评估大鼠膀胱内结石对排尿行为的影响,该方法的特点是无创、廉价且可以重复实验,实验过程中我们遵循美国国立卫生院在2015年制定的尿斑试验专家共识[13],设计尿斑实验应该具备的基本要素,目的是检测膀胱结石模型大鼠能否模拟出膀胱结石患者常见的LUTS症状,制定评价指标的依据包括动物的正向趋触性、实验目的和技术条件等因素,正向趋触性体现在老鼠通常会选定鼠笼的某个边缘区域作为安全排尿区域,在此处多次排尿,相反在鼠笼中央区域排尿被视为不正常的排尿行为[14-15]。事实上,已有多项研究通过尿斑实验评估模型动物的排尿行为,以此解释人类相关疾病所表现出来的LUTS症状[16-18],本研究选择尿斑数量、主尿斑所占尿斑面积百分比、中央区尿量百分比和总尿量等比较常用的评价指标来反映排尿情况。与健康对照组大鼠相比,模型大鼠的尿斑数量相对增多,主尿斑所占面积下降,这可以解释为膀胱内异物所致膀胱有效容积下降,排尿次数增多,每次尿量减少,同时异物带来的不适感影响到大鼠正向趋触性,大鼠在滤纸中央区出现反常的排尿行为,因此在中央区尿量所占的百分比要大于对照组。
虽然长期生存的模型大鼠能够在感染、膀胱异物附壁结石以及排尿行为等方面模拟出人类膀胱感染性结石的临床表现,但是要想成功建立一个成熟的泌尿系感染性结石动物模型仍然是一个艰巨的挑战,受限于实验动物的生理条件、实验材料及操作技术瓶颈,目前尚不能向大鼠肾脏内无创的逆向灌注细菌液,这也就决定了无法通过模型动物模拟出人类感染性肾结石所表现出来的临床症状,同时本研究也存在一些局限性,如没有通过电镜对异物表面细菌生物被膜进行观察和研究;没有通过病理HE染色对感染造成的膀胱黏膜炎症程度进行评估;也没有对改善模型大鼠并发症方面进行深入研究,这都是我们课题组未来努力的方向,但是不可否认的是本研究为探索此类动物模型做出的积极尝试,对模型大鼠在实验周期内的生理病理指标进行合理分析,能够表现出膀胱结石患者的部分症状,本实验室其后进行的类似动物实验显示动物模型稳定且具有可重复性,同时也对既往动物模型中的制作工艺提出了建设性意见。

