胶质母细胞瘤恶性亚型形成与临床相关性探讨*
艾依丁 吕超 解杨 杨永畅 徐星 金勋
胶质瘤是中枢神经系统最常见的原发性肿瘤。根据2021 年世界卫生组织(WHO)分类指南胶质瘤可分为弥漫型和非弥漫胶质瘤,其中弥漫型胶质瘤占整体的80% 左右,WHO 分级为Ⅱ~Ⅳ级[1]。弥漫型低级别胶质瘤(WHO Ⅱ级和Ⅲ级)根据肿瘤细胞形态可分为星形细胞瘤、少突胶质细胞瘤及间变型胶质细胞瘤,50%患者在手术结合辅助性放疗中获益,中位总生存期8~10 年[1]。弥漫型胶质瘤中,恶性程度最高且细胞形态上表现出高度异质性的胶质瘤称为Ⅳ级胶质瘤,又称胶质母细胞瘤(glioblastoma,GBM),其标准治疗方案是手术后放疗联合替莫唑胺(temozolomide,TMZ)化疗,但标准化治疗后的患者5 年复发率高达90%,中位生存期仅15 个月[1]。GBM 的不良预后可归因于其肿瘤微环境和肿瘤细胞自身的高度异质性导致的放化疗反应差异。探究具有放化疗抵抗性的肿瘤细胞亚群的形成规律及相关机制,对制定和优化GBM 患者的多模式治疗策略有至关重要的作用。本文将围绕放化疗抵抗性亚型肿瘤细胞的形成相关分子调控机制及微环境探讨GBM 治疗的前景。
1 GBM 的亚型异质性与可塑性
GBM 在细胞形态上表现出高度的异质性:在整体肿瘤组织的基因表达水平上可分为前神经元(proneural,PN)、经典(classical,CL)和间充质(mesenchymal,MES)3 种亚型[2]。以此为基础的转录组亚型分类一定程度上具有预测预后及恶性进展的价值。如在低级别弥漫型胶质瘤中,大部分肿瘤主要表达PN亚型特征,而在GBM 中,3 种亚型比例均衡,并且MES 亚型的患者相比于PN 亚型的患者预后差[3-4]。尽管转录组亚型对应的基因突变特点,如PN 亚型中的血小板源性生长因子受体α 多肽(platelet-derived growth factor receptors alpha,PDGFRA)扩增、CL 亚型中的表皮生长因子受体(epidermal growth factor receptor,EGFR)突变、MES 亚型中的神经纤维瘤病Ⅰ型(neurofibromatosis type Ⅰ,NF1)缺失等现象已有所报道,但在复发GBM 患者中常发生原发性肿瘤的突变基因现象,如EGFRvⅢ丢失或EGFR 减少等[5]。相应于此种突变基因的变化,复发GBM 患者中2/3 患者的基因转录谱与原发肿瘤有所不同,有证据显示大多数原发性PN 亚型GBM 患者在标准化治疗后复发时表现出MES 亚型[6],上述临床证据说明GBM 亚型的分子特征并非固定不变,而是在治疗或疾病进展过程中可能会发生亚型的可塑性变化。
目前,针对胶质瘤分子亚型可塑性变化的原因有两种解释:1)高度异质性的GBM 本身具备不同亚型的肿瘤细胞,并在放化疗等环境压力下具有耐受性的细胞存活下来形成肿瘤的主要亚型;2)GBM 中不同亚型的肿瘤细胞在放化疗等环境压力下发生了亚型转化。实际上,GBM 的大部分单细胞测序结果显示同一个患者肿瘤组织中3 种亚型肿瘤细胞共存[7-8],而富含MES 亚型肿瘤细胞的患者预后最差、对放化疗抵抗性强[9],但目前鲜见直接证据证明MES 亚型细胞本身在放化疗等环境压力下生存下来形成肿瘤的主要亚型。因此,不能排除非MES 亚型的肿瘤细胞在放化疗等环境因素的影响下发生表观遗传重组获得MES基因表达特性的可能性。事实上,在免疫缺乏鼠原位移植PN 亚型的胶质瘤干细胞(glioma stem cell,GSC)的胶质瘤模型中,经放疗后回收的肿瘤细胞其基因表达及细胞特性上表现出MES 亚型的特点,即发生前神经-间充质亚型转化(proneural-mesenchymal transition,PMT),而这种过程直接导致复发肿瘤对放化疗的高度抵抗[10]。无论MES 亚型本身在肿瘤克隆进化中占主导地位,还是非MES 亚型转化成对放化疗有抵抗性的MES 亚型,最终复发的GBM 趋向MES 亚型富集并获得放化疗抵抗性的问题是直接与临床预后密切相关的肿瘤细胞病理变化[11]。因此,深入了解MES 亚型维持及PMT 相关的分子调控机制对于完善GBM 治疗方案至关重要。
2 MES 亚型维持及转化相关的转录调控因子
在真核细胞中,基因的转录严格受控于结合DNA 转录调控区域特异性序列的转录因子及其转录调控因子。因此,特定细胞的转录谱的形成,在机制上依赖于特定的转录调控因子参与的分子机制。
2.1 C/EBPβ 和STAT3
GBM 亚型分类的根据是基因转录谱,所以早期的MES 亚型研究主要集中在寻找其特异性转录因子。针对MES 亚型特异性转录调控网络模拟的研究发现[12],C/EBPβ 和STAT3 可能对GBM 的MES 亚型转录起到重要作用,并通过功能性实验证明C/EBPβ和STAT3 的共同过表达引起的神经干细胞获得MES亚型转录谱,如YKL40、SMA、Fibronectin、CTGF、OSMR等基因和蛋白的高表达;以及C/EBPβ 和STAT3 共同降表达引起MES 亚型胶质瘤细胞低表达MES 标记基因和蛋白,如YKL40、Fibronectin、CTGF、OSMR 使胶质瘤细胞失去致癌性。基于该研究结果,其提出C/EBPβ 和STAT3 是调控GBM MES亚型特异性基因群的重要转录因子这一观点(图1A)。
2.2 TAZ
有研究在扩大候选转录调控因子前提下重复了Iavarone 团队的研究[13]。此研究发现由转录辅激活因子TAZ 与转录因子TEAD 构成的独立于C/EBPβ 和STAT3 的新MES 亚型特异性转录调控网络(图1A)[13]。在PN 亚型GBM 和低级别弥漫型胶质瘤中TAZ 启动子部位高度甲基化,证明DNA 甲基化为主的表观遗传调控机制参与GBM 亚型的维持。进一步的功能实验证明,TAZ 是MES 亚型GBM 特性维持的必要调控因子,而且通过PN 亚型GBM 和低级别弥漫型胶质瘤细胞模型中TAZ 过表达,证明了TAZ 诱导PMT 及胶质瘤恶性进展。
2.3 NF-κB
在原代PN 和MES 亚型GSC 的蛋白表达分析中,发现NF-κB 的激活态蛋白磷酸化P65(p-P65)高表达于MES 亚型GSC,并且调控TAZ、C/EBPβ 和磷酸化STAT3(p-STAT3)的蛋白质表达[10](图1A),提示NF-κB 信号通路在MES 亚型维持及PMT 中的重要性。NF-κB 作为重要的炎症相关转录调控因子不仅参与肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、CC 类趋化因子配体2(chemokine CC motif ligand 2,CCL2)、白细胞介素(interleukin,IL)-6 和IL-8等早期炎症因子的转录,并且直接调控MES 相关标记基因,如CD44、N-钙黏蛋白(N-cadherin)和波形蛋白(vimentin)的表达[10,14],而被NF-κB 转录调控的早期炎症因子以直接或间接的方式激活NF-κB 自身在内的MES 亚型的主要转录调控因子,如TAZ、C/EBPβ和STAT3,并形成多环节、多条信号通路的网络[14]。
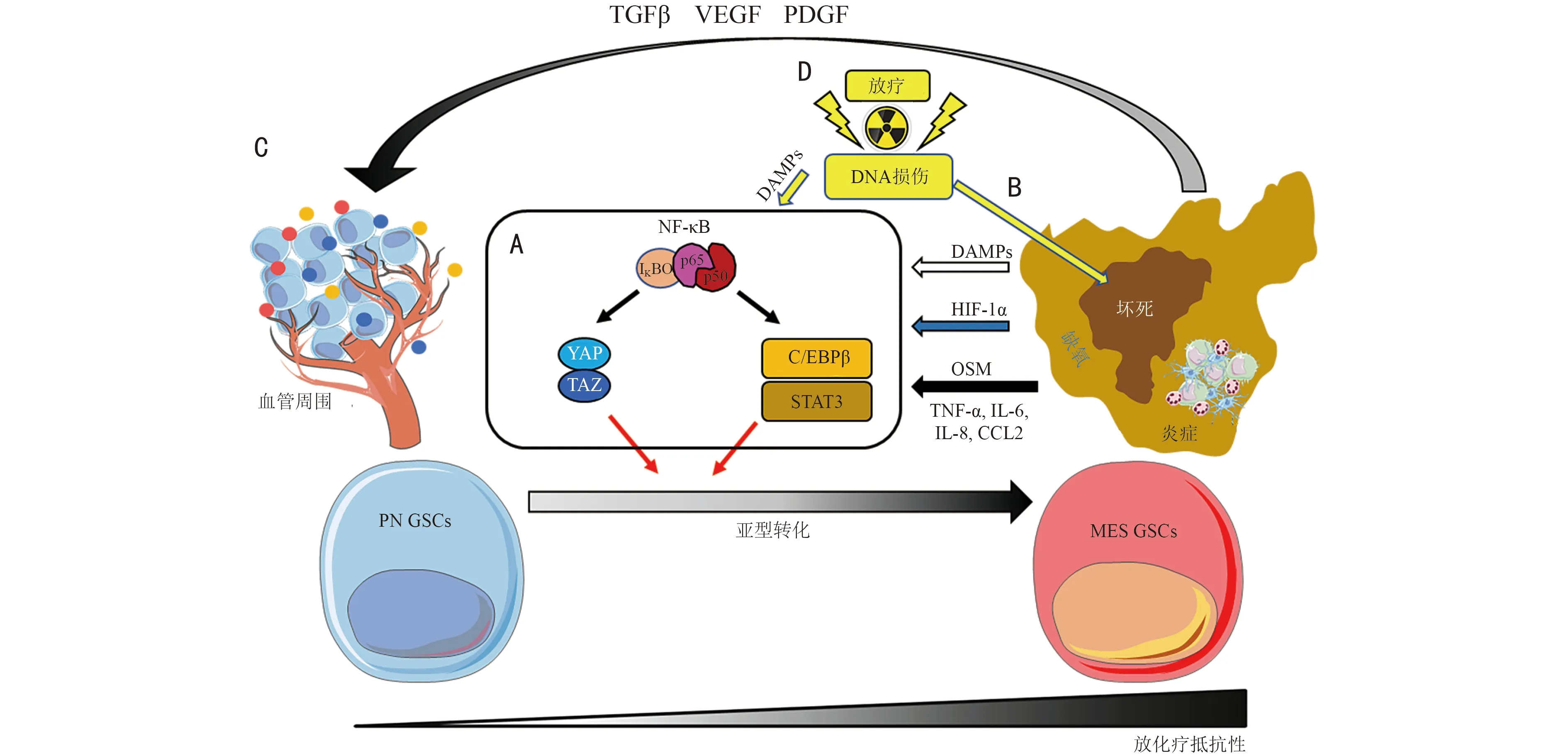
图1 GBM 恶性亚型形成机制
因此,结合GBM 患者样本实际情况分析MES亚型主要转录调控因子的激活机制,才能更好地设计针对性治疗方案。
3 肿瘤微环境与MES 亚型
GBM 病理上通常有坏死、血管增生、出血、高密度细胞群、不规则细胞核等特征,上述病理特征伴随着如氧气、酸碱度、营养素、细胞因子、基质细胞等,不同程度分布而形成肿瘤微环境。不同的肿瘤微环境影响不同GBM 亚型的转录调控因子的表达和激活,并形成不同亚型的选择性集落。本研究组的前期研究[15]结果也证实,PN 胶质瘤细胞主要分布在肿瘤血管周围,MES 胶质瘤细胞多分布在肿瘤坏死周围缺氧区。现主要围绕影响MES 亚型分布与维持相关的肿瘤微环境进行进一步的讨论。
3.1 坏死与MES 亚型
坏死是GBM 的一个代表性病理特征,是肿瘤恶性进展的标志。引起坏死的代表性原因有3 种:1)血液供应、氧气和营养素无法满足肿瘤细胞的快速增殖所需,导致局部肿瘤组织区域坏死;2)血栓引起的局部出血及后续的血液凝固,引起血栓周围细胞坏死;3)放疗引起的放射性坏死[16]。但无论何种方式引起坏死,坏死部位周围普遍伴随严重缺氧环境,并且坏死细胞或周围的应激性细胞(如衰老细胞)释放损伤相关模式分 子(damage-associated molecular pattern,DAMPs)如腺苷、高迁移率族蛋白B1(high mobility group protein B1,HMGB1)、IL-1α、透明质酸(hyaluronan,HA)等于周围微环境中。而这些DAMP 不仅参与肿瘤微环境的免疫调控,也直接参与MES 亚型转录调控因子的激活:如腺苷通过腺苷受体P2X7RB 不仅激活NF-κ 信号通路,还促进放疗后GBM 的复发[17-18];IL-1α 可通过其受体IL1R 激活NF-κB 信号通路;HMGB1和HA 可通过Toll 样受体(Toll-like receptor,TLR)-2和TLR-4 激活NF-κB 信号通路;而且HA 还可以直接结合MES 标记蛋白CD44,激活其下游信号通路,强化MES 亚型基因的表达[16]。上述潜在信号通路揭示了在坏死区周围富集MES 亚型的原因(图1A,1B)。
3.2 缺氧微环境与MES 亚型
正常脑组织氧水平在2.5%~12.5%,但在胶质瘤组织中下降至2.4%以下甚至在坏死附近达到0.1%。而在这种缺氧环境可抑制缺氧诱导因子-1α(hypoxia inducible factor-1 alpha,HIF-1α)蛋白的降解并发挥其转录活性[19]。HIF-1α 不仅可转录调控其他癌种上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)相关转录因子ZEB1 的表达,而且通过PLOD1激活NF-κB 活性态p-P65 来诱导GBM 的缺氧环境中的PMT[20](图1A,1B)。此外,本研究组前期研究[15,21]发现,缺氧环境中RNF144A 降表达改变BMI1 蛋白的稳定性,而BMI1 通过干细胞因子(stem cell factor,SCF)激活NF-κB 转录活性来增强MES 亚型GSC 在缺氧环境中的适应性。缺氧微环境还可以诱导肿瘤细胞特异性的代谢机制,如Warburg 效应,即肿瘤细胞通过Warburg 效应在有限的营养素环境中提高DNA 复制、蛋白质合成所需要的能量三磷酸腺苷(adenosine triphosphate,ATP)和前驱代谢产物产量,此过程中会产生大量的乳酸并形成酸性微环境。而肿瘤酸性微环境又可以维持MES 亚型及引起PMT 发生,并且还具有稳定HIF-1α、激活NF-κB 信号通路的作用[22]。
3.3 炎症微环境与MES 亚型
GBM 亚型转录谱的进一步深度分析显示,MES亚型肿瘤组织伴随大量的炎症相关基因的表达[23],提示MES 亚型可能伴随炎症相关免疫细胞的浸润。事实上,肿瘤坏死及缺氧部位的DAMP 的沉积及其引起的早期炎症因子,如集落刺激因子-1(colony stimulating factor-1,CSF-1)、基质细胞衍生因子-1(stromal cell-derived factor 1,SDF-1)的化学浓度梯度的形成可趋化巨噬细胞、小胶质细胞、中性粒细胞等早期炎症细胞向坏死及缺氧环境浸润,而浸润至肿瘤坏死区域的巨噬细胞在DAMP、SDF-1 等因素的影响下,由抑瘤性M1 转化成促瘤性M2 进而促进GBM 的恶性进展[17]。实际上,近期单细胞测序结果也证实MES 亚型GSC 占比高的GBM 组织中会富集巨噬细胞和小胶质细胞,而这些GBM 组织中的巨噬细胞和小胶质细胞分泌的制瘤素M(oncostatin M,OSM)通过结合肿瘤细胞白血病抑制因子受体(leukemia inhibitory factor receptor,LIFR)激活STAT3 使肿瘤细胞获得MES 亚型的特性[24]。炎性环境不但可以引起这种巨噬细胞和小胶质细胞诱导的MES 亚型转化,还可以招募巨噬细胞,使其分泌TNF-α 在诱导下通过激活NF-κB 信号通路,使PN 亚型转化成MES 亚型[4,10]。此外,DAMP 和小胶质细胞的刺激下GBM 组织中的星形胶质细胞可以转化成反应性星形胶质细胞,而这种反应性星形胶质细胞通过IL-6、IL-8 和CCL2 激活肿瘤细胞的NF-κB、C/EBPβ 和STAT3 转录调控机制,使其转化成MES 亚型并对放化疗具有抵抗性[25](图1A,1B)。
3.4 肿瘤血管形成与PMT 循环
无论肿瘤坏死、缺氧或炎症细胞的富集均可以导致大量血管形成因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子-β(transforming growth factor-beta,TGF-β)、PDGF 等分泌至周围环境,而这些因子不仅招募血管上皮细胞到其微环境中,还促进血管上皮细胞的增殖使其形成GBM特异性的微血管[26]。微血管连接至循环血管时,肿瘤细胞可通过血液获得充足的氧和营养素。而充足的氧和营养素环境抑制肿瘤细胞的坏死及缺氧区域的形成(图1C),使PN 亚型的GSC 通过以EZH2 为主的多梳抑制复合物2(polycomb repressive complex 2,PRC2)表观调控系统适应血管周围环境并形成PN 亚型区域[15]。当肿瘤血管无法供应PN 亚型肿瘤细胞增殖所需要的氧和营养素时,再次形成局部细胞坏死及缺氧环境,进而发生PMT 过程转化为MES 亚型。
综上所述,GBM 的微环境是一个动态循环变化的过程,而此过程带动GBM 不同亚型分布与转化的过程。因此,根据GBM 亚型微环境变化机制挖掘适用性微环境调控靶点是控制GBM 恶性进展的关键。
4 亚型转化与临床治疗面临巨大挑战
由于GBM 周围的新生血管异常丰富,采用抗血管生成药物(如贝伐单抗、舒尼替尼)治疗是目前治疗GBM 的另一种选择。然而,目前一项以贝伐单抗为辅助化疗药物的大型前瞻性Ⅲ期临床试验结果显示,标准治疗+贝伐单抗治疗并未改善GBM 患者的总生存期[27]。究其原因,虽然贝伐单抗的治疗对PN 亚型有一定的抑制作用,但这种治疗也导致了氧和营养素的供应不足,并局部形成缺氧及酸性等MES 微环境来激活MES 亚型转录调控机制,最终复发肿瘤呈现MES 亚型特性[28]。如前所述,TMZ 结合放疗的标准化治疗导致对放化疗有抵抗性的MES 亚型富集并形成MES 亚型复发[10]。但也不能排除放疗导致的放射性坏死释放的DAMP 参与到PMT 并引起的放化疗抵抗性(图1D)。此外,放疗引起的DNA 损伤也是GBM 亚型转化相关领域里被受关注的部分。如当肿瘤细胞暴露于辐射环境时,辐射引起的DNA 损伤可通过共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)激活NF-κB 和C/EBPβ来诱导CD109 表达,在CD109 作用下激活YAP/TAZ转录活性诱导发生PMT[14,29],但这种DNA 损伤情况下被转化的MES 亚型是否形成新的亚型克隆目前尚不清楚。当然,从GBM 亚型微环境的特异性分布和标准化治疗后的微环境变化角度来看,也可以考虑将破坏亚型微环境作为治疗GBM 的新策略。近期针对胶质瘤开发的相关巨噬细胞BACE1 信号通路抑制剂MK-8931 能够将促瘤巨噬细胞转化为对肿瘤细胞具有攻击性的抑瘤巨噬细胞[30],提示针对亚型微环境基质细胞特性转化的治疗有望改善GBM 的恶性进展。
5 结语与展望
GBM 是成人原发性恶性脑肿瘤中十分常见和极具侵袭性的,临床一线治疗平均总生存期为15 个月。一旦治疗失败,预后较差。目前批准用于挽救治疗的药物仅有贝伐单抗,其中位总生存时间为8.7~9.2 个月。贝伐单抗失败后,生存期约4 个月。因此,GBM迫切需要新的治疗方法延长生存期。
目前,虽然已经根据分子亚型的先前鉴定提出了使用个性化治疗,但研究表明GBM 可以在一种亚型和另一种亚型之间转换。此外,每个亚型均可以表达静止和增殖的细胞亚状态,这使设计新的治疗策略变得困难。同一肿瘤背景下不同细胞亚状态之间的转变也可能导致数据误解,尤其是标记物的表达与特定微环境相关时。因此,明确GBM 恶性亚型形成和转化机制,从而制定相应的治疗策略,是未来GBM 治疗的关键。

