双分子荧光互补技术在动物病毒中的研究进展
周水娟,郭忠建
江苏大学生命科学学院,江苏 镇江 212000
随着生命科学研究的不断深入,基因组信息已经无法满足人类对现有生命现象背后本质的探索,蛋白质作为生命活动的执行者,它们之间复杂的相互作用在细胞生命活动过程中起着重要的作用。在病毒感染宿主的过程中,其基因组编码的蛋白质发挥重要作用,因此,研究病毒蛋白之间或者病毒与宿主蛋白之间的相互作用对于揭示病毒感染宿主的分子机制十分重要。目前研究蛋白质间相互作用的方法有许多,如酵母双杂交技术(yeast two-hybrid system)、免疫共沉淀技术(co-immunoprecipitation,Co-IP)、pull-down技术、蛋白质片段互补分析(protein complementation assay,PCA)、荧光共振能量转移(fluorescence resonance energy transfer,FRET)试验、生物发光共振能量转移(bioluminescence resonance energy transfer,BRET)试验等。双分子荧光互补技术(bimolecular fluorescence complementation,BiFC)是近二十年来兴起的检测蛋白质相互作用的技术,已被广泛应用于可视化蛋白质互作的研究中。本文概述了BiFC技术的原理、发展、优势以及在动物病毒和抗病毒药物研究中的应用,以期为未来动物病毒致病机制的探索和抗病毒药物的研发提供参考。
1 BiFC技术
1.1 BiFC的原理
荧光蛋白两个β片层间的环状结构上有多个特异性位点可插入外源蛋白却不影响其荧光活性,BiFC可利用这一特性,在合适的位点切割荧光蛋白,形成没有荧光的N-端和C-端,分别与待研究的目标蛋白融合表达。若目标蛋白间发生相互作用,两个不完整的荧光片段则相互靠近形成完整的有活性的荧光基团,从而在激发光的激发下发出荧光(图1);反之,则无荧光。荧光信号同时也能够显示目标蛋白在活细胞中相互作用的定位。

图1 BiFC技术的原理图Fig.1 Principle of BiFC technology
1.2 BiFC技术中荧光蛋白的发展
荧光蛋白利用分裂后能够融合且不改变荧光特性的优势在BiFC技术中被广泛应用,后续又开发出以光敏色素作为荧光标记的BiFC技术。根据BiFC系统的发展历程,结合Kodama等[1]的综述总结用于BiFC的荧光蛋白和光敏色素绘制的发展进程见图2。
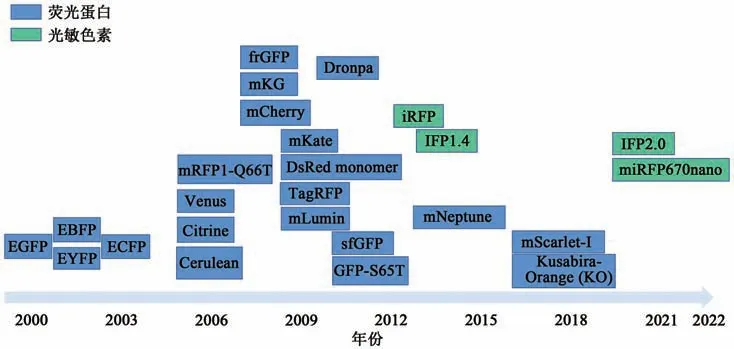
图2 BiFC技术中荧光蛋白和光敏色素发展Fig.2 The development of fluorescent proteins and photochromes in BiFC
2000年,Ghosh等[2]在体外将两个反平行的亮氨酸拉链融合到GFP的两个非荧光片段上,初步证明了GFP具有荧光互补性。随后多种荧光蛋白被应用于BiFC技术中,如GFP衍生出的增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)、增强型黄绿色荧光蛋白(enhanced yellowgreen fluorescent protein,EYFP)、增强型蓝色荧光蛋白(enhanced blue fluorescent protein,EBFP)和增强型青色荧光蛋白(enhanced cyan fluorescent protein,ECFP)[2-4]。随着GFP的发展,人们认识到GFP及其衍生变体对环境的敏感性阻碍了生理条件下BiFC的应用,因此,研究人员对荧光蛋白进行了一系列突变,生成可在生理培养条件下产生明亮信号的荧光蛋白Venus、Citrine、Cerulean[5]。随 后,绿 色荧 光亮 度 增强 的GFP变体frGFP[6]、GFP-S65T[7]被应用于BiFC。Zhou等[8]拆分sfGFP 214和sfGFP 215之间的氨基酸残基并对其进行基因突变,有效减少了荧光蛋白的假阳性现象。2008年,与GFP具有相似光谱特征的珊瑚荧光报告蛋白mKG(单体Kusabira-Green)被开发用于BiFC[9]。2010年,能够快速响应光的新型GFP样蛋白Dronpa被应用于BiFC,克服了GFP变体的光漂白和量子产率低的问题[10]。
除了绿色、青色和黄色荧光蛋白及其变体应用于BiFC外,红色荧光蛋白因其波长范围优势逐渐成为关注的对象。2006年,由单分子DsRED变体mRFP1突变形成的mRFP1-Q66T被应用于BiFC[11],随 后,基 于mCherry的BiFC系 统 被 开发[12],但这两种红色荧光蛋白只能在相对较低的温度下工作,限制了BiFC在活体哺乳动物细胞中的应用。为此,2009年Chu等[13]首次将mKate应用于更高温度下基于红色荧光蛋白的BiFC系统。同年,为改善红色荧光蛋白的温度敏感性及荧光强度,mKate-S158A变体mLumin[13]和TagRFP[14]被应用于BiFC中。2014年,由mKate进一步突变生成的首个激发峰值达到600 nm的明亮荧光蛋白Neptune[15]被应用于BiFC。2018年,新开发的红色荧光蛋白mScarlet-I[16]、Kusabira-Orange(KO)[17]在BiFC上得以应用,进一步优化了荧光蛋白的特性。
与类GFP蛋白不同,光敏色素是细菌或植物中一种可吸收红光和近红外光的光受体[18]。2013年,基于细菌光敏色素的近红外荧光蛋白iRFP(infra-red fluorescent protein)首 次 应 用 于BiFC系统[19-20]。随后,IFP1.4也被应用于BiFC[21],但它和iRFP的荧光强度均不高。2021年,开发了一种改进的单体近红外细菌光敏色素IFP2.0,增加了BiFC的信号强度[22]。同年,Chen等[23]开发了基于蓝细菌色素的最小近红外荧光互补系统—miRFP670nano,拓展了BiFC检测的波长范围,为其广泛应用奠定了基础。
1.3 BiFC技术的优势
BiFC技术具有多个优点,使其在众多研究蛋白质相互作用的方法中脱颖而出。第一,简易性和直观性。报告基因的固有荧光使蛋白质互作直接可视化而不依赖于二次检测,因此只需配备荧光显微镜便可对相互作用的蛋白进行成像分析,且能够直观反映互作在细胞中的定位。同时,荧光强度也可反映BiFC中两个互作蛋白间的相互作用强度[24-25]。第二,BiFC技术可使蛋白间的相互作用在活细胞中可视化,省去了裂解或者固定细胞等繁琐实验步骤且可以消除其带来的潜在影响。第三,复合物的形成比较稳定,可用于研究蛋白质间微弱或瞬时的相互作用[24-25]。第四,蛋白质在正常的细胞环境中表达,无需添加具有细胞毒性或扰乱细胞稳态的外源性底物[26],其效果可与内源性蛋白相媲美,几乎可反映天然蛋白质的性质,包括翻译后修饰的影响。第五,多种蛋白质间相互作用可以使用光谱不同的荧光复合物并行可视化,即多色BiFC分析[27]。BiFC技术的优势使其成为检测蛋白质相互作用的强大工具。
2 BiFC在动物病毒研究中的应用
BiFC几乎适用于除专性厌氧生物外的各种细胞类型,加之简单、快捷、灵敏且对细胞无侵害的特点,为BiFC的广泛应用提供了基础。动物病毒是一种寄生在人体或动物体内,能引起人和动物疾病的强感染因子,在病毒入侵、增殖和传播过程中,其依靠宿主编码的蛋白质发挥各项功能。利用BiFC技术研究动物病毒侵染宿主过程中蛋白质之间的相互作用关系,对于探索动物病毒与宿主间的相互作用,理解动物病毒的生命周期,进一步阐述其致病机制乃至设计与研发相关药物和抑制剂都至关重要。
2.1 人类免疫缺陷病毒(human immunodeficiency virus,HIV)
HIV是一种攻击T淋巴细胞的逆转录病毒,根据血清学反应和病毒核酸序列测定可分为人类免疫缺陷病毒1型(HIV-1)和2型(HIV-2)两种,其中HIV-1流行范围更广,研究也更加深入。HIV-I整合酶(HIV integrase,IN)是病毒将DNA整合到宿主基因中必不可少的病毒蛋白,这一过程通常需要将IN转运至细胞核。2009年,Levin等[28]利用BiFC技术证实IN和importinα存在相互作用,表明IN的核输入通过importinα途径发生。随着对IN入核机制的深入研究,Chen等[29]利用以光敏色素iRFP为荧光标记的BiFC系统,可视化IN和人类晶状体上皮衍生生长因子p75(LEDGF/p75)的相互作用,LEDGF/p75能够辅助IN入核并且将其靶向宿主染色质[30-31]。随后Nakamura等[32]利用引入5个突变的Venus-BiFC系统进一步阐明,多聚化的IN仍能与LEDGF/p75相互作用,进而帮助HIV病毒将DNA整合到宿主染色体DNA中[33]。
作为HIV-1的辅助因子,负调控因子(negative factor,Nef)与HIV的发病机制密切相关。先前的生化及结构研究发现,多数Nef功能的发挥需要其发生二聚化或者寡聚化[34-35]。直到2009年Poe等[36]的研究证实了这一发现,他们利用BiFC验证HIV感染宿主后,细胞内Nef呈现二聚体形式。后续有研究利用BiFC证明Nef形成二聚体后可与IL-2诱导T细胞激酶(interleukin-2-inducible T-cell kinase,Itk)和布鲁顿酪氨酸激酶(bruton tyrosine kinase,Btk)两种Tec家族激酶相互作用,将Itk和Btk募集到细胞膜,越过正常免疫受体对Tec家族激酶活性的控制,自磷酸化直接激活组成型激酶[37],导致病毒转录增强(图3)。2020年,Staudt等[38]利用BiFC检测到二聚化后Nef的一个单体可能与丝氨酸结合子5(SERINC5)接触,另一个与衔接蛋白-2(adaptin-2,AP-2)接合,形成Nef-SERINC5-AP-2复合物,在网格蛋白介导的内吞作用下下调SERINC5,这与BiFC检测出的CD4下调机制类似[39]。SERINC5和CD4均可阻止病毒进入宿主细胞,其下调增强了HIV-1的传染性且有助于HIV逃避宿主免疫系统的捕捉。
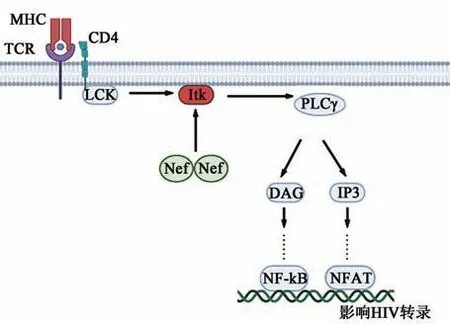
图3 Nef二聚体与Itk相互作用激活模型[37]Fig.3 Models of Nef-dimer mediated Itk activation[37]
除了可视化Nef自身发生的二聚化外,BiFC还用于研究Nef与多种宿主蛋白间的相互作用,如Nef和磷酸弗林蛋白酶酸性氨基酸簇选蛋白(phosphofurin acidic cluster sortingprotein,PACS)的相互作用破坏了宿主细胞内信号传导和膜运输,引起细胞表面主要组织相容性复合物I类(MHC-I)下调,从而导致病毒逃离免疫监视[40]。Nef和宿主细胞膜运输调节蛋白SNX18的互作参与调节宿主细胞内囊泡运输,也可使病毒逃避宿主的免疫监测[41]。最新研究发现,Nef与T细胞免疫球蛋白粘蛋白3(T cell immunoglobulin and mucin-containing molecule 3,Tim-3)形成复合物,促进Tim-3从细胞表面脱落[42],导致受感染T细胞表面检查点受体水平上调,加速T细胞的衰竭。
此外,BiFC还检测到HIV感染时其他重要蛋白间的相互作用,如Env糖蛋白间相互作用及其与SERINC5的相互作用[43],HIV-1辅助蛋白Vpu与Tim-3的相互作用[44],HIV-1主要结构蛋白Gag之间以及Gag和协调RNA干扰的宿主蛋白AGO2之间的相互作用[45]。这些相互作用的发现和验证,不仅为研究HIV感染宿主细胞的过程和分子机制提供了新见解,也为靶向抗病毒抑制剂的研发奠定了理论基础。
2.2 疱疹病毒
疱疹病毒主要分为α、β和γ三大类。其中单纯疱疹病毒是疱疹病毒的典型代表,属于α疱疹病毒,分为1和2两种血清型。单纯疱疹病毒进入细胞需要gB、gD、gH和gL 4种糖蛋白参与。Atanasiu等[46]利用BiFC对gD和gB以及gD和gH/gL之间的相互作用进行验证,首次检测出gD与其受体的结合可触发gB和gH/gL之间的相互作用,这一结论也被Avitabile等[47]证实。在单纯疱疹病毒1型(HSV-1)中,Hernandez等[48-49]发现感染细胞蛋白(infected-cell protein 27,ICP27)能够以头对尾的形式发生分子内相互作用,将ICP27锁定在封闭结构中。基于BiFC的FRET表明在其C端和N端完好无损的前提下,ICP27能与细胞mRNA输出受体蛋白TAP/NXF1发生相互作用[50],有利于对病毒感染机制的理解。Guo等[51]利用BiFC证实HSV-1刺激相关基因1蛋白(HSV-1 stimulation related gene 1,HSRG1)与SV40转化蛋白大T抗原(LT)有相互作用,进而改变LT对SV40启动子的调节,并影响细胞周期,这一相互作用的发现表明宿主可能存在一种未知的先天抗病毒机制。
人类疱疹病毒4型又称EB病毒(epstein-Barr virus,EBV),是一种能感染人的疱疹病毒,可潜伏感染B淋巴细胞并使其永生化。潜伏膜蛋白1(latent membrane protein 1,LMP1)是B细胞转化所必需的,可诱导多种信号通路改变细胞环境,常在与EB病毒相关的癌症中检测到,因此被称为EB病毒的癌基因[52]。Talaty等[53]利用BiFC技术证明LMP1能够自组装,且与肿瘤坏死因子受体相关因子TRAF2、TRAF3互作产生的荧光定位于细胞的核周和膜区域。Alaty等[54]通过BiFC技术筛选鉴定了一种新的LMP1结合蛋白——跨膜蛋白134(transmembrane protein 134,Tmem134),其与LMP1相互作用会影响LMP1诱导的NF-κB活性。2015年,Holthusen等[55]利用BiFC鉴定了多种肌动蛋白细胞骨架相关蛋白与LMP1互作且定位于脂筏结构域。这些相互作用的发现为寻找有效治疗EB病毒相关恶性肿瘤的靶点奠定了基础。
此外,BiFC技术还被用于测定伪狂犬病毒[56]和鸭肠炎病毒[57-58]等疱疹病毒感染时相关蛋白间的相互作用。BiFC技术在疱疹病毒研究中的应用不仅有助于探究各种疱疹病毒蛋白的功能及其在病毒感染过程中发挥的作用,更有助于进一步了解疱疹病毒感染及其发病机制。
2.3 流感病毒
流感病毒可引起人和禽类、猪、马等多种动物感染和发病,通常分为甲、乙、丙三型,其RNA聚合酶复合物是病毒基因组转录和复制所必需的,由PA、PB1和PB2亚基组成。其中,核心亚基PB1通过与PA和PB2相互作用,将PA和PB2整合到聚合酶复合物中[59],但并未发现PA和PB2亚基之间的相互作用。Hemerka等[60]利用BiFC技术除验证PA-PB1和PB1-PB2之间的相互作用外,首次检测出PA的N端和PB2存在相互作用,且定位于细胞质。Suzuki等[61]结合BiFC与光栅图像相关光谱(raster image correlation spectroscopy,RICS),发现PA与PB1结合后PA其C端诱导细胞质中三聚体聚合酶复合物的异常形成;相反,PA的N端可抑制这一异常形成,将三聚体聚合酶复合物转运至细胞核中,调控三聚体聚合酶复合体的正确形成。此外,PA、PB1、PB2还可分别和视黄酸诱导基因Ⅰ蛋白(retinoic acid-inducible gene-Ⅰ,RIGⅠ)相互作用,其中PB1-RIGⅠ和PA-RIGⅠ相互作用产生的BiFC信号主要分布在细胞质,而PB2-RIGⅠ相互作用产生的信号主要在细胞核中[62],这表明RIGⅠ具有抑制病毒RNA聚合酶的活性。
总之,在流感病毒蛋白互作的研究中,BiFC技术主要集中于可视化流感病毒RNA聚合酶复合物亚基间的相互作用和入核过程,验证聚合酶复合体的正确形成与病毒基因的转录和复制相关,进而阐述相关的抗病毒机制。
2.4 其他病毒
除了上述三种常见的病毒外,BiFC还被应用于其他病毒的相关研究中。如人类中丙型肝炎病毒的非结构蛋白NS4B与干扰素刺激蛋白STING[63]特异性结合的可视化;人乳头瘤病毒(human papillomavirus,HPV)的包膜蛋白(E2)和细胞溴结构域蛋白4(Brd4)的相互作用验证[64];视黄酸诱导基因Ⅰ蛋白(RIG-Ⅰ)与三基序蛋白25(TRIM25)、线粒体抗病毒信号蛋白MAVS之间形成的不同复合物及其空间定位的可视化[65]。其他动物中,鸡贫血病毒非结构蛋白VP2和凋亡相关蛋白Apoptin之间的相互作用,使Apoptin Thr108去磷酸化,从而减弱由Apoptin触发的细胞凋亡,促进病毒繁殖[66];猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的跨膜非结构蛋白相互作用网络可视化,可为未来研究转录复合物的形成和功能提供有价值的线索[67];猪Mx1蛋白与猪瘟病毒非结构蛋白NS5B的相互作用抑制了猪瘟病毒的复制[68];可视化家蚕的细胞分裂周期蛋白37(BmCdc37)与家蚕热休克蛋白(BmHsp90)的相互作用[69],以及家蚕细胞的紧密连接蛋白(Claudin-2)与家蚕质多角体病毒结构蛋白VP7的相互作用[70],提供了与病毒感染相关机制的新见解。对于新型冠状病毒(简称新冠病毒,SARS-CoV-2),Chen等[71]利用BiFC可视化了22种SARS-CoV-2结构蛋白和辅助蛋白的相互作用,揭示了核衣壳蛋白在病毒样颗粒组装中的关键作用,同时,SARS-CoV-2的核衣壳蛋白还与活细胞中细胞应激颗粒蛋白CSNK2B、G3BP1和G3BP2相互作用,下调颗粒蛋白G3BP1的表达水平[24],揭示SARSCoV-2可能通过核衣壳蛋白和应激颗粒蛋白之间的相互作用来逃脱宿主的清除。
总而言之,BiFC技术可对这些相互作用及其作用区域进行可视化,有助于理解病毒感染机制,进而深入研究抗病毒机制。
2.5 BiFC在抗病毒研究方面的应用
蛋白质-蛋白质相互作用在病毒感染宿主的过程中起关键作用,因此通过破坏或阻碍蛋白质-蛋白质相互作用来抑制病毒感染已成为一种前景广阔的抗病毒药物开发策略,而BiFC技术的可视化为活细胞抗病毒药物的评估提供了一种新思路。
HIV感染引起的宿主获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)是一种危害性较大的传染性疾病,治疗难度极大。Emert-Sedlak等[72]通过BiFC发现一种独特的二苯基吡唑化合物,可直接与Nef结合从而阻断Nef二聚化,有效地抑制了HIV-1活性。HIV-1整合酶IN与细胞辅助因子蛋白LEDGF/p75相互作用是一个重要的抗病毒靶点[73]。Chen等[29]通过分裂光敏色素iRFP构建BiFC系统,发现化合物6(compound 6)和卡比多巴(Carbidopa)可抑制IN-LEDGF/p75间的相互作用且成剂量依赖型,能够有效地阻碍病毒DNA整合到宿主基因上。Zhang等[43]利用BiFC发现SERINC5与HIV-1 Env蛋白的相互作用选择性地解离Env三聚体以限制HIV-1复制,为SERINC5的抗病毒活性提供了依据。
对流感病毒的研究发现,可通过抑制自噬进而抑制甲型流感病毒的复制[74]。LC3-II是自噬体形成所必需的,而Atg5-Atg12/Atg16异三聚体能促进LC3-I转化形成LC3-II,Dai等[75]利用BiFCFRET技术发现吴茱萸碱可抑制Atg5-Atg12/Atg16异三聚体的形成,从而对流感病毒的复制起抑制作用。Beclin 1作为自噬的调节因子,已被证明是多种病毒操纵的重要靶点[76]。B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白是一种与Beclin 1相互作用的自噬抑制剂,而Beclin1作用的发挥必须从Beclin1/Bcl2异源二聚体中解离。Dai等[77]基于BiFC技术鉴定出能够抑制Beclin1-Bcl2解离的药物丁香酚,同时,证实原花青素既可以抑制Atg5-Atg12/Atg16异源三聚体的形成又能抑制Beclin1/Bcl2异源二聚体的解离[78],为开发新型抗甲型流感病毒药物提供了思路。
近几年BiFC技术在抗病毒研究方面有了新的进展。Yu等[79]通过BiFC揭示了膜相关RINGCH型8(membrane-associated RING-CH 8,MARCH8)具有广泛的抗病毒活性:通过与不同病毒融合蛋白相互作用将其滞留在高尔基体中,进而抑制其从高尔基体向质膜运输以及与病毒粒子的结合。Wei等[80]利用BiFC鉴定了一种源自噬菌体展示肽库的肽——P1,它能够与日本脑炎病毒(Japanese encephalitis virus,JEV)的囊膜蛋白相互作用并阻止病毒入侵细胞,具有抗JEV感染的潜力。Huang等[81]发现化合物B7可以阻断PRRSV糖蛋白与巨噬细胞特异性表面受体CD163的相互作用,从而预防PRRSV感染。化合物Ⅱ-2-9也被BiFC技术证实能够干扰乙型肝炎病毒(hepatitis B virus,HBV)衣壳蛋白的相互作用,从而抑制HBV衣壳的组装,有助于开发新型抗HBV药物[82]。
BiFC在致病性病毒蛋白互作研究中的应用总结于表1。一直以来,由病毒引起的各种疾病威胁着全球人类的健康与生活,尽管疫苗的使用有效地预防和控制了疾病的发生和流行,但任何疫苗都需要时间才能发挥作用且无法完全预防病毒,机体依旧面临被感染的风险,因此抗病毒药物的研发尤为重要。BiFC技术将抗病毒药物的效果在活细胞中以可视化的途径展现,有利于抗病毒药物的筛选与评估,为开发新型药物提供便利。
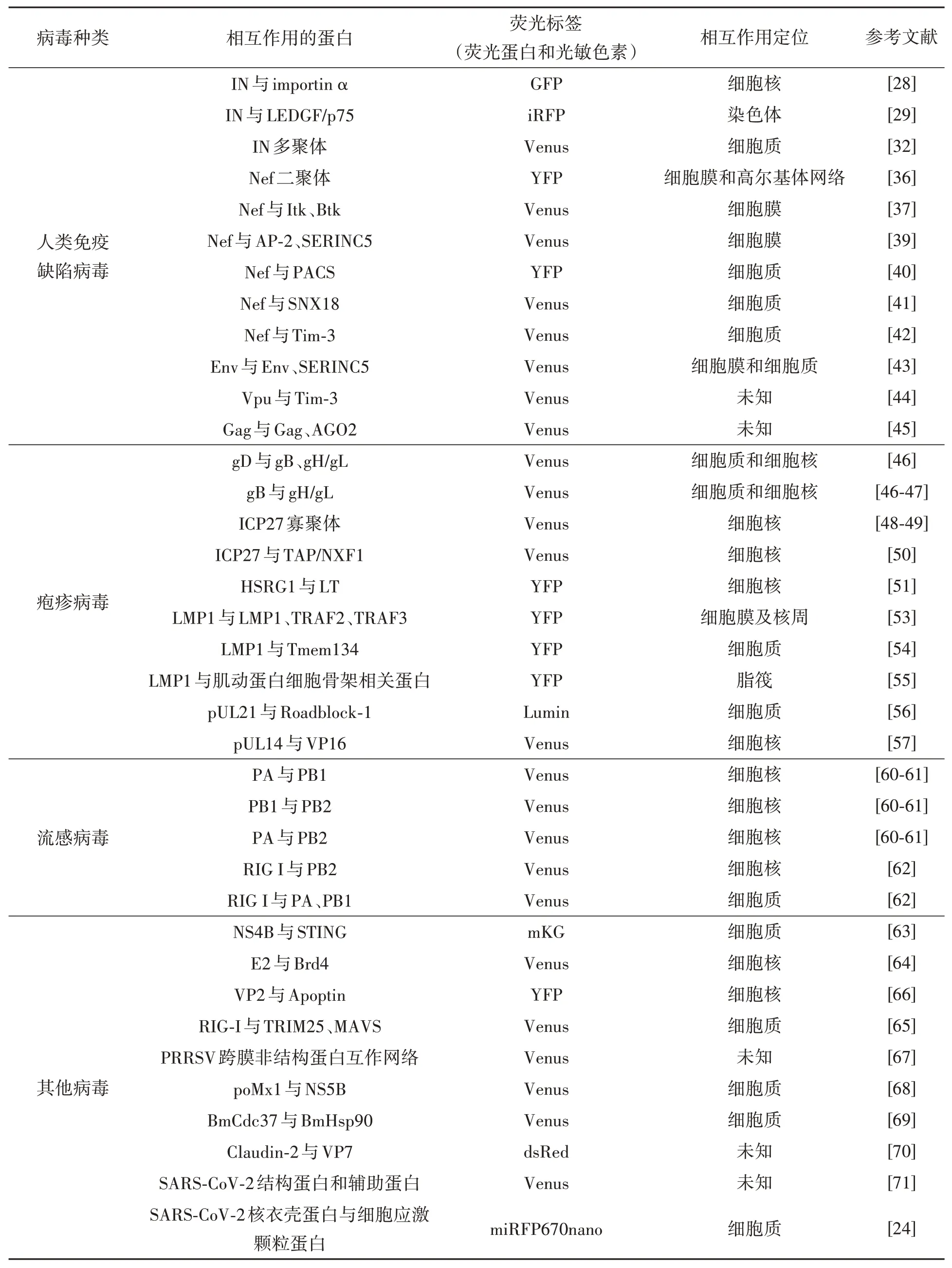
表1 BiFC在致病性病毒蛋白互作研究中的应用Table 1 Application of BiFC in the study of proteins interaction of pathogenic viruses
3 新型BiFC系统的开发与应用
3.1 BAC-BiFC系统
BiFC技术虽被广泛使用,但大量证据表明在目标蛋白不发生相互作用的情况下,两个非荧光片段也可能由于随机碰撞而自组装成完整的荧光蛋白,产生假阳性信号,进而限制了BiFC技术对目标蛋白相互作用的定量研究。为了克服这一问题,Mao等[45]开发了一种能够检测并消除假阳性信号的方法,并将其命名为BAC-BiFC(background assessable and correctable-bimolecular fluorescence complementation)。其原理是在BiFC中一个目标蛋白连接一个参考荧光蛋白,参考荧光蛋白可用来表征目标蛋白在细胞内的表达水平与空间分布,还可通过比率判断不同蛋白表达水平下假阳性信号的强弱,从而获得不受假阳性信号干扰的实验条件(图4)。该系统目前不仅在HIV-1结构蛋白Gag之间的相互作用中应用,还可将BAC-BiFC与其他成像方法(例如荧光共振能量转移)相结合,以研究多种蛋白质之间的相互作用;或与RNA标记系统相结合,研究蛋白质与RNA的相互作用。BAC-BiFC的灵活性,使其成为一种通用且可靠的方法,用于研究各种细胞和病理环境中的生物分子相互作用。
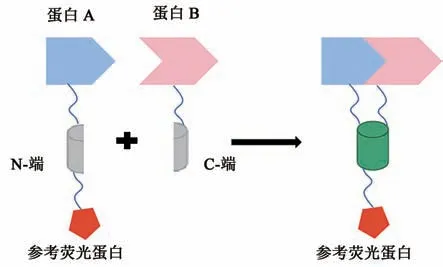
图4 BAC-BiFC用于PPI成像的工作原理[45]Fig.4 Working principle of BAC-BiFC for PPI imaging[45]
3.2 tBiFC系统
Chen等[22]以近红外光敏色素蛋白IFP 2.0为材料,通过串联构建的方式,发展了荧光互补效率显著提高的近红外串联荧光互补系统(tandem near-infrared fluorescence complementation system,tBiFC),将目标蛋白串联两个IFP 2.0分裂片段,以达到增强荧光信号的目的(图5)。该系统目前并未在病毒中应用,但其增强荧光信号强度的特点为病毒感染过程中相关蛋白质互作的研究提供了一种强有力的工具。此外,串联构建方法也可引入其他标签蛋白,以解决互补荧光强度弱的问题。
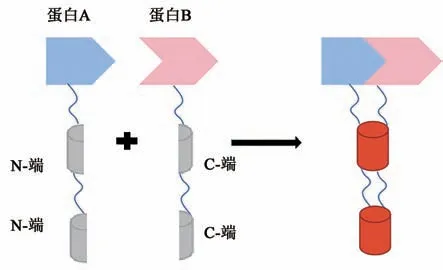
图5 tBiFC用于PPI成像的工作原理[22]Fig.5 Working principle of tBiFC for PPI imaging[22]
3.3 TagBiFC技术
许多研究表明荧光蛋白具有亮度低、光稳定性差、易漂白和多聚化等缺点,近期发展起来的自连接标签蛋白(self-labeling tags)可结合染料,同时能以融合蛋白的形式在活细胞内表达,成为取代荧光蛋白的材料。Shao等[83]开发了基于自连接标签HaloTag的TagBiFC技术,其可在细胞内单分子层次追踪发生互作的两个转录因子及转录因子与染色质结合的动态过程。TagBiFC能够克服使用荧光蛋白的BiFC缺点,扩展BiFC现有的工具包,并且在单分子和超高分辨水平追踪蛋白相互作用,为有关相互作用提供更多细节信息。
与传统的BiFC相比,新型BiFC系统完善了许多BiFC的不足,展现出优越的相互作用可视化性能,但在动物病毒相关的研究中暂未普及。因此,BiFC技术不断的改良与发展,新型BiFC系统的开发与应用,将为日后病毒感染过程中蛋白质相互作用的研究以及抗病毒药物的研发提供新的方法。
4 展望
BiFC已成为可视化活细胞中相互作用的标准实验方法,从蛋白质-蛋白质相互作用到蛋白质的构象[84-85]、蛋白质和RNA之间的相互作用[23,86-88]的应用,从多色荧光互补技术[27]到与其他技术如荧光共振能量转移[89]、流式细胞术[90]的联用,都体现了BiFC广泛的应用前景。本文阐述了BiFC的原理、发展、优势以及在典型的动物病毒和抗病毒药物评估中的应用,并对近年来提出的新型BiFC系统原理进行阐述。在病毒感染宿主的过程中,不仅病毒会侵染宿主,宿主也会对病毒做出抵御反应,因此利用BiFC了解病毒以及病毒与宿主之间的相互作用,对于病毒致病机制、宿主的抗病毒机制以及抗病毒药物的研究至关重要。尤其是在新型冠状病毒肺炎(corona virus disease 2019,COVID-19)全球大流行的当下,通过成熟而便捷的BiFC技术,有望对新冠病毒等严重致病性病毒中的蛋白质互作网络进行探究,进一步解析病毒感染机制,靶向抗病毒药物的筛选。
然而,在应用BiFC技术时仍然存在一些问题有待解决和改善。比如,分裂荧光片段能够随机碰撞和自我组装产生荧光造成假阳性,特别是在浓度较高的情况下;由于荧光蛋白在重组后并不能够重新分开,这种不可逆性限制了可逆的蛋白质互作研究;观察到的荧光信号滞后于蛋白质的相互作用,不能实时地反映相互作用过程;荧光蛋白的高灵敏性带来的高背景等。因此,除了使用对照和引入突变来规避假阳性和消除高背景外,有必要持续开发出新的荧光标签、新的与其他技术相关联的BiFC系统以及可逆的BiFC系统,继而为病毒和病毒造成的疾病研究提供新的思路。

