通过荧光标记的凝胶阻滞技术分析Opaque2蛋白与ZmGRAS11启动子的结合位点
朱佳梦,江海洋,陈茹梅,周晓今*
1.安徽农业大学生命科学学院,合肥 230000;
2.中国农业科学院生物技术研究所,北京 100081
凝胶阻滞实验(electrophoretic mobility shift assay, EMSA),或称凝胶电泳迁移率实验,是一种广泛应用于蛋白质与核酸结合的实验技术,可对核酸序列特异性结合蛋白进行定性与定量分析。20世纪80年代,凝胶阻滞实验首次应用在体外研究蛋白与DNA结合[1-4],之后几经发展,逐渐被应用于蛋白与RNA结合的研究中[5-7]。其中,最早在EMSA实验中使用的是放射性同位素标记探针,常用的放射性核素有32P、3H和35S等[8-9],但是放射性同位素存在辐射危害,并且有半衰期限制和放射性自显影检测时间长等不足,所以放射性同位素标记探针的方式逐渐被其他标记方式所替代。近年来EMSA实验多使用生物素标记探针[10-12],生物素标记在进行蛋白与探针结合前需要使用试剂盒标记探针,在电泳结束后还需要进行转膜和免疫反应,然后才能进行发光检测,实验整体耗时较长。荧光标记探针相较于放射性同位素标记更安全,并且相比生物素标记更加简便和高效,但荧光探针存在价格高和易聚集等问题。
Opaque2(O2)是种子发育过程中调控贮藏物质积累的关键转录因子[13],它可直接或间接与其他蛋白质相互作用,调节zein基因的表达[14-16]。同时O2作为核心因子,通过转录激活蔗糖合成酶基因Sh1、Sus1和Sus2的表达,增加胚乳灌浆期间蛋白质和淀粉合成的代谢源[17-18]。因此,O2蛋白通过影响醇溶蛋白和氮、碳代谢,在玉米胚乳发育过程中发挥关键作用。ZmGRAS11是GRAS家族的一个转录调控因子,其表达由O2直接调控在胚乳灌浆过程中促进细胞扩张,正向调控玉米籽粒的增大[19]。本实验主要使用荧光标记探针,通过EMSA实验探究O2与ZmGRAS11启动子的结合位点,为深入理解O2-Zm-GRAS11转录调控模块的作用机理提供依据,同时探索荧光标记法EMSA的可行性与便利性。
1 材料与方法
1.1 材料
1.1.1 试验材料KOD one Mix购自东洋纺公司;限制性内切酶、Infusion克隆试剂盒购自赛默飞公司;大肠杆菌Fast-T1化学感受态细胞购自诺唯赞公司;Rosetta(DE3)Competent Cell购自康为世纪公司;不含EDTA的cOmpleteTMMini蛋白酶抑制剂混合物购自Roche公司;Ni-NTA Agarose购自天根公司;无填料层析柱购自纽英伦生物技术有限公司;Amicon®Ultra-15离心过滤装置购自默克公司;PAGE凝胶快速制备试剂盒(10%)购自上海雅酶生物医药科技有限公司;Bradford法蛋白浓度测定试剂盒购自索莱宝公司;30%Acr-Bis(29∶1)、Ammonium persulfate substitute(APS substitute)、TEMED、5×EMSA/Gel-Shift结合缓冲液、10×EMSA/Gel-Shift上样缓冲液(无色)购自碧云天公司;5'端FAM荧光标记DNA探针、普通单链探针购自北京博迈德基因技术有限公司。
1.1.2 试验试剂及配方1 mol·L-1IPTG、裂解缓冲液、洗杂缓冲液、洗脱缓冲液、1×置换缓冲液、5×TBE缓冲液的配方见表1。
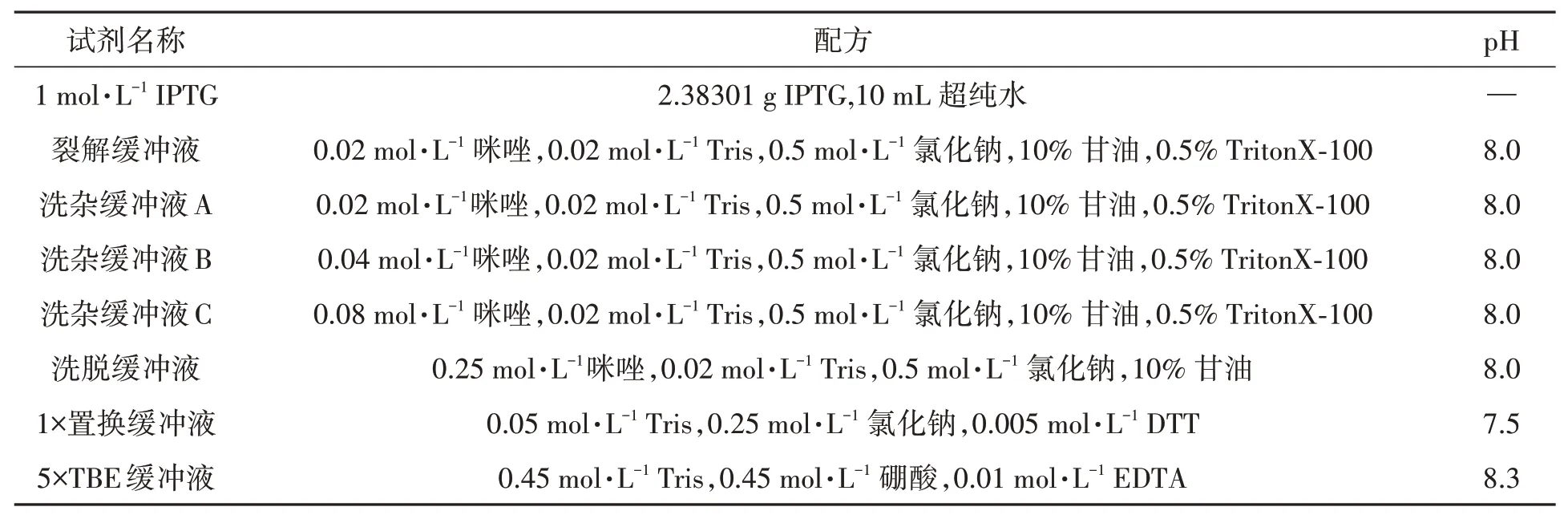
表1 实验所用到的试剂配方Table 1 Formulation of reagent used in this study
1.1.3 试验仪器PCR仪、琼脂糖凝胶电泳槽、Mini P-4小型垂直电泳槽、紫外可见分光光度计、恒温摇床、离心机、超声破碎仪、多功能微孔板检测仪、Tanon 5200 Multi多功能成像系统。
1.2 方法
1.2.1 pET28a-O2原核表达载体的构建EcoRⅠ和XhoⅠ双酶切pET28a载体,PCR获得O2开放阅读框,引物:F-5'-TCGCGGATCCGAATTCATGCCGC CGACGACCC-3';R-5'-GGTGGTGGTGCTCGAGATACAT GTCCATGTGTATGGCCC-3',酶 切 产 物 与PCR产 物进行琼脂糖凝胶电泳检测,切胶回收,利用Infusion克隆试剂盒重组获得质粒pET28a-Opaque2(图1)。
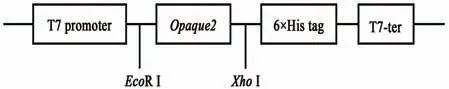
图1 pET28a-Opaque2原核表达载体构建示意图Fig.1 Construction of pET28a-Opaque2 prokaryotic expression vector
将重组质粒转化大肠杆菌Fast-T1化学感受态细胞,提取质粒双酶切鉴定后,送往北京博迈德基因技术有限公司测序。鉴定测序结果正确后,将质粒转化Rosetta(DE3)competent cell,在菌液中加入甘油保存于-80℃,即可短期使用进行蛋白诱导表达。
1.2.2 O2蛋白诱导条件的优化pET28a-O2菌液在摇床中培养至OD600=0.5时,将菌液等体积分装到试管a~f中,分别加入不同体积的IPTG,16℃,150 r·min-1摇床培养诱导表达16 h,然后12 000 r·min-1离心收集菌体(表2)。利用SDSPAGE观察不同浓度IPTG的诱导效果。
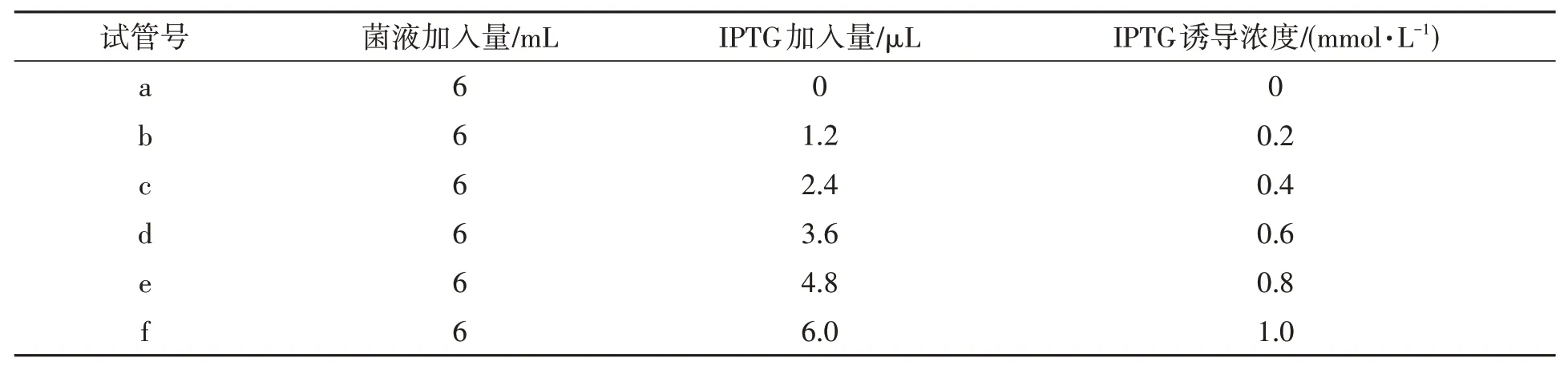
表2 IPTG诱导浓度的优化条件Table 2 Optimization of IPTG concentration for recombinant protein expression
1.2.3 O2蛋白纯化将菌液培养至OD600=0.5,使用最佳诱导浓度1.0 mmol·L-1的IPTG诱导表达,16℃,150 r·min-1摇床培养16 h,收集菌体。加入裂解缓冲液和蛋白酶抑制剂重悬菌体,超声破碎后离心保留上清,即获得粗蛋白液。将粗蛋白液加入镍柱中,含有His标签的O2蛋白可与Ni2+结合,然后加入5倍柱体积的洗杂缓冲液洗去杂蛋白,最后加入洗脱缓冲液洗脱获得目的蛋白。将目的蛋白溶液加入超滤柱(Amicon Ultra-15离心过滤器)浓缩,同时使用置换缓冲液除去咪唑,获得的高浓度纯化蛋白进行SDS-PAGE,以确定O2蛋白纯化效果。
1.2.4 O2蛋白浓度的测定根据Bradford法蛋白浓度测定试剂盒操作说明,绘制蛋白标准品浓度与OD值的标准曲线,根据标准曲线计算出样品中的蛋白浓度。
1.2.5ZmGRAS11启动子探针制备用超纯水将单链探针稀释至200μmol·L-1(表3),分别取等量的上下游探针混匀,使用PCR仪进行聚合。退火后FAM标记的双链探针需要进一步稀释至10μmol·L-1工作浓度,用于竞争的探针不需要稀释直接配置为n×母液。稀释后的标记探针需要用黑袋子包裹后-20℃保存。

表3 ZmGRAS11探针聚合所用引物Table 3 Probes in the ZmGRAS11 promoter
1.2.6 6% TBE凝胶的制备及预电泳配置6%TBE凝胶:5×TBE 1 mL,30%丙烯酰胺/甲叉双丙烯酰胺(Acr-Bis)溶液2 mL,50%甘油0.5 mL,超纯水6.44 mL,10%丙烯酰胺凝胶聚合催化剂(APS)50μL,N,N,N′,N′-四 甲 基 乙 二 胺(TEMED)10μL。将6%TBE灌入胶板中,室温放置30 min待TBE凝胶完全凝固后开始预电泳,4℃,100 V,电泳1 h,电泳缓冲液为预冷的0.5×TBE缓冲液。
1.2.7 检测不同蛋白与探针的比例对EMSA实验的影响为测定O2蛋白与ZmGRAS11启动子探针相互作用的最佳浓度,用不同浓度的O2蛋白与FAM荧光标记的ZmGRAS11启动子探针进行EMSA实验,各个泳道标记探针的浓度为10μmol·L-1,根据凝胶阻滞实验的反应条件,每个泳道的反应体系按表4加入相应试剂。

表4 不同蛋白与探针的比例设置Table 4 Different treatments of protein to probe ratio
1.2.8 检测不同突变方式的竞争探针对EMSA实验的影响各个泳道标记探针的浓度为10μmol·L-1,竞争探针的浓度为200μmol·L-1,根据凝胶阻滞实验的反应条件,每个泳道的反应体系按照表5加入相应试剂混匀,室温下孵育20 min。然后分别加入2μL荧光标记探针,混匀,在室温黑暗处孵育20 min。

表5 不同突变方式的竞争探针体系Table 5 Reaction system of competitive probes with different mutations
蛋白与探针结合反应结束后,4℃100 V电泳1 h。电泳结束后,快速拆开电泳槽取出胶板,用去离子水冲洗表面后,将胶板迅速转移至黑暗环境,用Image Reader软件扫描信号,选择激发波长492 nm激发荧光。
2 结果与分析
2.1 载体pET28a-O2的构建
通过Infusion方法将Opaque2基因的开放阅读框与pET28a载体骨架连接,转化大肠杆菌Fast-T1化学感受态细胞。EcoRⅠ、XbaⅠ双酶切鉴定分别获得5 712、854、143 bp的特异条带,EcoRⅠ单酶切鉴定分别获得5 855、854 bp的特异条带,XbaⅠ单酶切鉴定获得6 709 bp的特异条带(图2)。

图2 pET28a-O2酶切鉴定电泳图Fig.2 Enzyme digestion identification of pET28a-O2
2.2 蛋白浓度测定结果
EMSA实验之前,对浓缩后的O2蛋白进行浓度测定。已知蛋白标准品的浓度,绘制标准曲线,获得线性回归方程,再依据测得的样品OD值,计算样品中O2蛋白的浓度。
由图3可知,样品稀释16倍后测得的OD值为0.888,依据线性回归方程y=2.040 7x+0.596 2(R²=0.991 6),计算出样品中蛋白浓度为2.232μg·μL-1。
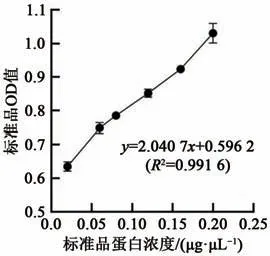
图3 蛋白定量标准曲线Fig.3 Standard curve for protein quantification
2.3 蛋白与探针的比例对EMSA实验的影响
使用波长为492 nm的蓝色激发光激发荧光,结果显示(图4),在泳道1体系中只加入FAM荧光标记的ZmGRAS11探针后未发生阻滞现象,泳道2~8体系中,随着O2蛋白加入量的不断增大,阻滞逐渐增强。泳道2中加入1.1μg的O2蛋白可形成微弱的阻滞条带,泳道5中加入8.9μg的O2蛋白有明显的阻滞条带,综合实验结果,选择8.9 μg O2蛋白的加入量进行下一步实验。

图4 EMSA检测不同浓度O2蛋白与ZmGRAS11探针的结合Fig.4 The binding of O2 protein with ZmGRAS11 probe was detected by EMSA
2.4 不同突变方式的竞争探针对EMSA实验的影响
为进一步探究ZmGRAS11启动子区GCN4 motif与O2蛋白结合中起主要作用的碱基,本研究对GCN4 motif序列进行多种方式的突变,合成了突变探针M1~M6,通过突变探针与FAM荧光标记探针竞争结合O2蛋白,分析GCN4 motif序列的各种突变对ZmGRAS11启动子区探针与O2蛋白结合能力的影响。
首先,通过在泳道2中加入荧光标记的野生型ZmGRAS11探针和O2蛋白设置阳性对照,结果出现阻滞条带,表明O2蛋白可以结合野生型Zm-GRAS11探针(图5B,泳道2)。其次,为证实未标记的野生型ZmGRAS11探针能与标记的探针竞争结合O2蛋白,在泳道2体系的基础上,泳道3、4加入了相较于荧光标记探针50倍和100倍的未标记探针,结果显示阻滞条带消失,进一步证实了野生型ZmGRAS11探针可与O2蛋白结合。为证实GCN4 motif序列是影响ZmGRAS11启动子区与O2蛋白结合的关键序列,设计了3种突变探针M1~M3,分别将GCN4 motif序列删除、全部突变成“T”和“G”,将探针分别加入了泳道5、6、7,结果显示泳道5、6中阻滞条带仍存在,证实了GCN4 motif序列是影响ZmGRAS11启动子区与O2蛋白结合的关键序列,泳道7中未出现阻滞条带,表明GCN4 motif序列不同的突变方式对其结合能力有不同的影响。最后,为分析GCN4 motif序列的各个碱基对ZmGRAS11启动子区探针与O2蛋白结合能力的影响,设计了3种突变探针M4~M6,分别突变了GCN4 motif序列的左三、中三和右三碱基,将探针分别加入了泳道8、9、10,结果显示泳道8、9中出现了阻滞条带,泳道10中未出现阻滞条带,表明GCN4 motif序列的7个碱基在与O2蛋白的结合过程中起到了不同的影响。
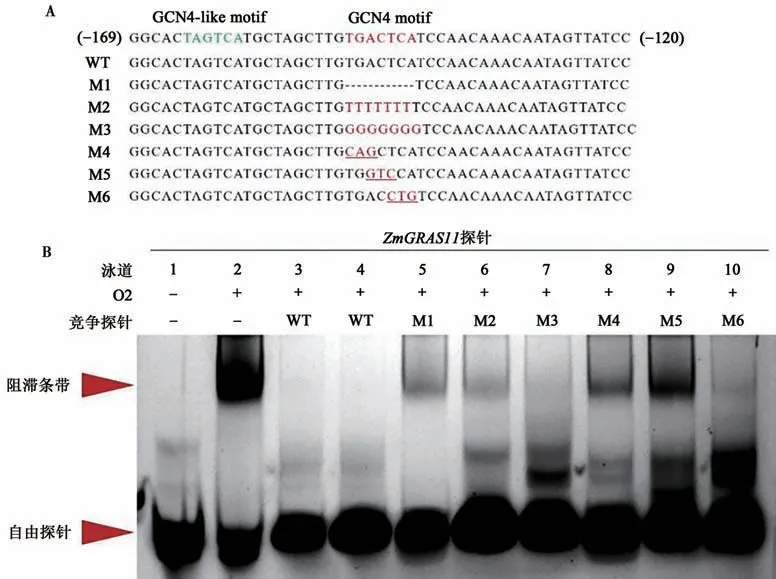
图5 不同方式突变对ZmGRAS11探针和O2蛋白结合力的影响Fig.5 Effects of different mutations on the interaction between the ZmGRAS11-promorer probe and O2 protein
3 讨论
凝胶阻滞实验是一种快速且灵敏检测蛋白质—核酸相互作用的实验方法,其原理是当目的蛋白与标记探针混合孵育后,会形成蛋白质—核酸复合物,而蛋白质—核酸复合物的电泳迁移率通常小于游离核酸的电泳迁移率,所以在非变性凝胶上会出现阻滞带,从而可以证实蛋白质与核酸互作[20-22]。相较于放射性同位素和生物素标记来说,荧光标记探针更为安全、稳定、简便,一次标记可长期贮存和使用。通过6%TBE凝胶只需要在电泳结束之后使用凝胶成像系统扫描信号,即可获得实验结果,实验步骤从菌体破碎至EMSA实验结束,整个流程只需2 d即可完成,不仅大大缩短了实验时间,而且降低了出现失误导致实验失败的概率。近年来,虽然荧光标记探针因为其优越性被广泛应用于EMSA实验中[23],但是一直缺少一份系统性的实验流程总结,本文对荧光标记的EMSA技术流程进行了优化和系统总结,可为蛋白—核酸互作研究提供技术支撑[24-25]。
凝胶阻滞实验时,需要特别注意的事项有以下几点:①荧光标记探针需避光放置,适宜分装保存于-80℃,使用时于冰上融化;②根据蛋白的等电点来确定电泳缓冲液的pH,且pH需要大于等电点,否则蛋白难以进入凝胶;③实验操作应尽量轻柔,以避免破坏蛋白结构。
已有研究表明,O2蛋白与ZmGRAS11启动子区的GCN4 motif序列结合[19],我们前期研究发现当对竞争探针进行GCN4 motif序列删除突变后,该探针将无法与标记的ZmGRAS11启动子区探针竞争结合O2蛋白。本研究通过固定荧光标记探针的加入量,梯度改变蛋白的加入量,以确定在EMSA实验中蛋白与探针结合的适宜比例,结果发现,提高蛋白的浓度能够优化实验结果,但是进一步提高蛋白浓度达到“饱和”后并不能增强EMSA的阻滞条带,因此蛋白与探针的适宜比例为8∶1[26]。本研究为进一步探究ZmGRAS11启动子区GCN4 motif序列中7个碱基与O2蛋白的结合位点,对竞争探针GCN4 motif序列进行不同方式的突变,结果发现:不同的突变方式会让Zm-GRAS11启动子区探针与O2蛋白的结合能力发生变化[27-29]。竞争探针M6的突变方式是将GCN4 motif序列右侧3个碱基突变,保留左侧4个碱基“TGAC”,此种突变方式未出现阻滞条带,提示GCN4 motif序列中的“TGAC”碱基序列可能在与O2蛋白结合过程中起主要作用。有研究认为,ZmGRAS11启动子区域在GCN4 motif上游10 bp处存在GCN4-like motif序列,该序列同样与O2蛋白有微弱的结合能力[30]。根据此研究结果进一步分析发现,GCN4-like motif序列中也存在与GCN4 motif序列中相同的“TGAC”碱基序列,所以我们认为GCN4-like motif序列能与O2蛋白结合也可能是因为其存在“TGAC”碱基序列。
本研究基于O2-ZmGRAS11调控模块,用荧光标记ZmGRAS11探针进行凝胶阻滞实验,首先集成优化了EMSA实验流程;其次确定了蛋白与探针的适宜比例为8∶1;最后确定了ZmGRAS11启动子区GCN4 motif序列中“TGAC”4个碱基可能是与O2蛋白的结合位点,为进一步研究O2-Zm-GRAS11转录调控模块在玉米籽粒发育中的作用机理提供依据。

