内陆水体盐度升高对小球藻生理特性的影响
赵开拓,李志龙,贺达
中冶南方城市建设工程技术有限公司,武汉 430077
近年来,人们越来越关注全球气候变化对自然环境造成的影响[1],其中内陆水体盐度升高是主要的影响之一[2-3]。据Nielsen等[4]预测,内陆地区水体盐度在未来50年将增长20倍。我国西部内陆地区大多处于温带大陆性气候和高原山地气候,水体盐化趋势明显[5]。周洪华等[6]研究表明,博斯腾湖25年间盐度从0.385 g·L-1升高至1.870 g·L-1,增加了3.9倍;乌梁素海13年间盐度从0.60g·L-1升高到4.36 g·L-1,增加了6.3倍。盐度升高会直接或间接地破坏内陆水生态环境和生物多样性,其中淡水藻类作为初级生产者对盐度反应最为敏感[7-8]。
淡水普通小球藻(Chlorella vulgaris)广泛分布于西部内陆地区,是一种常见的绿藻门小球藻属球形单细胞淡水藻类,细胞直径大多约为3~8μm[9-10]。在盐度升高条件下,小球藻生理特征的变化可反映全球气候变化导致的水体盐度升高对内陆水生态系统的影响程度[11]。现有研究主要从藻类对盐度的生理反应角度探究小球藻在高盐度胁迫时的响应。如杜宇等[10]研究表明高盐度(26.3 g·L-1)能抑制小球藻生长。刘春光等[11]研究表明盐度小于3 g·L-1会促进藻类生长,过高盐度会抑制藻类生长。饶本强等[12]在不同盐度条件下研究集球藻细胞结构的变化,发现在高盐条件下细胞形态结构出现阶段性破坏并出现质壁分离和空泡化等现象。葸玉琴等[13]研究自养和混养小球藻对NaCl胁迫的响应中发现:当培养基中NaCl浓度升高至5~20 g·L-1时,自养和混养小球藻由于受到盐胁迫,藻细胞内产生过多的自由基,细胞内蛋白质的含量会出现递减趋势。综上所述,现有研究主要集中在较高盐度(>5 g·L-1)条件下,小球藻及其他藻种的生长特性、产物合成及生理响应方面,而对低盐度条件(<5 g·L-1)下小球藻的生长繁殖及生理特性研究鲜见。
因此,本研究以我国西部内陆水体常见藻种普通小球藻(Chlorella vulgaris)为研究对象,以内陆水体逐渐盐化过程中形成低盐化水体(<5 g·L-1)为背景,模拟水体低盐化对普通小球藻(Chlorella vulgaris)的分裂增殖,探究低盐化条件下对小球藻叶绿素a合成速率、酶活性及其光合作用的生理响应。
1 材料与方法
1.1 实验材料
实验所用普通小球藻(Chlorella vulgaris)取自西安市兴庆湖地表水体,藻细胞在BG-11培养基上划线分离后纯化培养,挑取生长良好的藻种接种于新的BG-11培养基中,将培养至对数生长期的普通小球藻作为藻种使用,接种量为10%(体积分数)。扩培后将等量纯种普通小球藻分别置于40 cm×20 cm×30 cm的有机玻璃容器中进行培养,容器盛水量20 L,藻细胞原始浓度为1.2×105个·mL-1。取用兴庆湖原水模拟小球藻原有环境,并在126℃高压蒸汽灭菌锅中灭菌30 min,以去除其他藻细胞或细菌等杂质,灭菌完成后采用孔径1.2μm滤纸过滤作为本次实验培养基用水。
1.2 培养方法
为避免过低的营养条件对盐度刺激造成掩蔽作用,向灭菌过滤后的原水中添加营养盐使总氮含量达到12 mg·L-1,总磷含量达到0.5 mg·L-1。实验培养温度控制在为25℃左右,光照强度为3 300 lx,光暗周期为12 L∶12 D。实验设3个处理组和1个对照组,其中对照组不做处理,实测盐度0.4 g·L-1,实验组以NaCl调节盐度值,每组设3个重复,各项测量结果取平均值。本次实验周期连续9 d,实验第1 d各组均维持原水盐度值(0.4 g·L-1),作为实验对象的缓冲期;第2 d按照1、3、5 g·L-1的浓度梯度改变实验组溶液的盐度值。实验期间每天人工搅动3次,每隔24 h从各容器中间层分别取样,测定叶绿素a浓度、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)和叶绿素荧光等参数。
1.3 测定方法
1.3.1 叶绿素a含量测定取中间层原藻液10 mL,0.45μm过滤膜抽滤、-20℃冷冻过夜备用。测定方法改进梁兴飞[14]采用超声辅助热乙醇提取叶绿素a的方法,以低温高压破碎取代其超声破碎。
1.3.2 SOD比活性测定参考李合生等[15]氮蓝四唑(nitroblue tetrazolium,NBT)法测定SOD活性,用分光光度计测量波长560 nm处的吸光值,以抑制50%氮蓝四唑光还原为1个酶活力单位,除以总蛋白质含量得到比活性。
1.3.3 MDA浓度测定参考高俊凤[16]硫代巴比妥酸(thiobarbituric acid,TBA)法测定MDA浓度,用分光光度计分别测量532、600、450 nm处的吸光值,计算出MDA浓度。
1.3.4 叶绿素荧光参数qP和NPQ测定采用掌上水体叶绿素荧光仪(型号Aqua Pen-PAP-P100)连续测量,每次测定前暗处理15 min。
2 结果与分析
2.1 盐度对小球藻细胞分裂增殖的影响
实验第9天,从实验组和对照组中层水体分别取1 mL藻液,同倍率显微镜下统计每组样品10个视野中普通小球藻细胞数,并观察分裂增殖状况,结果取平均值。由图1可知,视野中可见的普通小球藻细胞数目随着盐度的升高逐渐减少:当水体盐度为1 g·L-1时,普通小球藻的数目与对照组近似相同,藻细胞体积几乎未发生变化,这表明1 g·L-1的盐度几乎不影响普通小球藻的细胞分裂及增殖;而盐度升高至3 g·L-1时,普通小球藻的数目与对照组相比略有减少,藻细胞体积缩小,表明3 g·L-1的盐度已开始对小球藻的细胞分裂与增殖产生一定程度的影响;而当盐度升高至5 g·L-1时,视野中细胞数目显著减少,藻细胞体积也明显缩小,表明5 g·L-1的盐度对普通小球藻细胞的分裂及增殖产生抑制作用,并显著影响细胞体积。
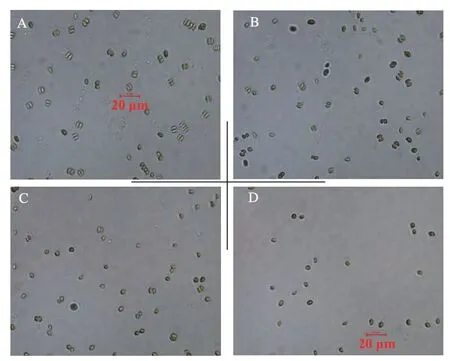
图1 不同盐度下的细胞数及细胞分裂图Fig.1 Cells amount and division in different salinity
图1中成对出现的藻细胞视为正在分裂的细胞,单个存在的藻细胞视野为未进行分裂的细胞。统计不同视野中正在分裂的藻细胞占藻细胞总量的比例,结果(表1)表明:在对照组和盐度1、3、5 g·L-1的实验组中,普通小球藻细胞分裂比例分别为77%、33%、18%、1.1%;随着盐度升高,普通小球藻细胞分裂比例呈显著下降趋势,当盐度升高至3 g·L-1时,藻细胞分裂比例小于20%,当盐度升高至5 g·L-1时藻细胞几乎停止分裂,这些结果表明水体盐度升高能明显抑制藻细胞分裂增殖,改变细胞生长周期。

表1 不同盐度下普通小球藻细胞相对分裂比例Table 1 Divide ratio of Chlorella vulgaris cells under different salinity
2.2 盐度对小球藻叶绿素a合成的影响
叶绿素a的合成量可间接表征普通小球藻的生长代谢情况,各组叶绿素a的初始浓度均为0.88 mg·L-1,实验第9天测量各实验组和对照组藻溶液中叶绿素a的最终浓度(图2)。

图2 试验期末处理组叶绿素a的最终浓度Fig.2 Comparison of final concentration of chlorophyll-a
叶绿素a最终浓度随着盐度升高降低。在试验第9天,对照组叶绿素a最终浓度为1.28 mg·L-1,与试验第1天相比增长了约36.2%,表明在水体盐度不改变条件下,藻溶液中叶绿素a不断合成累积。然而,在试验第9天,发现盐度为1、3和5 g·L-1时叶绿素a最终浓度相比于对照组分别减少5.30%、21.96%和28.03%,说明水体盐度越高,普通小球藻叶绿素a合成量越少。尤其当盐度达到5 g·L-1时,叶绿素a最终浓度仅为0.92 mg·L-1,与叶绿素a初始浓度0.88 mg·L-1相近,几乎未累积,这表明盐度越高对普通小球藻叶绿素a合成过程的抑制越强,盐度达到5 g·L-1时合成过程几乎停止,藻细胞的生长代谢受到抑制。
试验第1~9天各组叶绿素a浓度随时间的变化情况如图3所示:随着水体盐度升高,叶绿素a浓度的累积速率逐渐变缓。实验初期的1~2 d,各组叶绿素a浓度差异不大,均在0.85~0.95 mg·L-1范围内,各组叶绿素a的增长率大致相等,约为0.05~0.06 mg·L-1·d-1。实验中后期各组表现因盐度不同而出现较大差异,盐度1 g·L-1时,叶绿素a浓度持续增长,增长率与对照组相当,仅在浓度值上略低于对照组;而当盐度高于3g·L-1时,叶绿素a浓度在实验第7~9 d维持在0.9~1.0 mg·L-1左右不再增长,这说明盐度增加能明显抑制普通小球藻叶绿素a合成,进而抑制细胞生长。
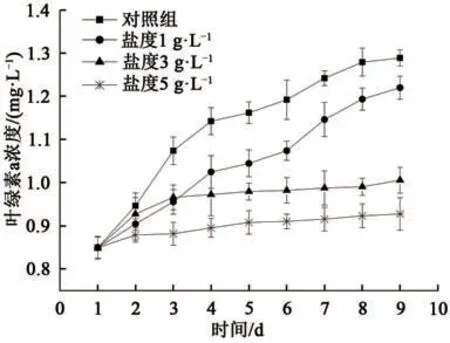
图3 不同盐度下叶绿素a浓度变化过程Fig.3 Change of chlorophyll-a concentration in different salinity
2.3 盐度对小球藻抗氧化指标的影响
2.3.1 丙二醛丙二醛(malondialdehyde,MDA)是脂膜氧化的最重要产物之一,MDA含量越高表明脂膜过氧化程度也越高,细胞组织破坏程度越大,对其增殖影响也越大。在实验第9天,不同盐度条件下普通小球藻细胞内MDA的平均含量如图4所示:与对照组相比,当水体盐度升高后普通小球藻细胞内MDA含量显著升高,两者呈正相关。实验第9天,对照组MDA平均含量较低,约0.004 mmol·mL-1;盐度为1 g·L-1时MDA平均含量略有升高,约0.012 mmol·mL-1;而当盐度升高至3或5 g·L-1时,细胞内MDA平均含量显著升高,分别 达 到了0.028 mmol·mL-1和0.04 mmol·mL-1,其中盐度5 g·L-1时MDA平均含量约为对照组的10倍。细胞内MDA平均含量大幅升高,反映出细胞膜已发生剧烈的脂膜氧化反应并产生自由基,表明水体盐度升高会在一定程度上损害藻细胞组织结构,抑制细胞生长代谢,这也侧面印证了普通小球藻增殖减缓以及叶绿素a变化趋势形成的原因。
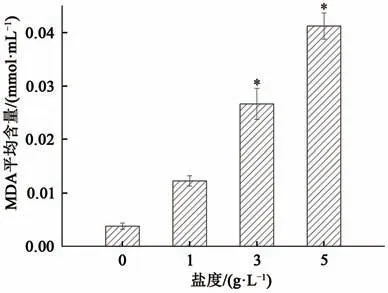
图4 不同盐度下MDA平均含量变化Fig.4 Average content of MDA under different salinity
2.3.2 超氧化物歧化酶超氧化物歧化酶(superoxide dismutase,SOD)是植物体内一种重要的抗氧化酶,其变化可表征植物体对环境恶化时产生活性氧的响应,从而使其逐步适应环境变化[17]。实验期间普通小球藻在不同盐度条件下细胞内SOD比活性的变化趋势如图5所示:由图5可以看出,对照组藻细胞的SOD比活性基本在0.01上下波动;与对照组相比,盐度升高使藻细胞内SOD比活性升高,总体呈现先升后降的趋势;且盐度越高SOD比活性上升速率越快,达到峰值的时间越短。在5 g·L-1的盐度条件下,SOD比活性在第4天达到峰值;在1 g·L-1和3g·L-1的盐度条件下,SOD比活性滞后于5 g·L-1实验组1 d达到峰值,且峰值时SOD比活性大小依次为为5 g·L-1>3 g·L-1>1 g·L-1>对照组。SOD比活性越高表明盐度增加造成的藻细胞膜氧化越严重,藻细胞在高盐度下被破坏可能是细胞分裂增殖速率下降的直接原因,这在Mostafa等[18]对螺旋藻的研究中也得到证实。
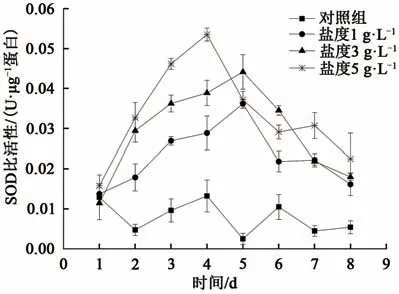
图5 不同盐度下SOD酶比活性变化Fig.5 The change of SOD specific activity under different salinity
2.4 盐度对小球藻光合作用的影响
叶绿素荧光动力学在探索植物光合效应方面有着广泛应用[19],其中光化学淬灭系数qP和非光化学淬灭系数NPQ是反应植物光合作用过程的重要动力学参数;前者反映了光合活性的高低和反应中心的开放程度,后者反映了植物耗散过剩光能为热的能力,体现了植物的光保护能力。实验过程中对照组与处理组的qP值以及NPQ值变化如图6和图7所示。
由图6可知,对照组普通小球藻的qP值(光合活性)平稳升高,与对照组中藻细胞持续增殖的状态吻合;而实验组普通小球藻的qP值则逐渐降低,且盐度越高下降速率越快,这说明细胞内光合活性处于衰减状态,且反应中心的开放程度也随着盐度升高而降低。特别是当盐度达到3 g·L-1以上时,藻细胞的光合活性下降趋势尤为显著,细胞内光合活性衰减直接导致光合作用的减弱,使对照组细胞分裂增殖减慢及叶绿素a合成量减少。
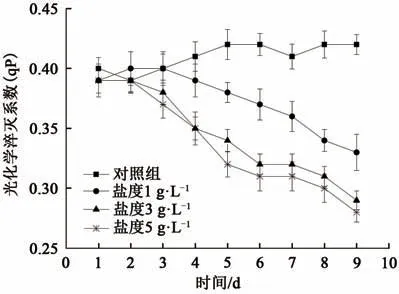
图6 不同盐度下光化学淬灭系数qP的变化Fig.6 Change of photochemical quenching coefficient qP under different salinity
由图7可知,对照组的NPQ值保持稳定,基本在0.125附近浮动;而实验组的NPQ值随时间延长逐渐增大,且盐度越高增长的速率越快,NPQ值也越大。实验第8天,盐度为1 g·L-1时NPQ值接近0.625,盐度≥3 g·L-1时NPQ值超过1.25,是盐度1 g·L-1时的2倍。当盐度超过3 g·L-1时,NPQ值成倍升高,说明此时藻细胞不能用于光合电子传递,而是以热的形式耗散掉这部分光能的增加,导致光合机构破坏或失活,进而抑制光合作用,这也解释了普通小球藻在盐度升高时生长增殖减缓以及叶绿素a合成量减少的原因。
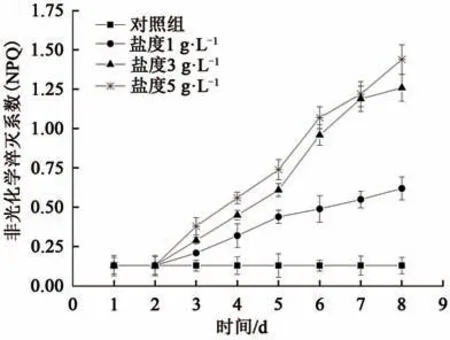
图7 不同盐度下非光化学淬灭系数NPQ的变化Fig.7 Change of non-photochemical quenching coefficient NPQ under different salinity
3 讨论
在全球气候变化的影响下,内陆水体盐度缓慢升高的趋势较为明显,水体盐度升高能够一定程度上抑制普通小球藻生长代谢,主要表现为光合作用、叶绿素a合成速率、细胞内酶活性降低等方面的影响。研究发现普通小球藻在盐度为1 g·L-1的水体中,虽然实验初期表现出环境胁迫,但经过环境适应后逐渐恢复生长和增殖水平。当盐度达到3 g·L-1时,普通小球藻细胞叶绿素a的合成速率和细胞增殖速率都逐渐降低;通过对光化学淬灭系数qP和非光化学淬灭系数NPQ的检测及计算,发现盐度升高造成光合作用反应中心破坏及光合活性降低,因此盐度升高能够显著抑制普通小球藻的生长代谢。任佳佳等[20]对波吉卵囊藻的研究也发现高盐会降低电子传递的量子效率,导致高盐组化学量子效率ΦPSⅡ值显著降低,这与本研究中NPQ值的变化趋势及结论吻合。同时,张国伟等[21]研究也发现,盐度升高使植物细胞的光合结构受到破坏,导致其细胞生长增殖等生理过程受到抑制。
此外,本研究发现,随着水体盐度的升高,普通小球藻细胞内MDA平均含量显著升高,与盐度呈正相关,表明普通小球藻细胞膜脂膜氧化作用随着水体盐度的升高逐渐加重。Meenakshi等[22]对钝顶螺旋藻的相关研究结果也表明,水体中金属离子含量升高时,钝顶螺旋藻的MDA水平明显上升。而随着水体盐度的升高,普通小球藻细胞内SOD酶比活性却表现出先升后降趋势,盐度越高SOD比活性上升速率越快,达到峰值的时间越短。孙妮等[23]研究栅藻发现,盐(NaCl)胁迫显著影响栅藻抗氧化物酶SOD和CAT活性,二者均随胁迫程度的增加出现先上升后下降的趋势,与本研究的结果类似,推测可能是由于藻细胞内抗氧化酶系统功能失衡,使藻细胞失去对盐度胁迫的灵敏性。
随着气候的变化,内陆水体盐度持续升高,水体环境严重恶化,当水体盐度超过5 g·L-1时内陆水体中普通小球藻群落密度可能逐渐减小。普通小球藻对水体盐化的适应性弱,若在水体盐化趋势难以逆转的背景下,淡水藻体系可能由多藻体系转变为耐盐藻体系,生态系统的多样性很可能逐渐丧失,进而引发食物链的多样性变化,因此需引起人类广泛重视。同时,本研究仅探究了盐度升高对纯种淡水藻类的胁迫作用,而缺少盐胁迫条件下多种混合藻类间的竞争关系研究,下一步将对混合藻种的盐胁迫进行探究。

