COPII囊泡衣被蛋白SEC24A在巨自噬通路中的功能研究
赵云鹏,张浩林,熊倩倩,李雨婷,王娟
北京工业大学环境与生命学部,北京 100124
细胞自噬是细胞内循环和降解过程,从酵母到哺乳动物都高度保守,对能量代谢、脂质代谢、应激和发育具有重要作用[1]。其主要过程是将细胞质成分包裹入具有新月形膜结构的自噬隔离膜,自噬隔离膜经扩张和封闭形成闭合的双层膜结构——自噬体,自噬体与溶酶体融合生成的自噬溶酶体致使内容物降解[2]。营养匮乏诱导的巨自噬通路对自噬体中的内容物没有选择性,线粒体自噬等选择性自噬通路仅对进入自噬体的特定物质进行降解。细胞自噬对细胞质成分的降解、蛋白质聚集物的清除、受损细胞器的循环以及对抗细胞内病原体等过程至关重要[3],自噬缺陷与许多人类疾病有关,包括传染病、神经退行性疾病和癌症等[4]。
来自酵母和其他真核生物的研究初步揭示了自噬相关蛋白在自噬过程中的重要作用[2]。自噬的发生需要一组专门的自噬相关蛋白ATGs(autophagy-related proteins)组装成功能复合物,这些复合物被有序招募到自噬体形成位点进而调控自噬通路的不同步骤。自噬相关复合物包括:①ULK1/ATG1复 合 物(ULK1/ULK2、ATG13、FIP200、ATG101),这是一种自噬启动所必需的丝氨酸/苏氨酸激酶复合物[5];②Ⅲ类磷脂酰肌醇3-激 酶(PI3KC3)复 合 物(VPS34、P150、BECN1、ATG14),对隔离膜的成核至关重要[6];③ATG9相关蛋白(ATG2、WIPI 1-4),它是唯一的跨膜核心ATG蛋白,作用于自噬体早期阶段[7-8];④ATG12泛 素 样 系 统(ATG12、ATG5、ATG16L1、ATG7、ATG10)[9];⑤LC3/ATG8泛素样系统(LC3、ATG7、ATG3、ATG4、ATG12、ATG5、ATG16L1)[10]。后两个泛素样系统,它们在自噬膜结构延伸过程中发挥作用。大多数ATG蛋白在自噬体形成后会从自噬膜结构解离,但LC3/ATG8的酯化形式在所有阶段都与自噬结构相关联,因此,LC3/ATG8是自噬隔离膜和自噬体的重要标记物[11-13]。
自噬体的形成涉及多种膜来源[14],源自内质网的COPII囊泡(coat protein complex II,COPII)是其中之一[15-17]。非饥饿条件下,COPII囊泡由ER的特殊区域内质网出口位点(ER exit sites,ERES)产生,主要功能是介导内质网向高尔基体的物质运输[18]。在营养匮乏条件下,内质网向高尔基体的运输途径受到抑制[19-20],ERES沿着内质网—高尔基中间室(ER-golgi intermediate compartment,ERGIC)扩大来帮助自噬体形成[21-23]。由ULK1激活的PI3KC3复合物促进COPII组分向ERGIC招募[24],从ERGIC出芽的特异性COPII囊泡作为LC3酯化的前体,这是自噬体生物发生的关键步骤[22,25]。COPII衣被蛋白复合物是一种多亚基蛋白复合物,内层由SEC23-SEC24蛋白组成,外层由SEC13-SEC31组成,它能够使高度弯曲的ER膜变形产生载货运输中间体[26]。酿酒酵母中SEC24在巨自噬通路中的重要作用已被报道[15],但哺乳动物细胞中SEC24各亚型在自噬中的功能尚不清晰,本文明确了SEC24其中一个重要亚型SEC24A在巨自噬通路中的关键作用,鉴定了SEC24A的作用位点及与其互作的自噬相关蛋白,以期为揭示自噬相关的分子机制提供参考。
1 材料与方法
1.1 细胞系及细胞培养条件
HeLa细胞由中国科学院生物物理所惠赠,Hela细胞在添加了10 %胎牛血清(Gibco,16000-044)和1 %青霉素/链霉素溶液的DMEM(dulbecco's modified eagle medium,Gibco,SH30022.01B)中培养,复合培养基放置于37℃,5% CO2的恒温细胞培养箱(Thermo,Form Series 3)。
1.2 siRNA干扰
将细胞接种于24孔板中,当细胞密度在30%~50%时进行转染实验。将100μL opti-MEM(Thermo,31985-070)加入RNase-free离心管中,取40 pmol待转染的siRNA(由吉玛公司合成)和2μL siRNA-Mate(吉玛,G04003),充分混匀后室温静置10 min,将混匀的试剂悬空滴加于相应孔中。siRNA序列如下,NC:Sense-5'-UUCUCCGAACGUGUCACGUTT-3',Antisense-5'-ACGUGACACGUU CGGAGAATT-3';siSEC24A:Sense-5'-GAGUCAGU GAGCCAAGGAUTT-3',Antisense-5'-AUCCUUGG CUCACUGACUCTT-3'。
1.3 Real-time PCR
参照RNA提取试剂盒(天根公司,DP430)说明书提取不同样品的总RNA,利用反转录试剂盒(天根公司,KR106)获得cDNA。qPCR反应体系为:7μL H2O,10μL Real-time PCR试剂(诺唯赞公司,Q712-02),正反向引物各1.5μL(擎科公司),1μL cDNA。引物序列如 下;siGAPDH:F-5'-TGCACCACCAACTGCTTA-
3',R-5'-GGATGCAGGGATGATGTTC-3';siSEC24A:F-5'-GAATCCACCTCTGCCTACAAC-3',R-5'-TGCCAATAAGCCACCTCC-3'。每组细胞检测SEC24A、GAPDH两个基因,且每次3个平行试验。Realtime PCR运行程序为:95℃预变性15 min;95℃变性10 s,55℃退火20 s,72℃延伸32 s,共41个循环。使用2-ΔΔCt方法计算基因相对表达水平。
1.4 蛋白质Western blot分析
蛋白样品和Marker加入8%或12%SDS聚丙烯酰胺凝胶孔中,分离胶80 V电泳30 min,浓缩胶120 V电泳70 min。使用甲醇激活的PVDF膜进行转膜,100 V电泳73 min。使用5%的脱脂奶粉封闭2 h。加入不同一抗后4℃孵育过夜,加入TBST缓冲液洗脱3次,每次10 min。anti-ATG9A兔源(MBL,PD042),1∶1 000稀释;anti-p62兔源(MBL,PM045),1∶1 000稀 释;anti-LC3II兔 源(CST,2775),1∶1 000稀释;anti-ACTIN兔源(索莱宝,K101527P),1∶1 000稀释;anti-SEC24A兔源(CST,9678),1∶1 000稀释。加入二抗室温孵育1 h,兔二抗(Proteintech,SA00001-2)和鼠二抗(Proteintech,SA00001-1)均按1∶5 000比例稀释,然后用TBST洗脱液洗3次,每次10 min。滴加显影液后使用化学发光成像仪显影,图像通过Image J软件进行灰度分析。
1.5 蛋白酶K保护实验
NC组和SEC24A敲低组细胞分别使用EBSS(earle's balanced salt solution,索莱宝,H2040)饥饿处理2 h,用100 nmol·L-1洛霉素A1处理6 h后悬浮在冷冻的匀浆缓冲液(20 mmol·L-1HEPES pH7.4、0.22 mol·L-1甘露醇、0.07 mol·L-1蔗糖和蛋白酶抑制剂)中。然后利用1 mL注射器使细胞反复通过27号针头20次以裂解细胞,4℃,4 500 r·min-1离心10 min后收集上清液(post-nuclearsupernatant,PNS)。然后将上清液再次以36 500 r·min-1离心30 min以获得沉淀(pellet,P)部分。将沉淀重悬于匀浆缓冲液中,然后分别用含有和不含有0.5% TritonX-100的100 mg·mL-1蛋白酶K(ProK,索莱宝,P1120)处理。冰上孵育20 min后加入10%三氯乙酸(TCA,麦克林,T818878),所得样品以12 638 r·min-1离心10 min。用冰冷的丙酮洗涤沉淀,重新悬浮在SDS-PAGE样品缓冲液中,并在100℃下煮沸10 min。通过Western blot检测蛋白酶K消化产物。
1.6 串联荧光质粒转染实验
将细胞接种于24孔板中,当细胞密度在30%~50%时进行siRNA转染实验,当细胞密度在70%~80%时进行串联荧光质粒RFP-GFP-LC3转染实验。准备两个无菌离心管,一个加入50μL opti-MEM和2μL lipo2000(Thermo公司,11668019),另一个加入50μL opti-MEM和1μgRFP-GFP-LC3质粒。将稀释的质粒加入稀释的转染试剂中混匀,室温静置15 min。向细胞培养板中加入新鲜的培养基,将100μL混匀的试剂悬空滴加。24 h后使用激光共聚焦扫描显微镜(Olympus,FV3000)观察记录荧光表达情况。
1.7 免疫荧光实验
将细胞接种在放有细胞爬片的24孔板中,在siRNA转染48 h后使用EBSS饥饿处理2 h,使用4%多聚甲醛固定20 min。在25℃下,细胞在10 mg·mL-1洋地黄皂苷(Sigma公司,11024-24-1)中透化15 min。在25℃下用5%山羊血清封闭60 min后,细胞中加入相应的一抗在4℃下孵育过夜。用PBS洗涤3次后,用FITC或罗丹明标记的二抗在室温下将细胞染色1 h。细胞核用0.2%Hoechst33258染色30 min,使用激光共聚焦扫描显微镜拍摄。
1.8 免疫共沉淀实验
收集EBSS饥饿处理2 h的HeLa细胞,用PBS洗2次后加入650μL裂解液(50 mmol·L-1Tris HCl pH 7.4,150 mmol·L-1NaCl,1 mmol·L-1EDTA,1%Triton X-100蛋白酶抑制剂),冰上裂解30 min。12 000 r·min-1,离心30 min,收集上清。取50μL细胞裂解液保存为整个细胞裂解液(Input),加入上样缓冲液,煮沸10 min。分别取1μg ATG9A抗体(MBL,PD042)以及1μg IgG兔抗(Proteintech,B900610)加入含有20μL磁珠的100μL裂解液中,室温孵育1 h,然后分别加入600μL细胞裂解,室温滚柱孵育2 h。利用磁力架分离磁珠弃上清,沉淀用洗涤缓冲液(50 mmol·L-1Tris HCl pH 7.4,150 mmol·L-1NaCl,1 mmol·L-1EDTA,0.2%Triton X-100,蛋白酶抑制剂)洗涤3次,每次5 min。最后加入20μL上样缓冲液,煮沸10 min,Western blot分析样品。
1.9 统计分析
实验获得的数据使用GraphPad Prism软件进行分析画图,统计均经过3次独立实验,采用t检验,描述性统计结果用平均值±标准差表示,ns代表P>0.05,*代表P<0.05,**代表P<0.01,P<0.05即被认为其有统计学意义。
2 结果与分析
2.1 SEC24A在巨自噬通路中的作用
为了确定SEC24A在巨自噬通路中的作用,利用siRNA干扰技术敲低SEC24A基因,siRNA转染24 h后,换成EBSS培养基饥饿处理2 h,经Western blot和免疫荧光检测SEC24A敲低细胞和对照细胞中自噬底物p62蛋白和自噬标记蛋白LC3的 蛋 白水 平,以确 定 自噬 通 量[13]。qPCR(图1A)和Western blot(图1B)显示SEC24A已经被显著敲低。SEC24A敲低细胞中p62蛋白水平显著增加(图1C,D),LC3-II蛋白水平显著减少(图1C,E),提示自噬通路受阻,表明SEC24A敲低会导致巨自噬活性降低。
随后利用免疫荧光实验验证内源p62和LC3的表达情况,获得了与Western blot一致的结果。EBSS饥饿处理2 h后,敲低SEC24A细胞中p62的表达量高于对照组细胞(图1F,G),表明自噬通路被阻断。在诱导自噬后,非酯化形式的LC3(LC3-I)与PE结合形成酯化形式的LC3-II,其与自噬膜结构结合并形成点状结构。LC3免疫荧光显示敲低SEC24A细胞中LC3成点的数量减少(图1H,I),同样证明饥饿条件下SEC24A敲低细胞中自噬活性降低,说明SEC24A在巨自噬通路中起重要作用。
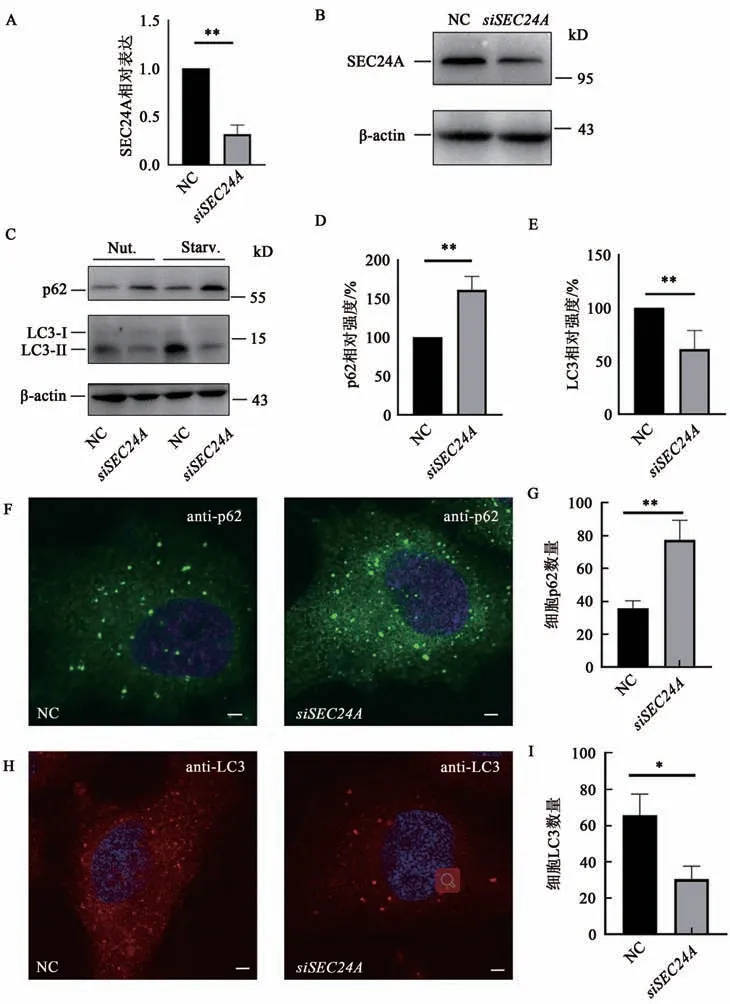
图1 SEC24A敲低后细胞内p62和LC3变化情况Fig.1 Changes of intracellular p62 and LC3 after SEC24A knockdown
2.2 SEC24A在自噬通路中的作用时期
为了确定SEC24A在自噬中的功能,我们通过RFP-GFP-LC3串联荧光实验检测SEC24A敲低细胞中自噬体及自噬溶酶体的数量变化情况。由于绿色荧光蛋白GFP对酸性环境比较敏感,当GFP蛋白进入溶酶体的酸性环境时荧光信号会淬灭,因此,与溶酶体融合之前RFP-GFP-LC3修饰的隔离膜和未成熟的自噬体表现为黄色斑点,而红色斑点则代表酸化的自噬溶酶体[27-28]。在NC组和SEC24A敲低组HeLa细胞中转染RFP-GFPLC3串联荧光质粒,荧光观察发现,饥饿2 h后,SEC24A敲低的细胞中黄色斑点和红色斑点均减少(图2A,B),且SEC24A敲低后自噬隔离膜、自噬体、自噬溶酶体均显著减少(图2C,D),表明SEC24A敲低作用于自噬通路早期的自噬体形成阶段。
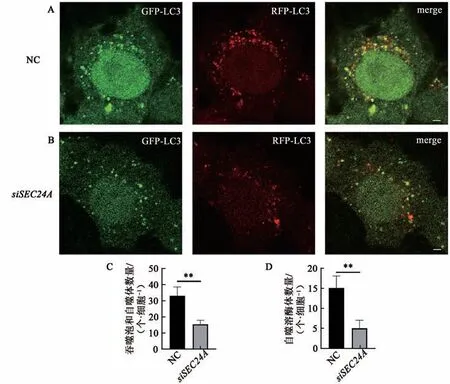
图2 敲低SEC24A后细胞中RFP-GFP-LC3荧光信号变化Fig.2 Changes in RFP-GFP-LC3 fluorescence signal in cells after knockdown of SEC24A
2.3 SEC24A在自噬体闭合过程中的作用时期
为了明确SEC24A在巨自噬通路中的作用位点,进一步通过蛋白酶K保护实验研究SEC24A作用于自噬体闭合前还是闭合后,该实验基于自噬体中隔离的p62和GFP-LC3对蛋白酶的敏感性[13],当p62和GFP-LC3被封闭的自噬体包裹时,p62和GFP-LC3受自噬体保护不被蛋白酶K降解,而p62和GFP-LC3位于细胞质中不被自噬体包裹时则会被蛋白酶K降解。对照组和SEC24A敲低组HeLa细胞使用EBSS饥饿处理2 h,自噬阻断剂洛霉素A1处理6 h,按照1.5中的方法进行蛋白酶K保护实验,经Western blot检测,当SEC24A被敲低后p62和GFP-LC3对蛋白酶K的敏感性增强,被保护的p62和GFP-LC3蛋白均显著减少(图3),表明SEC24A作用于自噬体闭合前。
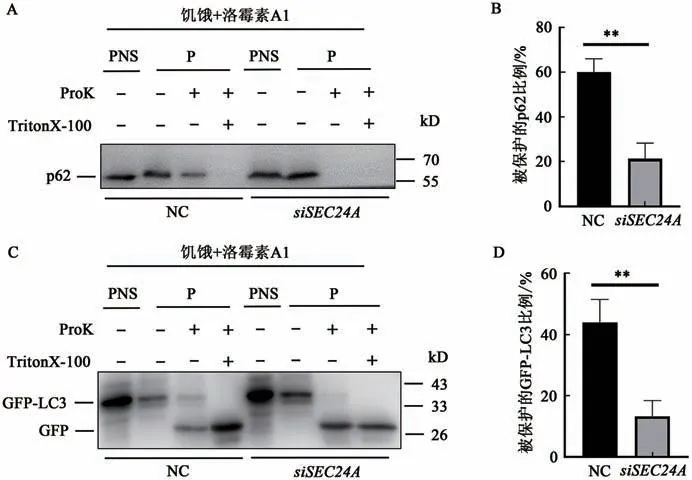
图3 敲低SEC24A的蛋白酶K保护实验结果Fig.3 Proteinase K assay results after knockdown of SEC24A
2.4 SEC24A的作用位点
当自噬发生时ATG蛋白按层次顺序被招募到自噬体形成位点,随着自噬体的闭合,大多数ATG蛋白从自噬膜结构中分离。2.3中已经确定了SEC24A作用于自噬闭合前,为了进一步精确SEC24A的作用位点,通过免疫荧光实验检测了SEC24A敲低后多种ATG蛋白(包括ATG9A、ATG14L和ATG16L1)的点状结构数量变化情况。如 图4所 示,HeLa细 胞 中 敲 低SEC24A导 致ATG14L和ATG16L1点状结构减少,而ATG9A点状结构的数量相比对照组没有明显变化,表明SEC24A作用于ATG14L和ATG16L1上游。
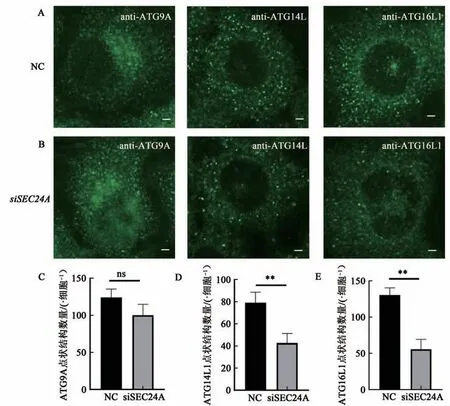
图4 敲低SEC24A后细胞内ATG9A、ATG14L和ATG16L1点状结构数量变化Fig.4 Changes in the number of punctate structures of ATG9A,ATG14L and ATG16L1 in cells after SEC24A knockdown
2.5 SEC24A与ATG9A的相互作用
有文献报道,在酵母细胞中SEC24与ATG9存在相互作用[15],在哺乳动物细胞中存在酵母ATG9的两种同源亚型ATG9A和ATG9B,ATG9A在所有组织中都有表达,而ATG9B在胎盘和垂体中富集[29-30],因此本研究在哺乳动物细胞中利用免疫共沉淀(co-immunoprecipitation,Co-IP)实验验证饥饿条件下哺乳动物细胞中SEC24A与ATG9A是否存在相互作用。收集EBSS饥饿处理2 h的细胞,使用非变性裂解液裂解细胞,利用磁珠免疫沉淀ATG9A,发现SEC24A与ATG9A共沉淀,且对照IgG处没有条带(图5),说明饥饿条件下ATG9A与SEC24A存在体内相互作用。
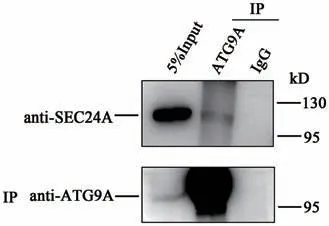
图5 ATG9A与SEC24A免疫共沉淀结果Fig.5 Co-immunoprecipitation results of ATG9A and SEC24A
3 讨论
细胞自噬是一种将细胞质成分和细胞器运输到溶酶体内并进行降解的过程,对于维持正常或压力下的细胞基本功能具有重要作用[1]。当细胞处于饥饿状态时自噬发生,自噬体的形成需要大量的细胞内膜重排[21,31-32]。内质网来源的COPII囊泡成为自噬体形成过程中膜的来源[15,33-34],并且COPII囊泡关键衣被蛋白SEC24 C端的磷酸化是控制囊泡运输与自噬转换的开关[15],目前哺乳动物细胞中COPII囊泡衣被蛋白SEC24各亚型在细胞自噬中的作用尚不清楚。
本研究发现在饥饿条件下,与对照细胞相比,SEC24A敲低细胞内自噬底物p62积累,且自噬标志蛋白LC3-II减少,表明SEC24A参与巨自噬通路,这与酵母中SEC24缺陷造成自噬受阻的结论一致[35]。此外,也有文献证明了磷酸化的SEC23B通过与SEC24A和SEC24B相互作用促进自噬通量[33]。RFP-GFP-LC3串联荧光实验[28]显示敲低SEC24A后自噬体及自噬溶酶体的数目均减少。蛋白酶K实验显示敲低SEC24A后被膜结构保护的p62和GFP-LC3均减少,提示SEC24A作用位点在自噬体闭合之前。敲低SEC24A导致ATG14L和ATG16L1点状结构减少,表明SEC24A作用于ATG14L和ATG16L1上游。
免疫荧光实验显示SEC24A敲低细胞中,ATG9A点状结构数量相比对照组没有明显变化。免疫共沉淀实验结果显示哺乳动物细胞中SEC24A与ATG9A存在相互作用,但与酵母相比,其相互作用较弱。可能的原因一是酵母和哺乳动物细胞中ATG9囊泡与自噬膜结构结合的密切程度有区别,COPII囊泡作为自噬体膜来源之一[17,36-37],与ATG9互作紧密程度可能会受到相应的影响。在酵母细胞中,自噬形成于自噬前体结构(pre-autophagosomal structure,PAS),ATG9在PAS处与ATG13[38]、ATG2和ATG18[39]等自噬相关蛋白相互作用,并且融入自噬体双层膜的外膜[40],使ATG9与自噬体紧密结合;而在哺乳动物细胞中,活细胞成像显示ATG9囊泡在细胞质中动态移动,仅与部分自噬蛋白(如LC3和DFCP1)标记的阳性区域短暂接触[41-42],并不融入自噬体。因此,哺乳动物细胞中SEC24A与ATG9A的结合表现得不如酵母细胞紧密,可能与ATG9囊泡和自噬体处于动态结合相关。二是哺乳动物细胞中ATG9A在质膜修复等非自噬通路中也起重要作用[43],这 些 通 路 没 有SEC24A参 与,因 此 与SEC24A互作的ATG9A比例会相应降低。
本研究确定了SEC24A参与哺乳动物细胞巨自噬,并且解析了参与巨自噬通路的作用位点,为全面解读COPII囊泡及其衣被蛋白在自噬中的重要作用提供了信息。在酵母细胞中,饥饿处理导致SEC24在自噬过程中被HRR25蛋白激酶磷酸化,且磷酸化的SEC24增加与ATG9之间的相互作用[15],然而哺乳动物细胞中是否存在同样的机制,以及哺乳细胞饥饿诱导自噬过程中激发SEC24A与ATG9A的相互作用机制,仍需要进一步探索。

