薏苡仁多菌发酵液的菌种优选及其抑制黑色素生成的作用研究
毛新亮,张卉,陈文杰,陈艳武,任红红,余桂媛,黄亚东,项琪,李晓敏*
1.广东完美生命健康科技研究院有限公司,广东 中山 528451;
2.完美(广东)日用品有限公司,广东 中山 528451
3.广州暨南大学医药生物技术研究开发中心有限公司,广州 510000;
薏苡仁(Semen coicis)又称薏米,是干燥成熟的薏苡种子,有“禾本科植物之王”称誉。薏苡仁营养丰富,其蛋白质含量约12%~17%,包括白蛋白、球蛋白、醇溶蛋白等[1],油脂约6%,包括棕榈酸、油酸、亚油酸、硬脂酸等[2],碳水化合物达60%~70%。此外,还含有丰富的薏苡仁酯、薏苡仁素、薏苡仁多糖A/B/C、甾醇类、多酚及三萜化合物等活性物质[3-5]。作为一种药食兼用型资源,薏苡仁既是一种传统食物,又可作为传统中药材应用于医药领域。现代药理研究表明,薏苡仁具有广泛的抗炎、抗氧化、解毒、除湿、镇痛、抗癌和抗肿瘤作用[6-7]。
乳酸菌发酵是指以乳酸菌为发酵菌株,以具有活性成分的植物原料为发酵基质,在双向发酵过程中,发酵基质为乳酸菌生长提供所需营养,而乳酸菌对发酵基质进行分解与再合成,从而产生新的功效成分,提高发酵产物活性[8-9]。谷物营养物质丰富,尤其是蛋白质和碳水化合物含量高,可为乳酸菌的生长提供充足且天然的养分资源。乳酸菌发酵谷物不仅有利于发酵液中功能性物质的增加和生物活性的增强,也有利于消除谷物抗营养因子的阻碍作用,促进营养物质充分转化与释放[10-11]。大部分乳酸菌作为益生菌被普遍用于发酵领域,其中乳酸乳球菌凭借其自身的代谢特点被用作基因工程工具,在生物工程领域极具开发优势[12]。保加利亚乳杆菌和嗜热链球菌则基于两者间的互利共生关系成为乳酸制品生产过程中广泛使用的发酵剂组合[13-14]。目前,国内薏苡仁产品开发相对不足,特别是高附加值的产品基本掌握在外资企业手中。本研究以药食同源的薏苡仁为发酵基质,采用乳酸乳球菌、嗜热链球菌和保加利亚乳杆菌进行单菌和复合多菌发酵,分析比较不同乳酸菌发酵对薏苡仁发酵液主要成分和体外活性变化的影响,并以斑马鱼为模型探讨发酵液对黑色素生成的抑制作用。此工艺创新获得的产品有望开发为新的具美白肌肤性能的功能性原料,对创新产业发展模式,促进薏苡产业转型升级,增加企业效益,推动薏苡仁高值产品走出国门具有积极意义。
1 材料与方法
1.1 材料
1.1.1 试验材料薏苡仁来源于山东枣庄滕州市大坞镇;嗜热链球菌菌粉和保加利亚乳杆菌菌粉均购自山东中科嘉亿生物工程有限公司;乳酸乳球菌来自广州暨南大学医药生物技术研究开发中心;AB系斑马鱼来自广州鲁比生物科技有限公司。
1.1.2 试剂与仪器MRS培养基购自青岛海博生物公司;α-淀粉酶、糖化酶、没食子酸标准品、芦丁标准品、左旋多巴、曲酸、羟基乙酸标准品、L-乳酸标准品均购自上海源叶生物科技有限公司;蘑菇酪氨酸购自Sigma公司;Spark多功能酶标仪TECAN、LC-2040C高效液相色谱仪购自日本岛津公司;HH600电热恒温水浴槽购自上海道墟茂祥仪器设备厂;LRH-150型生化培养箱购自上海一恒科学仪器有限公司;Z-A-D5五层单排独立养殖单元购自上海海圣生物实验设备有限公司;SZ680连续变倍体式显微镜购自重庆奥特光学仪器有限公司。
1.2 方法
1.2.1 薏苡仁发酵液制备薏苡仁粉与水按质量比1∶10复合并加入0.2%的无水氯化钙后糊化1 h,降温至75~80℃加入α-淀粉酶(酶用量为20 U·g-1薏苡仁粉)液化2 h,降温至60℃后调节液化液pH至4.0~4.2,加入糖化酶(酶用量为300 U·g-1薏苡仁粉)于60℃恒温条件下糖化2 h,调节糖化液pH至6.0,117℃高温高压灭菌20 min,冷却至室温完成薏苡仁发酵基质的制备。
乳酸乳球菌发酵液(记为L.l)制备:发酵基质中加入1.0%在MRS培养基中活化至OD600=1.0的乳酸乳球菌菌液,37℃恒温发酵48 h。
嗜热链球菌发酵液(记为S.t)制备:发酵基质中加入0.13%嗜热链球菌菌粉后于37℃恒温发酵48 h。
保加利亚乳杆菌发酵液(记为L.b)制备:发酵基质中加入0.13%保加利亚乳杆菌菌粉并于37℃恒温发酵48 h。
复合乳酸菌发酵液(记为L.l+S.t+L.b)制备:发酵基质中同时加入0.13%嗜热链球菌菌粉、0.13%保加利亚乳杆菌菌粉和1.0%在MRS培养基中活化至OD600=1.0的乳酸乳球菌菌液,37℃恒温发酵48 h。
1.2.2 总还原糖含量测定采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法[15]测定发酵液中总还原糖含量:取100倍稀释后发酵液1 mL,加入0.75 mL DNS试剂,沸水浴5 min,取出冷却后定容至7 mL,520 nm处测吸光度值。用葡萄糖标准液绘制质量浓度—吸光度标准曲线得出式(1)。
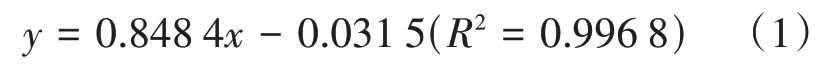
1.2.3 总酸含量测定总酸按照Avdeef等[16]的方法测定。取5 mL发酵液并用超纯水定容至25 mL,用0.1 mol·L-1的NaOH标准液将pH定至8.2,总酸含量计算方法如公式(2)。

其中X为总酸含量(g·L-1);c为NaOH标准液浓度(mol·L-1);V1为滴定样液时所消耗NaOH标准液的体积(mL);V2为空白所消耗NaOH标准液的体积(mL);K为换算系数(以乳酸为主,0.090);F为样液的稀释倍数;m为样液的质量(g)。
1.2.4 乳酸含量测定有机酸的检测参考郑梅等[17]的操作方法。采用高效液相色谱仪(LC-2040C)搭 配CAPCELL PAK ADME C18色 谱 柱(4.6 mm×250 mm,5μm)。流动相A为0.1 mol·L-1磷酸氢二铵溶液(磷酸调节pH为3.0),流动相B为甲醇,紫外检测波长为214 nm,柱温为30℃,进样量为5μL。标准品为L-乳酸标准品。
1.2.5 总酚含量测定总酚含量的测定参考Folin-Ciocalteu法[18-19]并修改如下:取发酵液0.5 mL,以水为空白对照,加入2.5 mL福林酚试剂摇匀,静置5 min后加入2 mL 7.5%Na2CO3溶液,室温下放置60 min,在765 nm处测吸光度值。以没食子酸标准品绘制质量浓度—吸光度的标准曲线,得出式(3)。
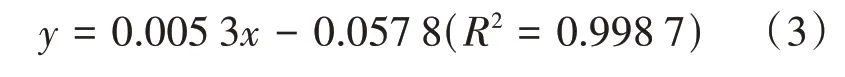
1.2.6 总游离氨基酸含量测定总游离氨基酸含量测定参考彭真汾等[20]和刘长姣等[21]的方法并作如下修改:取5倍稀释后发酵液1 mL,加入0.5 mL磷酸盐缓冲液和0.5 mL 2%茚三酮溶液混匀,沸水浴15 min,冷却后加水定容至7 mL并静置10 min,在570 min处测吸光值。以L-精氨酸标准品绘制质量浓度—吸光度的标准曲线,得出式(4)。

1.2.7 蛋白含量测定采用G250法测定发酵液中总蛋白含量:取发酵液40μL于96孔板中,加入200μL G250反应液混匀静置5 min,在595 nm处测定吸光值。以牛血清蛋白(BSA)标准液绘制质量浓度—吸光度的标准曲线,得出式(5)。
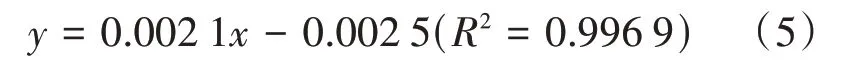
1.2.8 总活菌数量统计采用稀释平板计数法[22]。取发酵0、8、24、32和48 h共5个时间点的发酵样品,用0.9%的氯化钠溶液按10倍梯度稀释并涂布,选择菌落数适宜的平板计数,根据稀释倍数计算总菌数。
1.2.9 菌群结构分析在发酵0、8、24、32和48 h共5个时间点取发酵样冻存,委托北京奥维森基因科技有限公司进行扩增子扩增及测序。以F338(5′-ACTCCTACGGGAGGCAGCAG-3′)和R806(5′-GGACTACHVGGGTWTCTAAT-3′)为引物,扩增细菌16S rRNA基因V3-V4可变区[23-24]。PCR产物在Illumina Miseq平台上进行测序分析。
1.2.1 0羟自由基清除率测定羟自由基清除率测定参考赵淑锐等[25]和李倩茹等[26]的方法并作如下修改:取发酵液50μL并依次加入9 mmol·L-1FeSO4、9 mmol·L-1乙醇-水杨酸溶液和8 mmol·L-1H2O2各100μL,用超纯水定容至1 500μL,37℃水浴15 min,在510 nm处测定吸光值,羟自由基清除率计算方法如公式(6)。
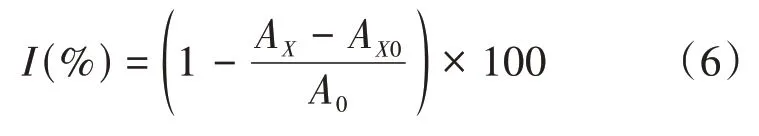
其中I(%)为DPPH自由基清除率;AX为样品组吸光值;AX0为对照组吸光值,以超纯水代替H2O2;A0为空白组,以超纯水代替样品。
1.2.1 1酪氨酸酶活性抑制率测定酪氨酸酶活性测定方法参考文献[27-28]并修改如下:取1 mL发酵液加入0.5 mL酪氨酸酶溶液混匀,37℃水浴10 min,加入1 mg·mL-1左旋多巴2 mL,混匀静置5 min,在475 nm处测定吸光值。酪氨酸酶活性抑制率计算方法如公式(7)。

其中I(%)为酪氨酸酶活抑制率;AX为样品组吸光值,AX0为样品对照组吸光值,以pH 6.8磷酸缓冲液代替酪氨酸酶溶液;A为空白组吸光值,以pH 6.8磷酸缓冲液代替发酵液;A0为空白对照组吸光值,以pH 6.8磷酸缓冲液代替发酵液和酪氨酸酶溶液。
1.2.1 2斑马鱼模型评价黑色素生成抑制将性成熟雌雄斑马鱼1∶1配对,自然交配产卵,挑选受精后6~8 hpf(hours post-fertilization)健康AB系斑马鱼胚胎随机置于96孔细胞板,1枚·孔-1,30枚·组-1,每孔加入200μL溶液。发酵液浓度设为0.5%、1.0%、2.0% 3组,设阳性对照组为1.0 mg·mL-1熊果苷和空白对照组。置于曲线控制生化培养箱孵育,孵育至72 hpf时,体式显微镜下观察斑马鱼胚胎的黑色素沉积情况。孵育至72 hpf时加入裂解溶液并超声裂解处理,离心取沉淀并震动使离心管中黑色素充分溶解,取100μL置于96孔板中,用酶标仪于405 nm波长处测定吸光值。黑色素生成抑制率计算方法如公式(8)。而离心后的上清置于96孔板中,同时加入左旋多巴溶液,37℃孵育1 h后在酶标仪475 nm波长处测定吸光值。酪氨酸酶活抑制率计算方法如式(7)。

1.2.1 3数据处理运用SPSS 18.0软件处理数据,组间两两比较采用LSD法,结果采用平均值±标准误表示,以P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 薏苡仁发酵液主成分变化
不同乳酸菌发酵薏苡仁前后主要成分变化如表1所示。与发酵前(N)相比,3种单一乳酸菌及其复合三菌发酵液的pH、总蛋白含量、总酸含量、乳酸含量均发生显著变化。经发酵后,4组乳酸菌发酵液的pH均显著降低,其中L.b组和复合三菌发酵液的pH降幅最大,分别由5.82±0.02降至3.25±0.03和3.21±0.01。单一乳酸菌和复合三菌发酵液的总蛋白含量均显著减少,由59.7±0.20 mg·mL-1降至31.63~37.29 mg·mL-1,但各组间无明显差异。4组发酵液的总酸和乳酸含量均较发酵前显著增加,其中复合三菌发酵液总酸和乳酸含量增幅最大,总酸含量由2.84±0.19 mg·mL-1增至30.15±0.76 mg·mL-1,乳酸含量则由0 mg·mL-1增加至6.38±0.14 mg·mL-1;L.b,S.t和L.l发酵液的总酸和乳酸含量增幅较小。而单一乳酸菌和复合三菌发酵对薏苡仁发酵液的总游离氨基酸含量、还原糖含量和总酚含量均无显著影响。

表1 不同乳酸菌薏苡仁发酵液的主成分变化Table 1 Changes of main substances in native and fermented coix seed fermented by different lactic acid bacteria
2.2 不同乳酸菌薏苡仁发酵液的体外活性
薏苡仁发酵液对羟自由基清除影响如图1A所示。实验条件下,阳性对照组抗坏血酸(0.5 mg·mL-1)对羟自由基的清除率为102.59%±2.45%,发酵前(N)的薏苡仁基质对羟自由基的清除率为29.17%±0.74%。经发酵后,不同乳酸菌薏苡仁发酵液对羟自由基清除率分别为51.08%±0.64%(L.l组)、49.72%±1.76%(S.t组)、48.98%±0.99%(L.b组)和49.99%±0.61%(L.l+S.t+L.b组),与发酵前相比均显著提高(P<0.05),表明乳酸菌发酵对薏苡仁发酵液的抗氧化能力具有增强作用,但不同乳酸菌的薏苡仁发酵液组间无明显差异。
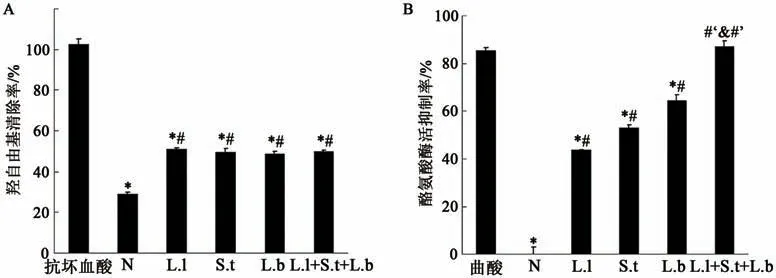
图1 薏苡仁发酵前后对羟自由基清除率和酪氨酸酶活性抑制的影响Fig.1 Inhibitory effects of native and fermented coix seed on hydroxyl radical scavenging and tyrosinase activity
薏苡仁发酵液对酪氨酸酶活性抑制的影响如图1B所示。在实验条件下,阳性对照组曲酸(0.125 mg·mL-1)对 酪 氨 酸 酶 活 性 抑 制 率 为85.35%±1.35%,对比发酵前(N)在P<0.05上具有统计学差异。经发酵后,不同乳酸菌薏苡仁发酵液对酪氨酸酶活性抑制率分别为43.85%±0.03%(L.l)、52.84%±1.34%(S.t)、64.46%±2.37%(L.b)和87.26±2.37%(L.l+S.t+L.b),与发酵前相比均显著提高,其中L.l+S.t+L.b组与阳性对照组效果相当,并显著高于L.l、S.t和L.b组,表明复合乳酸菌的薏苡仁发酵液在酪氨酸酶活性抑制方面具有较强的作用。
2.3 薏苡仁发酵过程中菌群结构分析
通过对比不同乳酸菌对薏苡仁发酵液的主成分变化和体外活性影响,结果表明相对单一乳酸菌发酵而言,3种乳酸菌复合发酵更具有优势。复合菌发酵过程中,总生物量和菌群结构变化如图2A所示:总生物量在0~8 h阶段呈指数增长,发酵液pH在此阶段降幅也最大,pH由5.82±0.02降至3.21±0.01;在8~24 h阶段,总生物量呈缓慢增加趋势,发酵液pH在此阶段降幅相应减缓;在24~48 h阶段,随着发酵液总体酸性接近乳酸菌生长下限,菌落生长受阻,总生物量趋于稳定,总菌落数达8.54[lg(CFU·mL-1)]。
复合菌发酵过程中菌群结构变化如图2B所示:发酵初始(F0样品),嗜热链球菌和保加利亚乳杆菌相对丰度相当,乳酸乳球菌较前两者偏低,相对丰度不足20%;发酵8 h后(F8样品),乳酸乳球菌占比增加,相对丰度达40%左右,保加利亚乳杆菌相对丰度降低,约25%;随着发酵的推进,保加利亚乳杆菌逐渐占据主导优势,在F48样品中相对丰度达60%左右,乳酸乳球菌与嗜热链球菌两者相对丰度则呈降低趋势,这可能与发酵后期阶段发酵液总体酸性较强,导致乳酸乳球菌与嗜热链球菌生长受阻,而保加利亚乳杆菌为好酸型菌,因此更偏好酸性环境有关[29]。

图2 发酵过程总活菌数量和菌群相对丰度变化Fig.2 Changes in total number of viable bacteria and relative abundance of flora during fermentation
2.4 薏苡仁发酵液对黑色素生成的抑制作用
薏苡仁发酵液对斑马鱼胚胎形态学的影响如图3A所示,与空白对照组相比,阳性对照组中1.0 mg·mL-1熊果苷处理后斑马鱼体表黑色素分布减少;不同浓度的发酵液处理后,斑马鱼体表黑色素分布随着发酵液使用浓度的增加而减少。

图3 薏苡仁发酵液抑制黑色素生成Fig.3 Inhibition of melanin production by coix seed fermented coix seed
发酵液对72 hpf时鱼胚黑色素生成的影响如图3B所示:在实验条件下,阳性对照组1.0 mg·mL-1熊果苷对鱼胚黑色素生成抑制率为25.80%±3.22%,与空白对照相比在P<0.05水平上具有统计学意义。实验组中,发酵液对鱼胚黑色素的抑制率随着使用浓度的增加而升高。当发酵液使用浓度为2.0%时,对鱼胚黑色素的抑制率达到59.45%±2.00%,显著高于空白对照组和阳性对照熊果苷。
发酵液对72 hpf时鱼胚酪氨酸酶活性的影响如图3C所示。在实验条件下,1.0 mg·mL-1阳性对照组熊果苷对鱼胚酪氨酸酶活性抑制率为29.97%±3.30%,与空白对照相比在P<0.05水平上具有统计学意义。实验组中,使用不同浓度的发酵液鱼胚酪氨酸酶活性抑制率均显著高于空白对照组。在2.0%使用浓度下,发酵液对鱼胚酪氨酸酶活性抑制率为35.38±5.68%,显著高于空白对照组和阳性对照熊果苷。
3 讨论
薏苡仁因其含有丰富的营养及活性成分,成为保健品市场最畅销的产品之一,为此,国际上也越来越重视薏苡仁的研究与开发。目前薏苡仁的研究多集中在药物开发和初加工产品方面,如薏米粉及制品、薏米饮料、薏米调味品等[30]。薏苡仁中的碳水化合物90%以上为支链淀粉,不利于乳酸菌的直接吸收利用[30]。因此,本实验在薏苡仁发酵基质的制备过程中通过糊化和糖化处理有效的将淀粉转化为小分子糖,可大幅提高乳酸菌的利用。
通过比较分析发酵液理化成分变化,发现L.b组和复合三菌发酵液的酸度值降幅最大,总酸和有机酸生成量也显著高于L.l组和S.t组单菌发酵液,表明前两组乳酸菌在薏苡仁发酵体系中的发酵空间优于后两组。体外活性方面,各组发酵液的抗氧化能力和酪氨酸酶活抑制率均较发酵前有明显提高,尽管各组发酵液在抗氧化能力方面无显著区别,但在酪氨酸酶活抑制率方面复合三菌发酵液显著高于3种单菌发酵液。不同菌组发酵液的总酸和有机酸含量与其钝化酪氨酸酶活效果表现出较高一致性。先前有研究报道,籽瓜瓤中的维生素C、苹果酸、柠檬酸及其复合有机酸和粗多糖均有钝化酪氨酸酶的能力,且随浓度增加而提高[31-32]。体外功效评价结果表明,2.0%复合三菌发酵液可显著减少斑马鱼体表黑色素的沉积,进一步实验发现其可通过抑制黑色素上游合成途径中的关键酶酪氨酸酶活性进而使黑色素合成受到抑制。由此推测,本实验所得薏苡仁发酵液抑制酪氨酸酶活的主要活性成分可能为有机酸物质,此外薏苡仁中特有的薏苡仁多糖A/B/C及薏苡仁素、甾醇类、多酚及三萜化合物对酪氨酸酶活的抑制作用也值得进一步关注。
本实验对优选的复合多菌发酵过程中生物量和优势菌群结构进行了分析。其中,总生物量在发酵前期呈指数增加,发酵液酸度也大幅增强,高通量测序结果表明乳酸乳球菌在此阶段的相对丰度明显提高,同嗜热链球菌作为发酵前期的优势菌。随着发酵进入中后期,发酵液酸度进一步增强,保加利亚乳杆菌逐渐取代乳酸乳球菌和嗜热链球菌而成为优势菌。有报道指出,在嗜热链球菌和保加利亚乳杆菌并存时,保加利亚乳杆菌因具有较强的蛋白质分解能力,可为嗜热链球菌提供生长所需的甲硫氨酸、组氨酸和脯氨酸等多种氨基酸和多肽;而嗜热链球菌则具有产酸较快的特点,其代谢产物包括甲酸、丙酮酸、叶酸等多种有机酸,可促进保加利亚乳杆菌对嘌呤和氨基酸的合成[14,29]。两者间的共生关系决定了复合发酵初期以嗜热链球菌生长为主,后期则以保加利亚乳杆菌生长为主[30],这与本实验结果相近。乳酸乳球菌因发酵环境温度高于其最适生长温度以及发酵液酸度值递增,其生长逐渐受阻而表现出前期生长快后期增长缓慢的趋势。
综上所述,乳酸乳球菌、嗜热链球菌和保加利亚乳杆菌三菌复合发酵所得薏苡仁发酵液具有较好的清除羟自由基和抑制酪氨酸酶活性的能力,并可通过钝化酪氨酸酶活性达到抑制斑马鱼体表黑色素生成的作用。研究结果可为研发乳酸菌发酵薏苡仁功能性高值化新产品及其工业化生产提供理论依据和技术支撑。

