二甲双胍对胶质母细胞瘤细胞的抑制作用研究
孙梦婷,赵鹏翔,仪杨,王濛,谢飞,ADZAVON Yao Mawulikplimi,刘梦昱
北京工业大学环境与生命学部,北京 100124
在成人脑肿瘤中,胶质母细胞瘤(glioblastoma,GBM)是最常见且恶性程度最高的肿瘤。根据GBM独特的组织学特征,即肿瘤坏死区及内皮细胞增殖程度,世界卫生组织将其归类为最高级别Ⅳ级脑肿瘤(Lah,Novak and Breznik)[1]。确诊后,GBM患者的生存期一般只有15个月左右[2]。GBM分为原发性GBM和继发性GBM,两类GBM具有不同的分子发生机制。在老年患者中,GBM主要为原发性肿瘤,该类患者未曾患有恶性程度较轻的脑肿瘤。继发性GBM来源于低等级脑胶质瘤的复发[3]。GBM的标准治疗手段为最大程度安全地进行手术切除联合放化疗治疗[4]。替莫唑胺作为小分子药物能够穿过血脑屏障,一直作为一线用药应用于GBM的临床治疗中,近年来随着抗肿瘤药物的研究发展,贝伐珠单抗、洛莫司丁以及肿瘤电场治疗也可作为辅助治疗手段参与到GBM的治疗中[5-7]。然而,尽管胶质母细胞瘤的治疗方法在不断进步,患者五年生存率仍低于10%[8],因此新的治疗方法以及抗肿瘤药物亟待研发。
二甲双胍(metformin hydrochloride,MET)是治疗2型糖尿病的一线双胍类药物[9]。二甲双胍在不同疾病中显示出了多效性,提示其不依赖于控制血糖而对多种组织器官产生作用。二甲双胍的亲水及亲脂性使其可以高度溶解于无机液相介质中,且易与膜脂质结构结合,使得二甲双胍可轻易穿过血脑屏障[10]。Labuzek等[11]研究发现全身炎症Wistar大鼠模型口服二甲双胍后,药物可透过血脑屏障,在脑不同部位的血药浓度均在μmol范围内。针对多种疾病的多项临床研究发现,二甲双胍经注射给药后血药浓度均在40μmol·L-1内,符合药理学血药浓度标准,为二甲双胍抗胶质母细胞瘤治疗提供了实验基础。研究表明二甲双胍的抗肿瘤作用机制包括AMPK依赖或AMPK非依赖方式[12]。二甲双胍能够通过激活细胞AMPK抑制下游mTOR信号通路而具有潜在的抗肿瘤作用。而AMPK非依赖在体内的作用包括降低胰岛素、抑制炎症信号以及增强脂联素等,这些变化在肿瘤的生成过程中均具有重要的调控作用[13-14]。近年来多项研究结果显示,二甲双胍在多类良性或恶性肿瘤中发挥了抑制作用,在结肠癌、乳腺癌以及前列腺癌的治疗效果中得到了证实[14-16]。因此,本研究选择多种胶质母细胞瘤细胞系作为研究对象,探讨二甲双胍在体外是否对不同胶质母细胞瘤细胞具有抑制作用,以期为进一步开展二甲双胍治疗胶质母细胞瘤的研究提供更多依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞小鼠源胶质瘤细胞株(GL261)购自北京协和医院细胞库;大鼠源胶质瘤细胞株(C6)购自国家实验细胞资源共享平台(北京总部);人源胶质瘤细胞株(U87MG)来源于北京陆军总医院附属八一脑科医院。
1.1.2 试剂二甲双胍盐酸盐(美国Sigma公司);DMEM高糖培养基、青链霉素、胎牛血清、0.25%胰蛋白酶(美国Hyclone公司);CCK-8试剂盒、CCK-L试剂盒(日本Dojiodo公司);NucGreen Dead488ReadyProbes(美国Thermo Fisher公司);细胞全蛋白提取试剂盒(上海生工生物工程有限公司);SDS-PAGE凝胶制备试剂盒(北京庄盟国际生物基因科技有限公司);p-Akt、Akt抗体(美国CST公司);β-actin抗体(美国Proteintech公司);荧光二抗(鼠抗、兔抗)(美国KPL公司)。
1.1.3 实验仪器CO2细胞培养箱(美国Thermo Fisher公司);光学(荧光)倒置显微镜(日本Olympus公司);低速离心机(江苏瑞江分析仪器有限公司);高速离心机(美国EPPENDORF公司);六合一酶标仪、核酸电泳仪(美国BIO-RAD公司);Odyssay凝胶成像仪(美国LI-COR公司);细胞实时成像系统(美国BioTex公司)。
1.2 实验方法
1.2.1 细胞培养含10% FBS和1%链青霉素的DMEM高糖完全培养基,37℃、5% CO2培养。隔天更换培养基,每3天传代1次,传代比例为1∶3。
1.2.2 CCK-8法检测细胞增殖活性将处于对数生长期的细胞按3×103个·孔-1接种于96孔板内,贴壁24 h。显微镜下观察到细胞贴壁并且生长良好时,加入完全培养基(0 mmol·L-1)和含不同浓度二甲双胍(2、4、6、8、10 mmol·L-1)的完全培养基,作用时间分别为24、48、72 h。每孔按照体系体积的10%加入CCK-8试剂,培养箱中避光孵育2 h,在波长450 nm处检测吸光度,按照公式(1)计算细胞相对增殖活性(细胞存活率)。

式中,As:实验孔(含有细胞的培养基、CCK-8、待测物质)吸光度值;Ac:对照孔(含有细胞的培养基、CCK-8、无待测物质)吸光度值;Ab:空白孔(不含细胞和待测物质的培养基、CCK-8)吸光度值。
1.2.3 活细胞实时成像实验细胞接种密度及实验分组同1.2.2,同时将75%乙醇处理细胞5 min设置阳性对照组。GL261、C6按照以下分组:对照组(CTRL组)、实验组(MET组,6 mmol·L-1)。U87MG按照以下分组:对照组(CTRL组)、实验组(MET组,8 mmol·L-1)。NucGreen Dead 488 ReadyProbes染料和培养基比例为1∶400。按照实验分组加入培养基及染料,避光放入活细胞成像系统监测48 h,观察凋亡情况。
1.2.4 平板克隆实验 将细胞按照GL261(100个·孔-1)、C6(200个·孔-1)、U87MG(200个·孔-1)的细胞密度接种于24孔板。GL261、C6按照以下分组:对照组(CTRL组)、实验组(MET组,6 mmo·lL-1)、实验组(MET组,8 mmol·L-1);U87MG按照以下分组:对照组(CTRL组)、实验组(MET组,8 mmol·L-1)、实验组(MET组,10 mmol·L-1)。连续培养7 d,隔天更换培养基,单个细胞克隆达到50个左右,4%多聚甲醛固定,0.1%结晶紫染色,拍照。4倍显微镜观察细胞团状态,并按照公式(2)计算克隆形成率。

1.2.5 活细胞ATP检测细胞接种密度同1.2.2,分组同1.2.3,作用时间为48 h。每孔加入100μL CCK-L工作液,25℃避光孵育10 min,酶标仪全波长检测相对光强度(relative light unit,RLU)。
1.2.6 Western blot实验分组同1.2.3,二甲双胍处理12、24、48 h后收集细胞。参照试剂盒操作说明提取细胞全蛋白,考马斯亮蓝法测蛋白浓度,上样量为40μg,SDS-PAGE凝胶电泳,湿法转膜至硝酸纤维素膜。5% BSA或5%脱脂牛奶室温封闭。一抗p-Akt(1∶1 000)、Akt(1∶1 000)、β-actin(1∶8 000)孵育。荧光二抗(1∶10 000)孵育,LI-COR成像系统直接扫描,Odyssey软件统计灰度值。
1.3 统计学方法
本研究均采用GraphPad Prism 9.0.0进行统计学分析,数据以平均值±SEM表示,组间差异比较采用t检验(t-test)、单因素方差分析(one-way ANOVA)或双因素方差分析(two-way ANOVA),组间比较P<0.05、P<0.001、P<0.000 1表示差异有统计学意义。
2 结果与分析
2.1 二甲双胍对GBM细胞增殖的影响
2.1.1 二甲双胍对不同GBM细胞增殖活性的影响CCK-8实验结果如图1所示:与对照组(0 mmol·L-1)相 比,二 甲 双 胍 在 较 低浓 度2~4 mmol·L-1时,对各组GBM细胞的活性无明显抑制作用,在较高浓度时(≥6 mmol·L-1)对各组GBM细胞增殖水平均产生了明显的抑制作用。CCK-8结果发现,不同GBM细胞对二甲双胍的药物敏感性不同,二甲双胍药物作用时间不同也对GBM细胞活性产生了不同的影响。如图1所示,与GL261、C6相比,U87MG具有较高的耐药性,二甲双胍浓度达到8 mmol·L-1且作用时间48 h后,U87MG细胞相对活性为54.268%±4.442%。对于C6细胞,随着药物浓度增加及作用时间增加对细胞增殖的抑制作用逐渐增强。GL261增殖能力较强,二甲双胍作用时间达到72 h,药物对细胞的抑制能力显著降低,药物作用48 h对GL261细胞U87MG细胞具有较强的抑制作用。综上,二甲双胍作用48 h对各组GBM细胞均产生了抑制作用,各组细胞半数抑制率药物浓度(IC50)及作用 时 间 为:U87MG,8 mmol·L-1作 用 时 间48 h(54.268%±4.442%);C6,6 mmol·L-1作用时间48 h(53.388%±1.521%);GL261,4 mmol·L-1作用时间48 h(58.9175%±9.670%)。
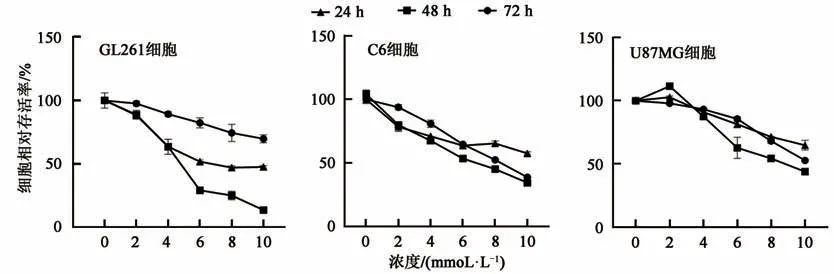
图1 二甲双胍对GBM细胞的增殖活性的影响Fig.1 Effect of MET on proliferation activity of GBM cells
2.1.2 二甲双胍对GBM细胞形态学变化的影响10倍显微镜下观察GBM细胞形态,结果如图2所示:与对照组相比,MET组视野中GL261、C6和U87MG细胞变圆、皱缩细胞数量增加,细胞密度降低。这与CCK-8实验结果相对应,证明二甲双胍明显抑制各GBM细胞的增殖和生长。

图2 二甲双胍对GBM细胞形态的影响(×10)Fig.2 Effect of MET on GBM cell morphology
2.2 二甲双胍对GBM细胞凋亡水平的影响
NucGreen Dead 488 ReadyProbes染料可与凋亡细胞的核DNA结合,发出绿色荧光,对生长状态正常的细胞无影响。10倍显微镜下观察发现(图3),MET可在24 h内有效促进U87MG细胞凋亡,而对GL261和C6细胞凋亡促进作用无明显变化;48 h内可有效促进3种GBM细胞大量凋亡,明场中3种GBM细胞的数量无明显变化,说明二甲双胍能够显著抑制GBM细胞增殖。由于不同GBM细胞自身代谢水平及增殖水平的差别,MET对不同GBM细胞发挥促凋亡作用的时间不同,促进GBM凋亡的具体分子机制尚需进一步实验验证。
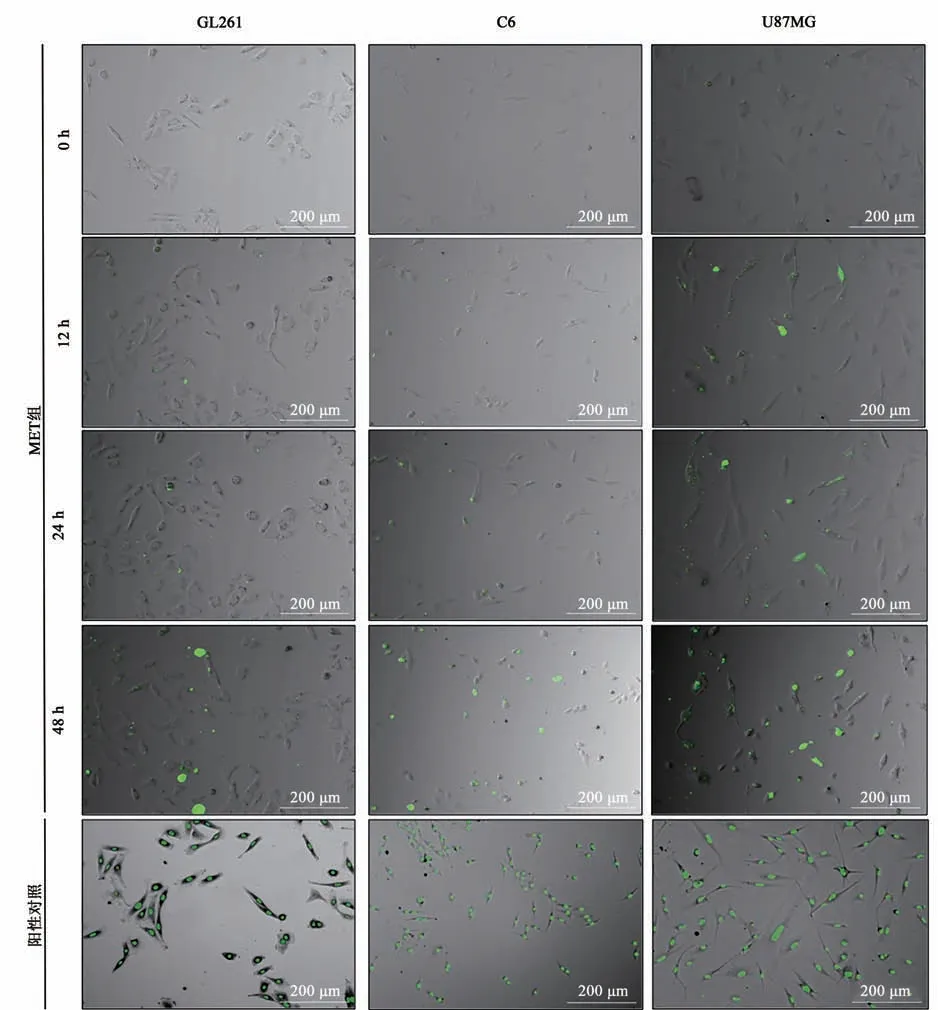
图3 二甲双胍对GBM细胞凋亡水平的影响Fig.3 Effect of MET on apoptosis of GBM cells
2.3 二甲双胍对GBM细胞克隆形成的影响
二甲双胍分别处理GL261、C6和U87MG细胞7 d后,如图4所示,克隆形成实验结果显示二甲双胍处理后的GBM细胞形成克隆数与对照组相比差异均具有统计学意义(P<0.001),MET组细胞克隆能力明显低于对照组,且随着作用浓度增加,二甲双胍对GBM细胞的抑制作用增强,形成的克隆细胞团内细胞数目也显著减少。4倍显微镜下观察克隆细胞团形态发现,与对照组相比,MET组中GBM形成细胞团的能力明显降低,克隆细胞团中细胞间空隙明显增大(图5)。综上,证明二甲双胍能够有效抑制GBM细胞的克隆形成能力,并具有一定的剂量依赖性。
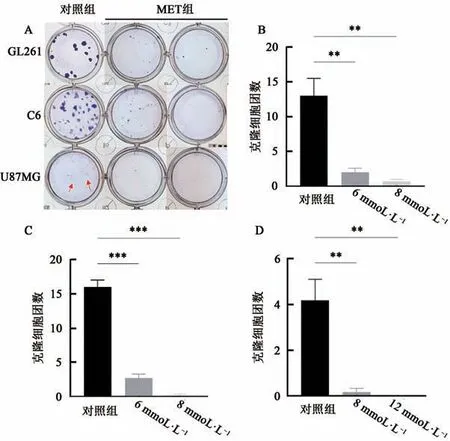
图4 二甲双胍对GBM细胞克隆形成的影响Fig.4 Effects of MET on the formation of GBM cell clonies
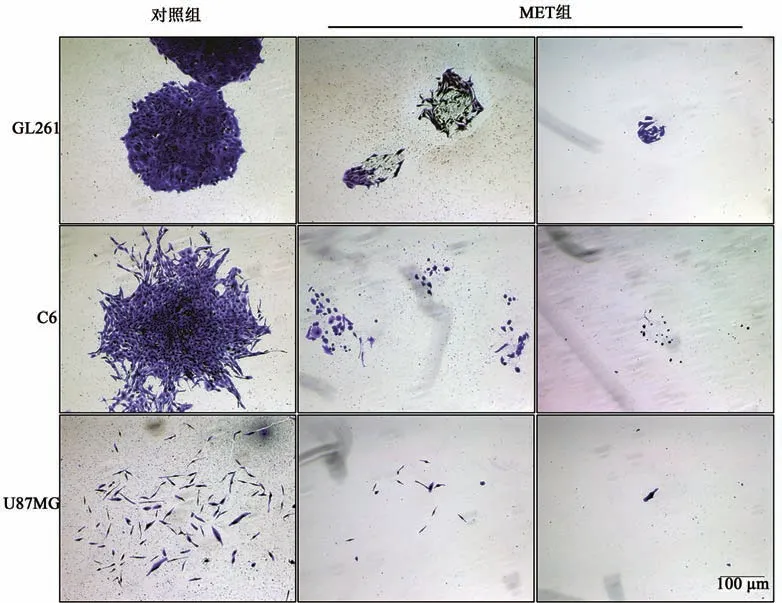
图5 二甲双胍对GBM克隆细胞团形态的影响Fig.5 Effect of MET on cell cluster morphology of GBM clonies
2.4 二甲双胍对GBM细胞内ATP水平的影响
研究表明二甲双胍能够通过抑制线粒体复合物Ⅰ对细胞产生抑制作用,本研究通过化学发光法(CCK-L)对GBM细胞的活细胞内线粒体产生的ATP水平进行检测。与对照组相比,MET组的相对光强度(RLU)明显降低(图6)。ATP作为细胞的能量货币,直接为细胞代谢提供能源,结果证明二甲双胍能够显著抑制各GBM细胞内线粒体产生ATP,从能量来源处抑制了细胞增殖及生长。

图6 二甲双胍对GBM细胞内ATP水平的影响Fig.6 Effect of MET on intracellular ATP level in GBM cells
2.5 二甲双胍对GBM细胞Akt及磷酸化水平的影响
检测不同时间点下二甲双胍作用对GBM细胞中p-Akt、Akt表达的影响,如图7所示:与各自时间点的对照组相比,随着二甲双胍作用时间延长,3种GBM细胞内p-Akt表达在12 h并未出现显著差异,在24 h出现显著下调(P<0.000 1);48 h仅C6细胞内p-Akt表达下调明显(P<0.05),其余细胞Akt表达水平在12~48 h内并未出现显著差异,证明二甲双胍通过抑制Akt磷酸化进而抑制GBM细胞内Akt活化,对p-Akt表达具有短效性作用,且无时间依赖性。

图7 二甲双胍对Akt及其磷酸化水平的影响Fig.7 Effect of MET on Akt and its phosphorylation level
3 讨论
近年来研究发现二甲双胍可能具有新的作用,不仅能够因其具有降糖作用而成为2型糖尿病的一线用药,同时在临床应用上还发现其对肿瘤有抑制作用。其作用效果在多种肿瘤中得到验证,如乳腺癌、前列腺癌、结直肠癌以及脑胶质瘤[17]。而GBM作为恶性程度最高的脑胶质瘤,患者可选择的治疗方案十分有限,且效果甚微。研究表明,放疗和化疗或可提高标准治疗效果,大量临床病例也显示联合放化疗治疗方法会抑制肿瘤生长和限制复发,从而使挽救病人生命成为可能,然而治疗后GBM患者的5年生存率仍难以提高[18]。在抗脑胶质瘤的体内外实验中,二甲双胍常与其他药物,例如替莫唑胺、二氯乙酸(DCA)等联合作用于U251、T98等胶质瘤细胞系或C57BL/6小鼠GL261移植瘤模型进行研究[19-21]。本研究结果与上述文献中的结果一致,证明了二甲双胍可有效地抑制不同GBM细胞的增殖能力,且有一定浓度依赖性。本研究中CCK-8结果确定了不同GBM细胞适合的药物作用浓度。实时细胞检测GBM细胞的动态生长状况进一步验证了二甲双胍作用后促进GBM细胞凋亡的有效作用时间,为进一步的实验研究提供了最重要的理论基础。已有研究结果表明,在不同GBM细胞中二甲双胍作用浓度不同,提示种属、组织与恶性程度不同的GBM细胞的增殖及代谢水平不同,使得二甲双胍抑制肿瘤细胞的有效浓度不同。本研究仅在体外探究了二甲双胍单独作用于GBM细胞的作用效果,未结合体外实验,且二甲双胍作用机制十分复杂,许多二甲双胍抗胶质瘤的相关研究仅局限于多药联合作用的基础实验,将二甲双胍单独应用于体内的实验研究较少。因此,后续将对二甲双胍单独作用动物的体内实验进行研究,并进一步验证二甲双胍在临床研究中的抗肿瘤效应。
尽管研究发现二甲双胍能够对肿瘤细胞的代谢产生影响,但其真正的作用机制尚待研究[22-23]。已有研究表明二甲双胍作用后涉及多种信号通路,包括AMPK、mTOR、REDD1以及细胞内线粒体呼吸链及氧化应激的调控[24-27]。本研究首先对GBM细胞内线粒体产生的ATP水平进行检测,发现二甲双胍作用后,不同GBM细胞内ATP水平均显著降低,证明了二甲双胍对肿瘤细胞代谢功能的抑制作用。Akt是肿瘤细胞信号通路中重要的调控因子,该因子通过自身磷酸化和去磷酸化调控下游信号转导,从而影响细胞能量代谢水平,并与体内多种肿瘤细胞的增殖、分化、迁移和凋亡过程等相关。本研究结果证明二甲双胍作用后,多种GBM细胞内Akt磷酸化水平显著降低。
综上所述,二甲双胍可抑制多种GBM细胞的增殖,降低Akt磷酸化水平,其机制或与细胞内ATP水平降低密切相关,本研究结果为二甲双胍用于GBM的防治及GBM患者治疗提供了新的思路与途径。

