宏观辨识与微观探析在盐类水解教学中的实践研究
闫佳琪
(吉林师范大学 化学学院,吉林四平 136000)
化学核心素养的研究近几年来热度越来越高,如何将化学核心素养真正落实到课堂实践是一线教师亟待解决的问题。化学核心素养中宏观辨识与微观探析旨在从宏观和微观相结合的角度认识物理和化学变化[1]。在学习目标描述上,学生能从学科观念进阶到能够掌握分析解决问题的方法,这种学习目标的进阶会不断促进学生学科问题解决的思维视角养成[2]。在盐类的水解教学中,比较离子大小一直是学生的难点问题。通过基于宏观辨识与微观探析教学设计帮助学生真正解决这一难题。
1 教材与学情分析
1.1 教材分析
本节内容选自人教版选修四第三章第三节。首先学生在之前的化学平衡知识的学习中已经掌握了平衡移动的知识,由此知识迁移到水溶液中离子平衡问题就会比较轻松地理解这些知识点。通过建立宏观和微观的化学核心素养让学生在理解盐类水解过程中存在盐先电离再水解的过程。通过具体的教学过程探究,让学生构建出易溶于水且易电离的盐的电离是宏观过程,产生的离子是宏观离子。弱酸根和弱碱根的水解是微观的过程,产生的离子是微观离子。由此真正理解离子浓度大小比较的依据是什么。本节课内容是在学生已经学习了盐类水解的基本概念和规律,以及水解的离子方程式的基础上进一步对水解的本质进行探究,通过对离子浓度大小的比较可以进一步深化化学核心素养的认知和加深对盐类水解本质的理解。
1.2 学情分析
(1)学习了盐类水解的基本概念、水解规律、水解平衡移动、盐类水解离子方程式。
(2)通过宏观辨识与微观探析的构建解决离子浓度大小比较的问题。
1.3 存在的问题
对于较复杂的电解质溶液粒子种类的判断、比较离子浓度大小存在知识障碍。
2 设计思路
以宏观辨识与微观探析核心素养的培养为主线,让学生理解在水溶液中哪些离子是宏观离子,哪些离子是微观离子。通过学生活动探究,让学生自己总结出,易溶于水且易电离的强电解质电离出的离子在水溶液中可以归纳为宏观离子。难溶于水或者难电离的弱电解质电离出的离子可以归纳为微观离子。弱酸根和弱碱根的水解产生的离子是微观离子。由此在比较时归纳为宏观离子远远大于微观离子,先对电离水解过程进行排序,一般过程为:易溶于水且易电离的强电解质电离>弱电解质电离>盐类的水解>水的电离,将浓度大小比较总结为“细判断”“先宏观”“再微观”的三步比较法。即通过活动探究培养学生的核心素养,让学生真正理解浓度大小比较的核心素养内涵,也通过三部比较法解决学生做题的难点问题。
3 教学设计
3.1 情境导入
【提问】前面我们学了电解质的电离,强电解质的电离是完全电离,一步电离。弱电解质的电离是部分电离,因此弱酸根和弱碱根有结合氢离子和氢氧根生成弱酸和弱碱的能力。由此知道盐的水解本质是盐类物质电离产生的弱酸根和弱碱根结合水产生的氢离子和氢氧根生成弱酸和弱碱。因此我们学会了书写盐类的水解方程式,进一步会判断溶液中存在哪些离子,那么这些离子浓度大小的判断成为我们这节课研究的主要问题。
3.2 活动一:单一溶液中离子浓度的大小比较
【讨论】在氯化铵溶液和碳酸钠溶液中,离子浓度大小如何比较?有何规律?
(1)氯化铵溶液。
【交流】NH4Cl在水溶液中是先电离再水解的过程。

由此先排序是宏观>微观1>微观2(逐渐培养学生的宏观微观构建意识)
NH4Cl是强电解质且易溶于水,由此电离出的Cl-是宏观离子,而H2O是弱电解质,电离出的H+,OH-是微观离子。由此可知盐类的水解电离平衡常数是大于水的电离平衡常数的,因此微观1大于微观2(微观的比较是根据平衡常数大小来进行排序比较的)。先比较宏观离子浓度大小关系,其中会水解导致浓度降低,由此微观离子中,本来H+、OH-浓度相等,但是水解产生 H+,导致c(H+)>c(OH-)。
【交流】根据其电离和水解程度的相对大小,确定氯化铵溶液中离子浓度由大到小的顺序是c(Cl-)>c(H+)>c(NH3·H2O)>c(OH-)[3]。
(2)碳酸钠溶液
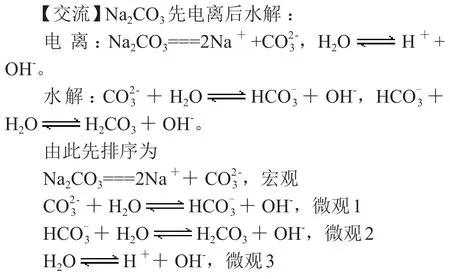
由此排序为宏观>微观1>微观2>微观3(微观的排序也是通过平衡常数的大小来排序)。
其中Na+和是宏观离子,二者本来是二倍关系,但是由于水解导致浓度变小,所以H+是微观3产生的离子,所以排在最后。

【强调】先排序再比较,宏观产生的离子大于微观,微观1产生的离子大于微观2。
(3)醋酸溶液
【交流】醋酸溶液离子浓度大小比较
弱酸弱碱溶液中,弱酸弱碱的电离是大于水的电离的,由此先排序:

首先明确CH3COOH是宏观粒子,因为它的电离是微量的,而它电离产生的微观离子中,微观1大于微观2,因此在溶液中产生的离子中微观1产生的CH3COO-和H+是大于微观2产生的OH-的,而H+和CH3COO-本应相等,但是微观2又增加了一部分导致c(H+)>c(CH3COO-)。
在溶液中微粒浓度由大到小的顺序:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)。
醋酸钠溶液
【交流】CH3COONa溶液中:

所以 CH3COONa溶液中:CH3COO-,Na+是宏观离子,CH3COOH,OH-是微观1产生的离子,H+,OH-是微观2产生的离子。c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)。

对于这种多元弱酸根既电离也水解的,我们需要明确是电离大于水解还是水解大于电离,根据题意,溶液显碱性,因此水解大于电离。所以微观1是多元弱酸根的水解,微观2是多元弱酸根的电离。

【例题】常温下pH<7的NaHSO3中浓度最小的离子是( )

【答案】B
【解析】NaHSO3是强电解质,因此电离产生的Na+和是宏观离子,在溶液中既会水解也会电离,水解溶液显酸性,电离显酸性,由于pH<7所以电离大于水解,由此排序如下:
由此浓度最小的是微观3产生的OH-,由于H+在微观2产生,c(H+)>c(OH-)。
3.3 活动二:混合溶液中离子浓度的大小比较
【讨论】0.1mol/L的NaOH溶液和0.1mol/L NH4Cl 溶液等体积混合,混合溶液中各离子浓度大小关系如何?
【交流】二者混合发生如下反应,NH4Cl+NaOH===NH3·H2O + NaCl,由此生成了0.1mol/L的NH3·H2O和NaCl溶液(先判断溶液发生哪些反应,再判断那些电离和水解过程),在混合溶液中有Na+、Cl-、NH+4、OH-、H+,NaCl强电解质,NH3·H2O 弱电解质,在溶液中发生如下反应:

【讨论】0.1mol/L的NH4Cl溶液和氨水等体积混合后,pH>7,溶液中离子浓度大小比较。
【交流】二者混合后,首先NH4Cl电离出和Cl-,氨水电离出和OH-,然后水解产生NH3·H2O和H+。由于pH>7,所以电离大于水解,电离排在水解之前,由此先排序:


【问题探究】等体积等物质的量浓度的CH3COONa溶液和NaClO溶液混合后,溶液中离子浓度大小关系是什么?{已知常温:Ka(CH3COOH)>Ka(HClO)}
【讨论】弱酸弱碱的电离和盐类的水解是大于水的电离的,由此排序如下:

由此排序为宏观1=宏观2>微观1>微观2>微观3。
由此得出:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+)[4]。
【归纳小结】最终小组讨论总结出盐类水解中溶液离子浓度大小比较规律如下:
(1)先排序,易溶于水的强电解质的电离是宏观过程,弱电解质的电离是微观过程,弱酸根和弱碱根的水解是微观过程,水的电离是微观过程,由此一般排序为:
强电解质(易溶于水)的电离>弱电解质的电离>弱酸根和弱碱根的水解>水的电离.
其中多元弱酸根分步水解Kh1>Kh2,排序根据水解平衡常数判断。
(2)再比较,宏观产生的离子浓度>微观1产生的离子浓度>微观2产生的离子浓度,由此可以排出顺序。
3.4 课堂总结
学生在分析离子浓度大小时,通过让学生真正理解电解质在水中是先溶解再电离的过程。由此产生的离子是有宏观,微观的区分的。通过真正掌握如何判断宏观微观离子,通过三步法解决大小比较的问题,并且在这一过程中提升了对从微观水平又进阶到宏微结合水平,既解决了问题也提升了综合素养。
3.5 板书设计—盐类的水解
3.5.1 单一溶液中离子浓度的大小比较
(1)先电离后水解,强电解质电离是宏观过程,产生的离子是宏观离子,弱电解质电离是微观过程,所以产生的离子是微观离子。
(2)弱酸根和弱碱根的水解是微观过程,产生的离子是微观粒子。
(3)水的电离是微观过程,产生的粒子是微观离子。
3.5.2 混合溶液中离子浓度的大小比较
(1)先判断溶液混合以后发生那些变化,有些溶质会反应,有些是先电离再水解。
(2)根据题目有效信息包括酸碱性等信息判断宏观过程有哪些,微观过程有哪些,然后将过程排序,一般顺序为:
强电解质电离(易溶于水)>弱电解质电离>弱酸根或弱碱根的水解>水的电离
(3)根据顺序依次比较
4 结语
核心素养的提出,是教育对人的全面回归。核心素养指人适应信息时代和知识社会的需要,解决复杂问题和适应不可预测情境的高级能力和人性能力。核心素养体系的构建,成为顺应国际教育改革趋势,增强国家核心竞争力,提升我国人才培养质量的关键环节。化学核心素养是学生核心素养中的一部分,本次教学设计基于宏观辨识与微观探析在学生活动探究的基础上总结出三步法,先宏观再微观帮助学生理解如何比较离子浓度,并提升了学生的核心素养。

