调控高稳定CAU-10-X(X=H、NO2、CH3)孔化学环境以实现N2O高效捕获
张迎迎 张飞飞 马 蕾 王 丽 杨江峰
(太原理工大学化学工程与技术学院,气体能源高效清洁利用山西省重点实验室,太原 030024)
0 引言
全球气温的急剧上升,带来了极端天气等一系列环境问题,而人类大规模的工业活动使得大气中二氧化碳(CO2)、甲烷(CH4)和氧化亚氮(N2O)等温室气体的含量增加,导致全球温室效应[1]。其中,N2O的影响仅次于CO2和CH4,其全球变暖潜力是CO2的310倍;空气中N2O含量的升高会带来严重的臭氧损耗,对地球的臭氧层产生破坏[2-3];此外,还是酸雨和光化学污染等环境问题的诱因之一[4-5]。同时,N2O也是一种重要的工业气体,具有较高的实用价值,例如在医药、食品、航空航天等领域中用作麻醉剂、发泡剂和助燃剂等[6-8]。鉴于N2O大量排放带来的环境危害及其潜在的经济价值,近年来,N2O的捕集和利用引起了各个领域研究人员的广泛关注[6,9]。N2O总排放量的40%来自于人类活动,主要包括农业、交通和工业活动[10-12]。在工业上,N2O作为己二酸、硝酸和尼龙生产过程中的副产品被直接排放到空气中[10,13]。目前,工业N2O废气的处理方法主要有2种:一是直接将N2O分解成N2和O2[12];二是将 N2O作为氧化剂使用,例如,在苯酚生产中,N2O可以一步将苯氧化成苯酚[14]。然而,由于N2O高的动力学稳定性,以上2种处理策略均会带来较高的能耗[9]。而且,现存的策略主要以处理N2O作为主要目标,并不能获得有价值的N2O产品。因此,探索经济高效的N2O捕集和富集方法至关重要。
吸附分离技术因其成本低、操作简单等独特优势,被认为是一种高效节能的分离技术[15],其分离的关键在于高选择性的吸附剂。目前,多种吸附剂,包括沸石分子筛、活性炭材料和金属有机骨架(MOFs)材料均已被用于N2O的捕集研究中[16-18],其中MOFs材料因其高且可调节的孔隙率、超高比表面积、结构多样性和易于化学改性等优点引起诸多关注[19-20]。研究者已发现多种可用于N2O吸附的MOF材料,包括 MOF-5[18]、Ni-MOF[21]、HKUST-1[22]、ZIF-8[22]、UiO-66[22]、ZIF-7[23]、MIL-100(Cr)[24]和 MIL-100(Fe)[25]。其中本课题组通过对高度稳定的MIL-100Cr中Cr3+空位进行激活,实现了对N2O的高效捕获,其中,MIL-100Cr-250在298 K下对N2O的吸附量高达5.78 mmol·g-1,是目前报道的最高值,而且该材料表现出较高的N2O/N2选择性[24]。
MOFs材料的取代基/氨基调控被认为是一种有效的孔表面化学性质调控策略,通过该策略可以调整材料的孔化学性质,从而改变MOFs材料对小分子 气 体 (例 如 N2、O2、CH4、CO2和 N2O)的 吸 附 能力[26-27]。本课题组[22]通过乙二胺功能化MIL-100(Cr),成功在MIL-100(Cr)中构建了新的碱性吸附位点,实现了CO2与N2O的吸附分离。此外,通过取代基调控,构筑了4种具有不同取代基(—X)的MIL-101(Cr)-X(X=H、NO2、CH3)[28],该类材料表现出不同的N2O吸附能力,密度泛函理论计算表明,供电子基团(—NH2)中N的存在是提高材料N2O吸附能力的主要原因。
作为一种高稳定性的Al-MOF,CAU-10因其配体廉价易得、合成条件温和,被认为是一种极具工业前景的MOF材料[29]。CAU-10的三维结构是由顺式连接的AlO6多面体通过间苯二甲酸根的羧酸基团交替旋转连接形成的(图1,X代表指向空隙的基团)[29],因此,可通过改变取代基的方法来调节孔径和孔道表面化学性质[30]。我们分别利用具有—NO2的5-硝基间苯二甲酸和具有—CH3的5-甲基间苯二甲酸作为配体合成具有不同取代基的CAU-10-NO2与CAU-10-CH3[31],并对其结构进行了表征,系统研究了具有不同取代基的CAU-10对N2O的吸附捕获性能,并针对空气分离装置中存在微量的N2O(0.015%)模拟研究了材料对N2O/N2(0.1%/99.9%,V/V)混合气体的分离性能。

图1 CAU-10-X的结构图Fig.1 Structure diagram of CAU-10-X
1 实验部分
1.1 试 剂
试剂包括十八水合硫酸铝(Al2(SO4)3·18H2O,AR,阿拉丁)、六水合氯化铝(AlCl3·6H2O,AR,阿拉丁)、间苯二甲酸(1,3-H2BDC,AR,阿拉丁)、5-甲基间苯二甲酸(5-CH3-1,3-H2BDC,≥99%,阿拉丁)、5-硝基间苯二甲酸(5-NO2-1,3-H2BDC,98%,阿拉丁)、N,N-二甲基甲酰胺(DMF,AR,国药集团化学试剂有限公司)。实验用水为蒸馏水,以上化学品都是商业上可用的,未经进一步净化处理。
1.2 样品的制备
CAU-10-H、CAU-10-CH3与CAU-10-NO2均参考已报道方法合成[29]。分别将带有不锈钢外壳的聚四氟乙烯反应釜放于408、403、393 K烘箱中反应12 h,反应结束后,将产物进行离心,用去离子水重复洗涤多次,将洗涤后的产物在353 K的烘箱中干燥过夜,最终分别获得白色固体粉末、淡黄色固体粉末与白色固体粉末。
1.3 材料的表征
样品的粉末X射线衍射(PXRD)图在配备Cu Kα靶(λ=0.154 18 nm,V=40 kV,I=40 mA,2θ=5°~50°)的Bruker D8 ADVANCE型X射线衍射仪上进行测定。在Micromeritics ASAP 2020装置上测试样品在77 K下的N2吸附-脱附等温线,为充分脱除孔道中的溶剂分子,样品在测试前需要在473 K、真空条件(10 Pa)下活化 10 h。BET(Barrette-Joyner-Halenda)比表面积由p/p0=0.05~0.3范围内的吸附分支进行计算;样品总孔隙体积在p/p0=0.99时进行计算;样品的微孔体积采用t-plot法进行计算。热重分析(TGA)使用德国STA449 F5热重分析仪进行测试,氮气气氛,加热速率10 K·min-1,温度范围298~1 073 K。
1.4 气体吸附性能与动力学性能测试
N2O(99.999%)和N2(99.999%)在 298和 273 K 下的单组分气体吸附-脱附等温线在Micromeritics ASAP 2460比表面积和孔隙度分析仪上测量。在进行吸附测试之前,将约100 mg吸附剂装入样品池中,并在473 K、真空条件(10 Pa)下活化10 h。在智能重量分析仪(英国,IGA001)上测量了样品的吸附动力学,IGA001可以精确记录材料在气体吸附过程中的重量变化,测试过程:首先在473 K下进行脱气处理,直到没有观察到进一步的失重,然后将系统温度降至设定温度进行测试。
1.5 IAST(理想溶液吸附理论)选择性与吸附热(-Qst)计算
为了考察 CAU-10-X(X=H、NO2、CH3)对 N2O/N2的分离能力,根据单组分气体吸附等温线,对样品在298和273 K下对N2O/N2(50%/50%或0.1%/99.9%,V/V)混合气体的选择性进行了计算,以进一步研究其分离潜力[32]。
为了验证吸附剂与吸附质之间的相互作用,根据273和298 K下的吸附等温线和Clausius-Clapeyron方程计算了吸附剂的-Qst[33]。
1.6 N2O/N2的穿透模拟
穿透模拟可以描述N2O/N2在CAU-10-X(X=H、NO2、CH3)上的吸附过程,此外,还可对 N2O/N2的分离性能进行有效预测,因此使用Aspen Adsorption软件进行穿透模拟。吸附过程使用热量、质量和动量守恒方程来描述;多组分吸附用Langmuir模型描述;吸附速率用线性推动力方程描述。该模拟对复杂的吸附过程进行了理想条件的简化:(1)吸附过程中的气体被认为是理想气体;(2)吸附剂孔隙率与床层空隙率大小被认为是均一的;(3)对于吸附柱中的温度与压力分布,考虑轴向变化,忽略径向扩散。在这种理想条件下根据表1设定的吸附床层及吸附剂参数,在温度为298 K,压力为1×105Pa,流量为5mL·min-1条件下模拟,结果得到塔顶出口处N2O与N2的浓度随时间的变化曲线[34]。
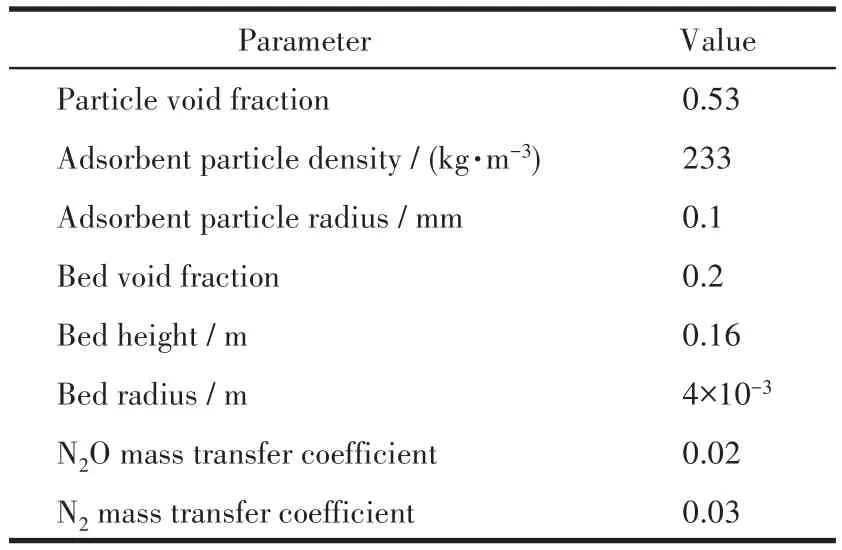
表1 吸附剂及吸附床参数设置Table 1 Parameter setting of adsorbent and adsorption bed
2 结果与讨论
2.1 材料的表征
所得样品的相纯度通过PXRD进行验证,如图2a所示,3种材料所有特征峰均与标准图(PXRD精修)吻合[29],表明样品被成功合成。通过TGA对材料的热稳定性进行了评价,如图2b所示,3种材料均表现出较高的热稳定性。其中CAU-10-CH3的骨架坍塌温度达到700 K,高于CAU-10-NO2(661 K)和CAU-10-H(678 K)。考虑到 CAU-10-NO2和 CAU-10-CH3与CAU-10-H有相同的拓扑结构,且都是Al基MOF,我们猜测导致三者热稳定性差异的主要原因是有机配体的不同。
CAU-10-X(X=H、NO2、CH3)材料的孔容积和孔径分布使用77 K N2作为探针分子进行测定。如图2c所示,CAU-10-H与CAU-10-NO2的N2吸附-脱附等温线均表现为Ⅰ型等温线,在低压阶段,N2吸附量急剧增加,表明CAU-10-H与CAU-10-NO2中均存在微孔,随着相对压力的增加,吸附量上升趋势变得平缓,表明吸附达饱和状态,整个过程中吸附与脱附支基本重合,未出现明显的滞后环。CAU-10-CH3未显示出明显的N2吸附特性,可能是—CH3的引入使得材料的孔径变小,导致N2分子无法正常通过。由表2可知,CAU-10-H、CAU-10-NO2和CAU-10-CH3的比表面积分别为641、486、8 m2·g-1,这与报道的结果相近[35]。使用密度泛函理论模型进一步计算了所得样品的孔径分布,结果如图2d所示,CAU-10-H和CAU-10-NO2均有微孔结构,孔道尺寸分别为0.76、0.59 nm,这说明取代基的引入导致CAU-10-NO2的孔径有所减小,其孔径大小与文献报道基本一致[29]。
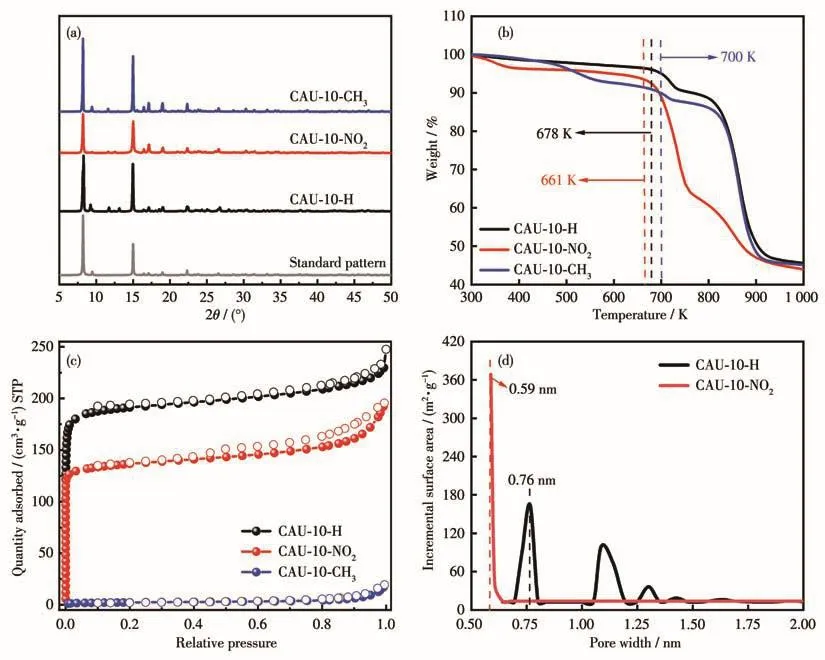
图2 CAU-10-X(X=H、NO2、CH3)的(a)XRD图、(b)TGA曲线和(c)N2吸附-脱附等温线;(d)CAU-10-H和CAU-10-NO2的孔径分布曲线Fig.2 (a)XRD patterns,(b)TGA curves,and(c)N2 adsorption-desorption isotherms of CAU-10-X(X=H,NO2,CH3);(d)Pore size distribution curves of CAU-10-H and CAU-10-NO2

表2 77 K下CAU-10-X(X=H、NO2、CH3)的N2吸附-脱附数据Table 2 N2 adsorption-desorption data of CAU-10-X(X=H,NO2,CH3)at 77 K
2.2 气体吸附性能与动力学分析
为了探索取代基的引入对材料气体吸附性能的影响,测试了CAU-10-X(X=H、NO2、CH3)在273和298 K下对N2O和N2的单组分气体的吸附等温线。如图3所示,在298 K、1×105Pa下,CAU-10-X(X=H、NO2、CH3)对 N2O 的吸附量分别为 67.83、53.83和41.94 cm3·g-1。与 CAU-10-H 相比,CAU-10-NO2和CAU-10-CH3对N2O的吸附量均出现一定的下降,这可能是由于取代基的引入使得材料的孔容变小。同样,在273 K、1×105Pa下N2O的吸附量分别为90.31、73.76和61.22 cm3·g-1,虽然相对298 K下有所提高,但2种温度下具有相同的趋势。CAU-10-NO2在低压(0~2.0×104Pa)下对N2O的吸附量明显高于CAU-10-H。CAU-10-CH3在低压(0~2.0×104Pa)下对N2O的吸附量出现明显的下降。基于以上数据,我们推测—NO2的引入改变了材料局部孔化学环境,进而提高了材料对N2O吸附能力。与N2O不同,取代基的引入并没有对N2吸附产生明显的影响,引入前后对N2的吸附量基本不变。
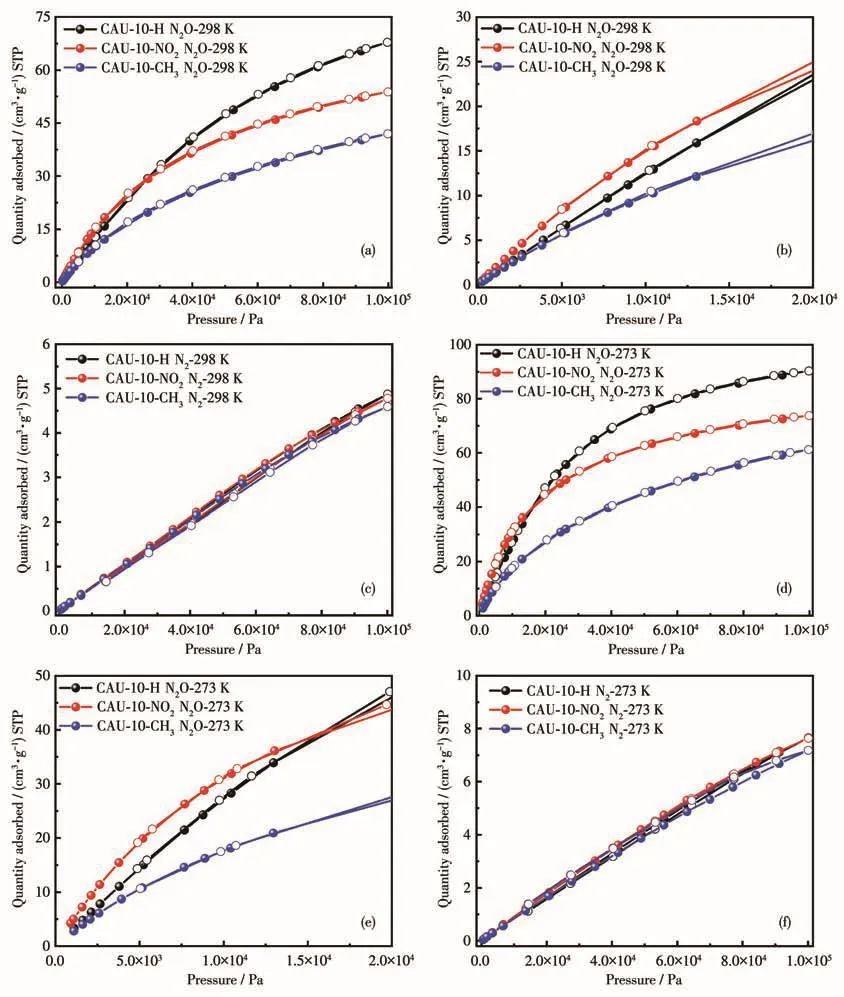
图3 CAU-10-X(X=H、NO2、CH3)的吸附等温线:(a)298 K、0~1×105Pa下的N2O吸附等温线;(b)298 K、0~2.0×104Pa下的N2O吸附等温线;(c)298 K、0~1×105Pa下的N2吸附等温线;(d)273 K、0~1×105Pa下的N2O吸附等温线;(e)273 K、0~2.0×104Pa下的N2O吸附等温线;(f)273 K、0~1×105Pa下的N2吸附等温线Fig.3 Adsorption isotherms of CAU-10-X(X=H,NO2,CH3):(a)N2O adsorption isotherms at 298 K and 0-1×105Pa;(b)N2O adsorption isotherms at 298 K and 0-2.0×104Pa;(c)N2 adsorption isotherms at 298 K and 0-1×105Pa;(d)N2O adsorption isotherms at 273 K and 0-1×105Pa;(e)N2O adsorption isotherms at 273 K and 0-2.0×104Pa;(f)N2 adsorption isotherms at 273 K and 0-1×105Pa
使用IGA001进一步研究了N2O和N2在CAU-10-X(X=H、NO2、CH3)吸附剂上的吸附动力学。从图4中可以看出,3种吸附剂对N2O和N2均表现出相近的吸附速率,CAU-10-NO2和CAU-10-CH3达到吸附平衡的时间略快于CAU-10-H,但相差不大[36],这意味着三者对N2O与N2的动力学选择性相差不大。此外,与CAU-10-H相比,取代基的引入虽然缩小了材料的孔径,但材料对N2O、N2的平衡速率并没有受到明显的影响。材料较快的平衡速率(时间仅20~25 min)保证了其在工业应用中快速的吸脱附循环,对于实现N2O/N2的分离具有巨大的价值。

图4 CAU-10-X(X=H、NO2、CH3)在常压下的吸附动力学曲线Fig.4 Adsorption kinetic curves of CAU-10-X(X=H,NO2,CH3)at normal pressure
2.3 IAST选择性计算
为了评估取代基引入对N2O/N2混合物吸附选择性的影响,对N2O、N2单组分吸附等温线使用双位点Langmuir方程进行拟合,采用IAST对N2O/N2的选择性进行了计算。如图5a所示,CAU-10-X(X=H、NO2、CH3)在 298 K 下的 N2O/N2(50%/50%,V/V)选择性都随压力的增加而增加。在1×105Pa下,CAU-10-NO2的N2O/N2选择性达到64.05,是CAU-10-H的1.64倍(39.03),远高于CAU-10-CH3(32.85)。273 K下3种材料的选择性与298 K时具有相同的规律(图5b)。结合吸附等温线的测试结果可知,—NO2基团的引入使得材料具有更加适合N2O吸附的局部化学环境,CAU-10-NO2在低压区(0~2.0×104Pa)表现出更加陡峭的N2O吸附等温线,进而改善了材料对N2O的选择性。在298 K、1×105Pa下,CAU-10-X(X=H、NO2、CH3)的 N2O/N2(0.1%/99.9%,V/V)选择性分别为27.03、34.82、24.12(图 5a),在 273 K、1×105Pa下,CAU-10-X(X=H、NO2、CH3)的 N2O/N2(0.1%/99.9%,V/V)选择性分别为 43.56、56.95、31.97(图 5b),由此可见,CAU-10-NO2同样具有最高的选择性。表3列出了在298 K和1×105Pa条件下,一些典型MOF对N2O/N2的选择性,由表可知,CAU-10-NO2的选择性低于经典的MIL-100(Cr),但远高于MIL-100(Cr)-NO2。
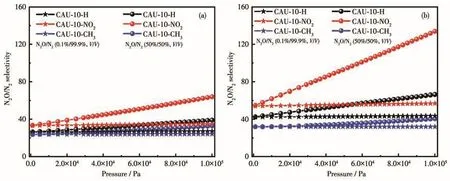
图5 CAU-10-X(X=H、NO2、CH3)的N2O/N2选择性Fig.5 N2O/N2 selectivity on CAU-10-X(X=H,NO2,CH3)

表3 在298 K和1×105Pa条件下一些典型MOF对N2O和N2的吸附量及N2O/N2的选择性Table 3 Adsorption capacities of N2O and N2 and N2O/N2 selectivity on some typical MOFs at 298 K and 1×105Pa

续表3
2.4 -Qst分析
根据材料在273和298 K下的吸附等温线(图3)计算了 CAU-10-X(X=H、NO2、CH3)对 N2O 和 N2的-Qst。从图6中可以看出,三者均表现出较高的对N2O的-Qst。对N2O的-Qst顺序为CAU-10-NO2(30 kJ·mol-1)>CAU-10-H(24 kJ·mol-1)>CAU-10-CH3(21 kJ·mol-1)。其中,CAU-10-NO2对N2O的吸附作用力最强,这很好地解释了上述IAST选择性计算的结论,同时与CAU-10-NO2在低压区展现出的陡峭N2O吸附趋势一致。与N2O相比,3种材料对N2的-Qst介于 12~15 kJ·mol-1之间,远小于对 N2O 的-Qst,说明N2O与骨架之间的相互作用明显强于N2,三者均能够很好地分离N2O/N2混合物。
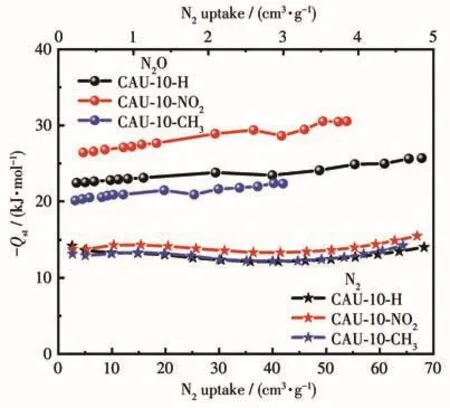
图6 CAU-10-X(X=H、NO2、CH3)在298 K下对N2O和N2的-QstFig.6 -Qstfor N2O and N2 at 298 K of CAU-10-X(X=H,NO2,CH3)
2.5 N2O/N2的穿透模拟
为了进一步评估材料对N2O/N2混合物的分离性能,以N2O/N2混合物作为原料气,在298 K、1×105Pa条件下按照表1中的吸附剂及吸附床参数,对N2O/N2混合物进行了穿透模拟(图7a)。可以看出,N2最先突破吸附床,而N2O在5 min后开始缓慢洗脱,然后在20 min左右逐渐达到平衡。N2O和N2存在明显的穿透时间差距,表明CAU-10类材料对于实际的N2O/N2分离非常有效。当N2O穿出气体浓度为10%时,穿出时间顺序为CAU-10-H(6.6 min)>CAU-10-NO2(5.7 min)>CAU-10-CH3(4.2 min),穿出时间与选择性的规律(CAU-10-NO2>CAU-10-H>CAU-10-CH3)并不一致,这可能是穿透模拟过程中只考虑了分压5×104Pa下的气体吸附量,并没有像IAST一样同时考虑低压下的吸附,所以N2O穿出时间没有表现出与IASI计算一致的结果。此外,针对空气分离装置中存在微量的N2O(0.015%),我们同样对体积比为0.1%/99.9%的N2O/N2混合物进行了穿透模拟。从穿透曲线图7b中可以看出,3种材料都是N2先穿出,经过一定时间后N2O突破吸附柱。N2O和N2的穿透时间存在着明显的差异,可以预料的是,3种材料均可以高效去除混合气中的N2进而得到高纯度的N2O。当穿出气体中N2O浓度为0.1%时,CAU-10-NO2的穿出时间最长(6.8 min),该结果说明CAU-10-NO2具有较高的微量N2O捕获能力。
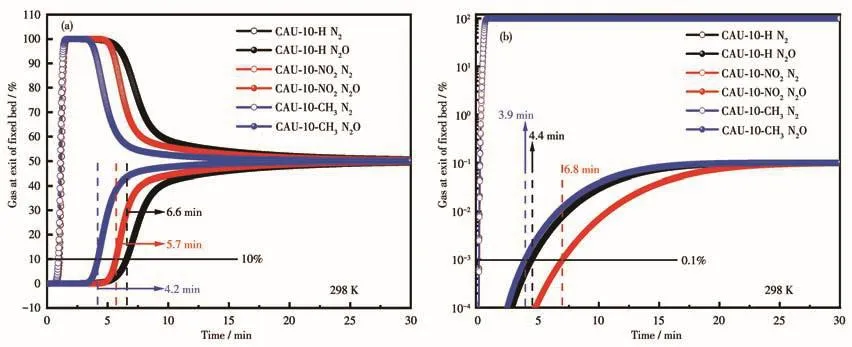
图7 CAU-10-X(X=H、NO2、CH3)的穿透模拟图Fig.7 Breakthrough simulation of CAU-10-X(X=H,NO2,CH3)
2.6 材料的再生
吸附剂的可重复使用性对于材料的实际应用至关重要。为了考察材料的循环可用性,在298 K下进行了5次N2O和N2的循环吸附测量(图8)。每次测试前,样品都在真空条件下活化3 h,如图所示,CAU-10-NO2对N2O的5次循环测试的吸附量都维持在 54 cm3·g-1左右,对N2的吸附量都维持在 5 cm3·g-1左右,说明材料经过5次循环后仍能保持良好的气体吸附能力,展现出优异的可重复使用性和耐久性。

图8 298 K、0~1×105Pa下CAU-10-NO2对N2O和N2的吸附循环Fig.8 N2O and N2 adsorption recycles of CAU-10-NO2 at 298 K and 0-1×105Pa
3 结 论
综上所述,我们在相似的反应条件下合成了具有不同取代基的 CAU-10-X(X=H、NO2、CH3)系列MOFs。从吸附曲线、IAST选择性和吸附热的结果来看,取代基的引入显著影响了材料的孔道直径和表面性质,进而对N2O的吸附容量和吸附能力产生了较大影响。其中,CAU-10-NO2在低压区(0~2.0×104Pa)展现出更高的N2O吸附能力,其N2O/N2选择性得到明显提升。穿透模拟的结果进一步表明—NO2基团的引入使得材料具有更加适合N2O吸附的局部化学环境,可以有效地提高材料的分离效率,当入口混合气体体积比为0.1%/99.9%时,CAU-10-NO2的N2O和N2穿透时间间隔最长,说明该材料具有最优的去除空气中微量N2O的能力。这项工作证明了取代基调控策略对N2O捕获的重要作用,为寻找和合成更优的N2O吸附材料提供了新的思路。

