吡咯替尼结合TAC化疗对HER2阳性乳腺癌患者疾病控制及IGF-1、EGFR蛋白表达的影响
唐冬艳 黄静仪
乳腺癌在全球女性恶性肿瘤中发病率为24.2%,位居首位,具有发病率高、病死率高等特点[1]。有关调查结果显示,18%~30%的乳腺癌患者人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)呈阳性,此类患者具有病情严重、预后差的特点,对常规化疗方案不太敏感,新辅助化疗已成为首选[2]。有研究证实,化疗是全身治疗的基础,加用抗HER2 靶向药可进一步使患者受益[3]。吡咯替尼为我国自主研发的恶性肿瘤靶向药,通过阻断HER 家族成员HER2、HER1 与HER4 异源/同源二聚体形成,从而发挥作用。文献[4]报道,胰岛素样生长因子-1(IGF-1)、表皮生长因子受体(EGFR)与乳腺癌的发生、进展关系紧密。为改善HER2 阳性乳腺癌患者预后,本研究采用吡咯替尼+TAC 新辅助化疗方案,观察该方案对IGF-1、EGFR 蛋白表达及免疫功能指标水平等的影响,现报道如下。
1 资料与方法
1.1 一般资料 选择2019 年1 月-2021 年11 月开平市中心医院收治的100 例HER2 阳性乳腺癌患者。纳入标准:(1)符合文献[5]《中国抗癌协会乳腺癌诊治指南与规范(2021 年版)》中乳腺癌诊断标准,经病理组织活检证实;(2)采用FISH 技术检测得出HER2 基因过度扩增;(3)处于局部晚期(T4,任何N,M0;T2~3,N2/N3,M0);(4)卡氏功能状态量表(KPS)评分≥70 分;(5)可测量病灶≥1 个;(6)各器官功能基本正常。排除标准:(1)哺乳或妊娠期女性;(2)合并其他肿瘤;(3)预期生存时间<3 个月;(4)既往接受过其他治疗;(5)乳腺癌类型特殊,如微乳头状癌、黏液癌等;(6)双乳癌;(7)无完整病历资料。参照随机数字表法将患者分为联合组(n=50)和化疗组(n=50)。本研究得到医院伦理委员会批准,患者均签订知情同意书。
1.2 方法
1.2.1 化疗组 采取TAC 新辅助化疗方案治疗,第一天静脉滴注多柔比星(生产厂家:深圳万乐药业有限公司,批准文号:国药准字H44024359,规格:10 mg)60 mg/m2、环磷酰胺(生产厂家:山西普德药业有限公司,批准文号:国药准字H14023686,规格:0.2 g)500 mg/m2,21 d 为1 个周期,用药4 个周期;序贯紫杉醇(生产厂家:云南植物药业有限公司,批准文号:国药准字H20093882,规格:5 mL∶30 mg),剂量为80 mg/m2,第一天给予,1 次/周,用药12 周。
1.2.2 联合组 在化疗组基础上联合吡咯替尼(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20180013,规格:80 mg)治疗,口服,4 片/次,1 次/d,餐后30 min服用,21 d 为1 个周期,用药4 个周期。新辅助治疗完成后,对患者一般情况进行评估,视肿瘤退缩情况、个人意愿、手术适应证采取改良根治术或保乳手术治疗。
1.3 观察指标及判定标准(1)比较两组治疗效果。治疗4 个周期后按实体瘤疗效评价标准(RECIST)指南1.1 版评估疗效,该指南指出疗效分为疾病进展、疾病稳定、部分缓解与完全缓解。完全缓解(CR)为全部靶病灶消失,所有病理淋巴结(非靶结节与靶结节)短直径缩小到10 mm 以下;部分缓解(PR)为靶病灶直径之和较基线值降低≥30%;疾病进展(PD)为以试验中全部测定的靶病灶直径之和最小值作为参照,直径之和相对增加≥20%(若基线测定值最小则以基线值作为参照);此外,需满足直径之和绝对值增加≥5 mm(若出现≥1 个新病灶也可判定为PD);疾病稳定(SD)为介于PR 与PD之间[6]。总有效=CR+PR。(2)比较两组IGF-1、EGFR 蛋白表达情况。于治疗前和治疗4 个周期后分别取癌组织标本,浸入10%甲醛内固定,脱水,以石蜡包埋,切取3~4 μm 切片,以二甲苯脱蜡、乙醇脱水,使用磷酸冲洗,再以抗原修复后封闭,以SP 法进行染色,在显微镜下观察,EGFR、IGF-1 阳性表达判断标准为细胞膜或细胞质中出现棕黄色或棕褐色着色现象,随机选取5 个高倍镜视野,观察1 000 个细胞阳性染色情况,阳性表达率=(阳性表达细胞数/1 000)×100%。(3)比较两组免疫功能指标水平。治疗前和治疗4 个周期后抽取10 mL 晨起空腹静脉血,抗凝,加入荧光素标记抗体混合液20 mL,摇匀,静置20 min 后加入Facstm 溶血素2 mL,摇匀,静置10 min,离心(5 000 r/min,15 min)去除血清,再加入1 mL磷酸缓冲盐溶液,摇匀,使用流式细胞仪(碧迪公司,型号:BD FACSCanto Ⅱ)测定免疫功能指标(CD69、CD3+、CD4+/CD8+)水平。(4)比较两组不良反应发生情况,按照WHO 常见抗癌药物毒副反应分级标准评定,包括恶心呕吐、脱发、肝功能损伤、腹胀腹泻、血小板计数减少等,分为0~4级,其中0 级为无反应。
1.4 统计学处理 采用SPSS 22.0 分析数据,计量资料用()表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 化疗组年龄28~69岁,平均(50.73±8.87)岁;肿瘤直径2.2~9.1 cm,平均(5.31±1.42)cm;体重指数18.34~26.71 kg/m2,平均(22.26±1.57)kg/m2;肿物部位:21 例乳腺外上,6 例乳腺外下,13 例乳腺内上,8 例乳腺内下,2 例中央区。联合组年龄30~70岁,平均(50.69±9.45)岁;肿瘤直径2.0~9.4 cm,平均(5.80±1.73)cm;体重指数18.19~26.38 kg/m2,平均(22.64±1.79)kg/m2;肿物部位:23 例乳腺外上,7 例乳腺外下,11 例乳腺内上,6 例乳腺内下,3 例中央区。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组治疗效果比较 治疗4 个周期后,联合组CR 18例,PR 21例,SD 7例,PD 4例,总有效率为78.00%(39/50);化疗组CR 12例,PR 17例,SD 12例,PD 9例,总有效率为58.00%(29/50)。联合组总有效率高于化疗组,差异有统计学意义(χ2=4.596,P=0.032)。
2.3 两组IGF-1、EGFR 蛋白表达情况比较 治疗前,两组IGF-1、EGFR 阳性表达率比较,差异均无统计学意义(P>0.05);治疗4 个周期,两组IGF-1、EGFR 阳性表达率均低于治疗前,且联合组均低于化疗组,差异均有统计学意义(P<0.05)。见表1。
表1 两组IGF-1、EGFR蛋白表达情况比较[%,()]
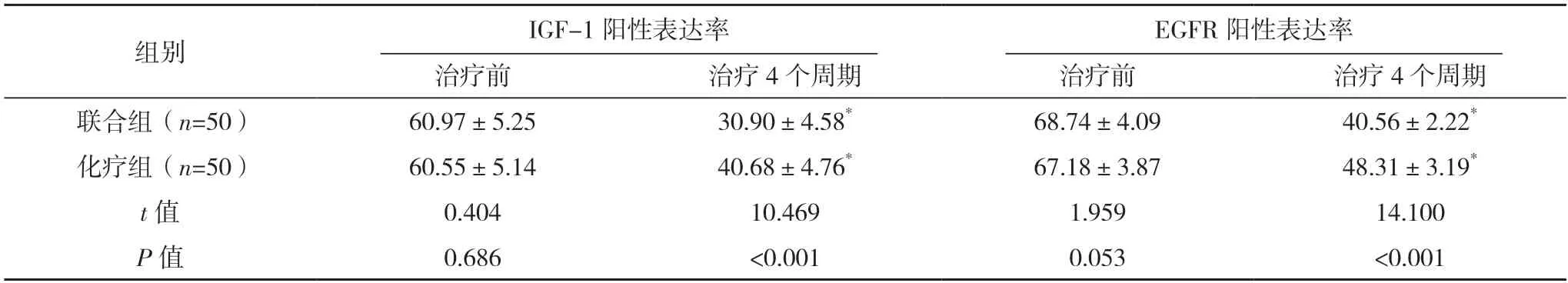
表1 两组IGF-1、EGFR蛋白表达情况比较[%,()]
*与治疗前比较,P<0.05。
2.4 两组免疫功能指标水平比较 治疗前,两组CD69、CD3+、CD4+/CD8+水平比较,差异均无统计学意义(P>0.05)。治疗4 个周期,联合组CD69、CD3+、CD4+/CD8+水平均高于化疗组,差异均有统计学意义(P<0.05)。治疗4 个周期,化疗组CD69、CD3+、CD4+/CD8+水平均低于治疗前,差异均有统计学意义(P<0.05)。见表2。
表2 两组免疫功能指标水平比较()

表2 两组免疫功能指标水平比较()
*与治疗前比较,P<0.05。
2.5 两组不良反应发生情况比较 治疗期间,联合组出现恶心呕吐46 例(1 级24例,2 级16例,3 级6 例)、脱发33 例(1 级16例,2 级9例,3 级8 例)、肝功能损伤8 例(1 级5例,2 级2例,3 级1 例)、腹胀腹泻44 例(1 级25例,2 级15例,3 级4 例)、血小板计数减少40 例(1 级25例,2 级12例,3 级2例,4 级1 例)。化疗组出现恶心呕吐49 例(1 级31例,2 级15例,3 级3 例)、脱 发28 例(1 级17例,2 级8例,3 级3 例)、肝功能损伤6 例(1 级4例,2 级2 例)、腹胀腹泻40 例(1 级25例,2 级13例,3 级2 例)、血小板计数减少43 例(1 级26例,2 级14例,3 级3 例)。两组恶心呕吐、脱发、肝功能损伤、腹胀腹泻、血小板计数减少发生率比较,差异均无统计学意义(P>0.05)。
3 讨论
HER2 属于表皮生长因子受体,能自发或与其他表皮生长因子受体结合形成二聚体,使下游Ras/MAPK、PI3K/AKT 信号通路活化,在细胞增殖、分化、凋亡中发挥调控作用,一般情况下表达量极低,过量表达提示乳腺癌患者不良预后[7-8]。目前,治疗局部晚期HER2 阳性乳腺癌首选新辅助化疗,可降低临床分期,缩小病灶[9]。多柔比星联合环磷酰胺、紫杉醇是新辅助化疗常用方案,环磷酰胺在肿瘤治疗中发挥细胞毒作用,多柔比星可抑制信使RNA 形成,阻碍核糖核酸、脱氧核糖核酸合成,对众多肿瘤细胞均有杀灭作用,紫杉醇可抑制肿瘤细胞分裂,从而取得抗肿瘤效果[10-12]。有研究显示,化疗是治疗乳腺癌无可替代的手段,而在化疗基础上结合靶向药物是改善病情、增加生存时间的有效方法[13]。吡咯替尼作为靶向药物,靶点为HER2、HER1 与HER4,可与其胞内酪氨酸激酶区三磷酸腺苷结合位点共价结合,抑制HER 家族二聚体形成,阻断HER2 介导的信号通路,抑制肿瘤细胞生长,且对靶点的抑制作用是不可逆的,抗肿瘤效果强大[14]。郑向欣等[15]研究证实,给予局部晚期HER2 阳性乳腺癌患者吡咯替尼与新辅助化疗方案联合治疗,可取得满意效果,病理完全缓解率达43.80%。本研究显示,联合组治疗4 个周期后总有效率78.00%,高于化疗组58.00%(P<0.05),可见吡咯替尼+TAC 新辅助化疗方案应用于HER2 阳性乳腺癌治疗中效果显著。究其原因,TAC 化疗作为新辅助化疗方案,能阻止肿瘤转移,杀灭肿瘤细胞,减轻炎症反应,吡咯替尼为抗HER2 靶向药物,在肿瘤细胞生长中发挥抑制作用,二者联用可发挥协同作用,抵御肿瘤细胞增殖,加速肿瘤细胞凋亡。
肿瘤血液供应与肿瘤恶性程度密切相关,破坏肿瘤血液供应能阻止肿瘤生长。众多因子能反映出肿瘤血供状态,IGF-1 属生长因子,可调控PI3K/AKT 与MAPK 信号通路,加速细胞凋亡、增殖,参与多种肿瘤发生、发展,EGFR 是一种受体型酪氨酸激酶,与乳腺癌细胞生长与增殖具有密切关系,通过调控血管生成、癌细胞分裂、增殖等过程,加速癌细胞转移[16-18]。现阶段,对于乳腺癌化疗的研究主要集中于治疗情况、肿瘤标志物等方面,缺乏对IGF-1、EGFR 蛋白表达情况的报道。本研究结果显示,联合组治疗4 个周期后IGF-1、EGFR 阳性表达率均低于化疗组(P<0.05),提示吡咯替尼联合TAC 新辅助化疗方案可调节HER2阳性乳腺癌患者IGF-1、EGFR 蛋白表达,这与吡咯替尼强效抑制靶点,阻止血管新生,切断血液供应密切相关。
随着恶性肿瘤研究的深入,乳腺癌患者的细胞免疫缺陷明显,故在抗肿瘤治疗中加强细胞免疫十分重要[19]。T 细胞在免疫应答中发挥重要作用,主要通过CD3+、CD4+、CD8+实现细胞免疫[20]。CD69是T 细胞活化后早期表达的标志性因子,其表达被当作T 细胞活化的标志,起到免疫监视作用[21]。本研究发现,联合组治疗4 个周期后CD69、CD3+、CD4+/CD8+水平均高于化疗组(P<0.05),提示在TAC 新辅助化疗方案基础上加用吡咯替尼,可减轻HER2 阳性乳腺癌患者免疫功能损害。分析原因可能为,化疗药物既能杀灭肿瘤细胞,又会不同程度抑制淋巴细胞,激活免疫防御系统,导致免疫功能抑制,而本研究中吡咯替尼仅作用于HER2,能抑制肿瘤发展,增强机体抵抗致病菌侵袭能力,改善免疫功能。靶向药物治疗恶性肿瘤具有低毒、高效的优势,这是由于其将在正常细胞中呈低表达或不表达,但在恶性肿瘤细胞中呈高表达的基因作为靶点,可最大程度减轻对正常细胞的损伤,提升肿瘤杀灭效果,也有利于延长生存时间,但本研究由于时间限制,未观察吡咯替尼联合TAC 新辅助化疗方案对生存期的影响,需在后期加以完善。
综上所述,吡咯替尼联合TAC 新辅助化疗方案治疗HER2 阳性乳腺癌,可调节IGF-1、EGFR 蛋白表达,减轻免疫功能损害,安全有效。

