乳腺癌中CREPT的表达及临床意义
张美智子,陈永良,郭佳雯,吴梓萱,薛 晶
乳腺癌是全球女性最常见的恶性肿瘤,最新统计的全球乳腺癌新发病例为226万,而死亡人数为68万[1]。中国乳腺癌发病率呈逐年上升趋势,且发病年龄趋于年轻化,新发病例位居全球首位,患者的经济负担也逐年加重[1-2]。目前,乳腺癌主要以手术治疗为主,并结合辅助治疗手段[3-4]。肿瘤细胞周期相关蛋白(cell-cycle related and expression-elevated protein in tumor, CREPT)也称RPRD1B,是新发现的位于人类20号染色体的基因,在多种肿瘤中呈高表达[5]。现阶段对于CREPT的研究较多,最新观点认为CREPT/RPRD1B以p300依赖的方式,通过STAT3驱动基因转录促进肿瘤的发生[6],但尚未有文献阐明CREPT在乳腺癌发生、发展中的关系。本文着重探讨CREPT在乳腺癌中的表达,并分析其与临床病理特征的相关性,以提高临床与病理医师的认识水平。
1 材料与方法
1.1 临床资料收集2020年11月~2021年6月承德医学院附属医院收治的乳腺癌术后癌组织石蜡标本132例,患者年龄26~73岁,中位年龄49岁;癌旁组织石蜡标本52例,患者年龄30~56岁,中位年龄48岁,随访时间为270个月。另收集12对新鲜乳腺癌与癌旁配对组织标本,置于-80 ℃超低温冰箱保存。患者术前均未行放、化疗等辅助治疗,病理分级按WHO(2019)乳腺肿瘤分类进行。本实验经承德医学院附属医院伦理委员会批准,患者均知情同意。
1.2 方法
1.2.1数据库 UALCAN数据库(http:// ualcan.path.uab.edu/)包括31种癌症类型,通过该数据库可利用TCGA转录组和临床患者数据,对CREPT基因表达进行深入分析[7]。GEPIA2数据库(http://gepia2.cancer-pku.cn/analysis)包括9 736个肿瘤和8 587个正常样本,可有效进行癌症数据在线分析和挖掘的网站[8],分析CREPT基因的表达及与预后的关系。
1.2.2Western blot法 取适量置于-80 ℃冰箱冻存的乳腺癌及配对癌旁组织,加入蛋白酶抑制剂和裂解液(稀释比1 ∶100,上海碧云天生物公司),置于冰上操作,充分研磨静置后放入离心机中,离心3 000 r/min,5 min;使用BCA法测定蛋白质浓度,调整样品浓度;加入Loading Buffer煮沸10 min。Western blot检测:配胶,转膜,裁膜封闭,加入一抗(CE10稀释比1 ∶500),TBST洗膜,加入二抗(稀释比1 ∶1 000);室温孵育1 h;洗膜后显影。Image J软件进行灰度值分析。
1.2.3qRT-PCR法 取适量置于-80 ℃冰箱冻存的乳腺癌及配对癌旁组织,按照TRIzol说明书提取总RNA,评价RNA纯度,根据FastQuant试剂盒(天跟生化公司)说明书合成cDNA第一链。PCR引物由上海生物工程公司合成,其中CREPT引物序列:上游5′-TGTCCCTTTGGCTCATCCAC-3′,下游5′-CATCTGCCTCTCTGGCAACA-3′。GAPDH引物序列:上游5′-GCACCGTCAAGGCTGAGAAC-3′,下游5′-TGGTGAAGACGACAGTGGA-3′。
1.2.4免疫组化 采用免疫组化EnVision两步法染色,室温下经石蜡包埋,切片,脱蜡,水化,蒸馏水洗3次各3 min,PBS冲洗3次,各5 min,进行抗原修复,将切片放入柠檬酸缓冲液中煮沸,持续20 min;室温冷却。PBS冲洗3次,各5 min;加入3%H2O210 min;用PBS冲洗3次各5 min;倒去封闭液,用PBS冲洗3次各5 min,滴加一抗鼠抗CREPT单克隆抗体(3E10,1 ∶100)(由清华大学医学院常智杰教授赠与),置于4 ℃过夜,用PBS清洗3次,各5 min;加入二抗(DAKO公司),室温下静置45 min;PBS清洗3次,各5 min;DAB显色试剂盒(DAKO公司);苏木精复染,脱水封固。CREPT染色结果以半定量方法评估,免疫反应性评分(immunoreactivity score, IRS):低表达组(IRS为0~6分)和高表达组(6~12分)。

2 结果
2.1 GEPIA2及UALCAN数据库分析利用GEPIA2和UALCAN数据库分析显示,CREPT在1 097例乳腺癌、114例正常乳腺组织中的表达差异有显著性,且CREPT在乳腺癌组织中的表达显著高于正常乳腺组织(P<0.01,图1A)。在乳腺癌的临床病理因素中,CREPT在乳腺癌的各个分期均有表达且分期越高,其表达量越高,差异有统计学意义(P<0.01,图1B)。检索UALCAN数据库发现,CREPT基因高表达组乳腺癌患者总生存期明显低于低表达组,差异有统计学意义(P=0.032,图1C);在不同种族的乳腺癌患者中,CREPT高表达组患者总生存期明显低于低表达组,差异有统计学意义(P=0.034,图1D)。
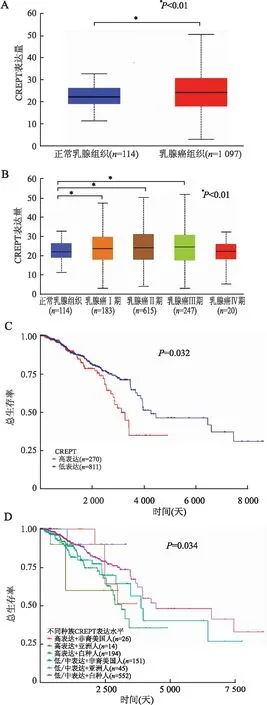
图1 GEPIA2及UALCAN数据库分析CREPT在乳腺癌中的表达水平与预后的关系:A.正常乳腺组织与乳腺癌组织中CREPT的表达;B.正常乳腺组织与不同临床分期的乳腺癌组织中CREPT的表达;C.CREPT的表达对患者生存期的影响;D.CREPT表达在不同种族的乳腺癌患者中的比较
2.2 Western blot法检测CREPT蛋白表达采用Western blot法检测显示:乳腺癌组织中CREPT蛋白表达水平明显升高(图2A);CREPT蛋白在乳腺癌组织中的表达量(0.30±0.01)明显高于癌旁乳腺组织(0.08±0.07),两者差异有统计学意义(P<0.01,图2B)。

图2 Western blot法检测乳腺癌及癌旁组织中CREPT蛋白表达:A.电泳图;B.直方图
2.3 qRT-PCR法检测CREPT相对表达量运用相对定量法通过2-ΔΔCt计算,检测乳腺癌组织中CREPT mRNA相对表达量(6.321±0.543)明显高于癌旁组织(1.032±0.32),差异有统计学意义(P<0.01,图3)。

图3 乳腺癌及癌旁组织中CREPT mRNA表达水平
2.4 免疫组化法检测石蜡切片中CREPT的表达CREPT表达主要定位于细胞核。132例乳腺癌标本中,CREPT表达者132例(图4A),其中高表达76例,低表达56例,而在癌旁组织中表达者52例(图4B),均为低表达;两组差异有显著统计学意义(χ2=51.008,P<0.01)。CREPT的高表达与TNM分期有关及有无淋巴结转移有关,且差异有统计学意义(P<0.01,表1)。采用Kaplan-Meier法分析105例患者生存状态,Log-rank检验CREPT高表达的乳腺癌患者总生存期较短(P<0.05,图5)。
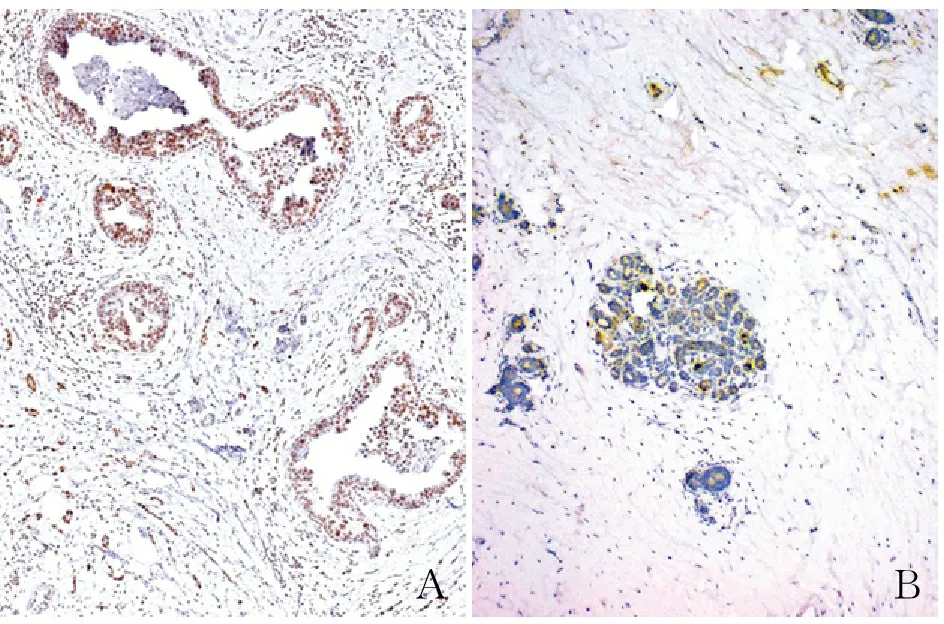
AB

图5 CREPT表达与乳腺癌患者预后的关系

表1 乳腺癌组织中CREPT表达与临床病理特征的关系
3 讨论
含核前mRNA结构域蛋白(regulation of nuclear pre-mRNA-domain-containing RPRD)家族主要成员有p15RS(RPRD1A)、CREPT(RPRD1B)和RPRD2。RPRD家族蛋白质结构包含C末端结构域(carboxy-terminal domain,CTD),与CTD相互作用的效应蛋白是CTD相互作用域(RNA Pol II CTD interacting domain,CID)[9]。
CID存在于众多调节转录、终止和加工RNA的蛋白质中,介导与RNA聚合酶II(RNAPII)的最大亚单位Rpb1含有CTD的关联,并在高效合成成熟的mRNA中发挥重要作用。2012年常智杰教授新发现了CREPT基因,表达于大部分人体细胞和组织中,其定位于20号染色体长臂1区1带[10]。在结构上CREPT除了有RPR结构域外,还有一个卷曲螺旋末端结构域,可以帮助其形成二聚体,进一步加强CID与CTD的相互作用[11]。在功能上包括有促进DNA的修复、调节细胞周期等。最近也有研究发现,沉默CREPT的乳腺癌细胞会降低CDK1的表达,而CDK1是同源重组(homologous recombination, HR)方式中的关键效应子。因此,CREPT可能以间接的方式参与HR过程,但存在细胞类型的差异,其具体发生过程仍有待于进一步研究[12]。Yang等[13]发现CREPT缺失的肠上皮细胞在损伤后无法再生的现象,说明CREPT可以调节小鼠肠道干细胞分化分裂相关的基因表达,促进肠道再生对肠上皮细胞的恢复与更新至关重要。
目前,已经在多种类型的肿瘤中均发现CREPT的异常过表达,并且其在调控细胞周期和促进肿瘤生长方面也发挥巨大作用[9]。
有学者发布最新研究指出,CREPT首先与p300形成复合物,然后通过其RPR结构域与STAT3结合,充当p300与STAT3沟通的桥梁,从而增强STAT3转录活性,发挥其致癌作用[14]。在结直肠癌(colorectal cancer,CRC)细胞系中发现,CREPT与p300协同作用,增强p300与β-catenin的乙酰化作用,并激活Wnt/β-catenin通路,进而调控肿瘤的发生与发展[15]。此外,细胞周期的失调也是肿瘤发生的共同特点之一。CREPT调节多种细胞周期蛋白和周期蛋白依赖性激酶的表达,进而调控细胞周期。其主要是通过增强RNA聚合酶Ⅱ与启动子的结合,诱导靶基因成环实现。文献报道CREPT可以促进Cyclin D1、Cyclin E、CDK4、CDK2和CDK6转录,即其主要作用集中于G1/S期的过渡[4]。研究发现,胃癌细胞中CREPT经极光激酶B(Aurora B)磷酸化S145位点后,使其RPR域与RNA聚合酶Ⅱ作用,促进Cyclin B1转录进而加速G2/M期转换[16]。
在CRC[15]、胃癌[16]、食管癌[17]、非小细胞肺癌[18]、黑素细胞瘤[19]等15种癌组织中[20],CREPT的表达含量均高于其癌旁组织。在肾癌组织中,CREPT的表达水平与TNM分期、分级预后紧密相关[21]。在CRC组织中,CREPT高表达促进肿瘤的增长;与良性组织相比,CREPT细胞在CRC组织中大量表达且与肿瘤进展呈正相关[22],提示CREPT参与多种癌症发生、发展,促进癌症的转移和侵袭。Ma等[23]设计了一种细胞可渗透性肽的PROTAC,可在胰腺癌细胞中降解CREPT;当CREPT被降解,肿瘤细胞的增殖与迁移能力大幅减弱,提示CREPT可能成为解决肿瘤防治问题的新方向。
目前,CREPT在乳腺癌中的作用尚不清楚。近年我国女性乳腺癌发病率及病死率逐年攀升,且发病年龄有低龄化的趋势,已严重危害女性身体健康[24-25]。因此,本实验分析CREPT在乳腺癌组织中的表达及临床意义,结合生物信息学技术,通过Western blot法及免疫组化EnVision两步法检测CREPT在乳腺癌组织中的表达,实验结果发现乳腺癌中CREPT的表达明显高于癌旁组织,且乳腺癌患者的临床分期越高,CREPT的表达水平也不断提高。CREPT高表达患者的总生存期明显低于低表达患者,CREPT的表达水平与乳腺癌分型及有无淋巴结转移均有关。
总之,CREPT可作为新的原癌基因,参与调控乳腺癌发生、发展,促使乳腺癌向恶性发展。CREPT有望成为乳腺癌分型相关的潜在生物学标志物及治疗的新靶点,有助于早期的癌症筛查和靶向治疗。

