荧光法检测根际土壤胞外酶活性的优化
唐连发,王琴,唐兆鑫,杨晴晴
(河北大学 生态环境学院(筹),河北 保定 071002)
土壤酶由植物根系和土壤微生物分泌[1].在植物—土壤元素循环中,酶对有机分子的降解和矿化起着重要的作用,土壤中胞外酶揭示了土壤的C、N、P循环[2].土壤胞外酶稳定性好,可长时间保持高的酶活性[3].它们在环境受到胁迫后的响应能力,使其成为评价土壤微生物质量的潜在指示剂[4].在有关土壤生态学以及土壤微生物的测定中,关键土壤酶活性的测定成为必不可少的指标[2].
对采集的土壤立即进行分析可能是最接近实际情况的,但由于各方面的限制较难实现,因此就需要采用适宜的方法来保存土壤,这可能影响到土壤胞外酶的活性,但不同类型土壤酶活性的差异仍可得以保留[5].在特定的实验条件下使用人工底物测量土壤胞外酶活性,大多采用荧光法或吸光度法[6].荧光法测定土壤胞外酶活性与吸光度法相比具有灵敏性高、所需样本量少、高通量、耗时短等优点,但同时也存在着底物较贵、底物和标准品难溶解等缺点[7].在荧光法测定土壤胞外酶活性的实验中,缓冲溶液与土壤混匀是土壤酶提取的重要一步,其作用在于破坏土壤团聚体将土壤酶充分释放出来,但不同类型的土壤使用相同的缓冲溶液可能对不同土壤酶的提取存在差异[1].大多采用漩涡震荡将缓冲溶液与土壤混匀,使土壤中的酶与底物发生完全反应[8].不同酶与底物充分反应所需的培养时间不同,大多为4 h[9-12].酶与底物充分反应还会受到培养温度的影响,在合适的温度下培养更能获得实际的土壤中酶活性情况.因土壤类型不同、酶的种类不同等,可能在可控的实验步骤方面存在一定的差异,需要逐项优化.
本研究检测了根际土壤中5种关键的胞外酶:纤维素降解的β-葡萄糖苷酶(βG)[13],从甲壳素中释放出含氮小氨基糖的β-N-乙酰氨基葡萄糖苷酶(NAG)[14],将纤维素分解为纤维二糖、果糖和葡萄糖的纤维二糖水解酶(CBH)[15],水解蛋白质和多肽的亮氨酸氨基肽酶(LAP),矿化有机磷的碱性磷酸酶(AKP)[16].通过测定不同缓冲溶液提取、不同混匀方式、不同培养温度、不同培养时间等对酶活性的影响,确定荧光法测定5种土壤胞外酶活性的最佳参数,为其标准的制定提供参考.
1 材料与方法
1.1 土壤样本的选择
选取来自不同类型宿主的根际土壤样本.刺槐(RobiniapseudoacaciaLinn)和一年生的欧美杂交杨‘546’(Populusdeltoidescv.′55/56′×P.deltoidescv. ′Imperial′,高敏感性,含有典型臭氧敏感性差异杨树基因型),均来自北京延庆地区臭氧实验基地(40.47° N,116.34° E).树木种植在20 L的塑料花盆中,盆内装有从附近农田采集的0~10 cm深度的棕色砂壤土.生长5个月后取植物根际土,过2 mm筛用于测定土壤理化指标,再过1 mm筛用于测定土壤胞外酶活性,密封袋保存后快速运回实验室-20 ℃冷冻保存.
1.2 土壤理化指标的测定
土壤pH采用国标法,使用pH计(ST3100,奥豪斯)进行测定[17].
含水率:土壤过1 mm筛,110 ℃至恒质量,计算含水率.
含水率=(湿土质量-烘干土质量)/烘干土质量×100%.
有机质、全氮、全磷、全钾、碱解氮、有效磷和速效钾的测定均采用鲍士旦[18]所记录的方法.所测得杨树土壤理化指标见表1.

表1 根际土壤的理化指标
1.3 相关溶液的配制
1.3.1 标准溶液的配制
标准物质为4-甲基伞形酮(MUB)和7-氨基-4-甲基香豆素(AMC)(麦克林试剂).LAP的参考标准是AMC,其余4种酶是MUB[19].本研究以MUB和AMC的偶联物作为底物[19-20],其原理是:5种酶分解其特异性的底物,其底物中包含的荧光物质MUB、AMC被释放出来,通过测定荧光强度值,将酶活性转化为所产生标准物的量.在Merck网站上(https://www.sigmaaldrich.cn),MUB在甲醇中的溶解度为50 mg/mL;AMC在丙酮中的溶解度为10 mg/mL.另有文献采用另一种极佳的有机溶剂DMSO(二甲基亚砜)作为溶剂[21].本研究中MUB和AMC标准物采用甲醇作为溶剂,超纯水稀释(AMC在超纯水中溶解较好),配制浓度为40 mmol/L.
1.3.2 底物溶液的配制
底物浓度200 μmol/L,底物溶剂为超纯水,其中βG底物需超声使其彻底溶解.有文献使用底物浓度4 μmol/L[22],但大多数文献使用200 μmol/L[23-24],后者可使大多数土壤样品分解[20, 24].所配溶液分装且用锡纸包裹后,放入4 ℃冰箱保存备用.所用底物见表2(罗恩试剂).

表2 所测土壤胞外酶及相应底物
1.3.3 土壤胞外酶活性测定的操作步骤及计算方法
称取1 g土壤于50 mL离心管中,加入缓冲溶液,振荡混匀,制备土壤均质悬浊液.先将土壤悬浊液(在磁力搅拌器上取样)、超纯水加入黑色96孔酶标板(上海WHB),然后在暗处加入底物溶液和标准溶液.加入完成后,在黑暗条件下使用恒温培养箱培养.培养完成后在每孔中加入10 μL、1 mol/L的NaOH(终止反应,增加荧光强度),反应1 min后使用酶标仪(美国/Biotek,Cytation5,激发365 nm,发射450 nm)测定荧光值.各孔加入物质[25]见表3.

表3 黑色96孔酶标板各孔加入物质
计算方法:
酶活=(净荧光值×缓冲溶液体积)/(发射系数×悬浊液体积×培养时间×土壤干质量).
其中,
净荧光值=(样品微孔的荧光值-样品控制孔的荧光值)/淬灭系数-基底控制孔的荧光值;淬灭系数=(淬火标准孔的荧光值-样品控制孔的荧光值)/参考标准孔的荧光值;发射系数=参考标准孔的荧光值/(参考标准物浓度×参考标准物体积).
1.4 实验设计
1.4.1 缓冲溶液的选择
分别选取乙酸钠(0.2 mol/L,pH 5.8)、柠檬酸-柠檬酸钠(0.2 mol/L,pH 6.6)、PBS(0.2 mol/L,pH 7.5)、超纯水4种溶液作为缓冲溶液.
1.4.2 混匀方式的选择
选取几种常用的混匀方式,混匀时间根据经验设置.本研究中所用的混匀方式见表4.

表4 本研究所用的混匀方式
1.4.3 培养温度的选择
恒温培养箱(SPX型智能生化培养箱)设置3个不同的温度(20、25、30 ℃).
1.4.4 培养时间的选择
每种酶的培养时间分别为1、2、3、4、5、6 h.
2 结果
2.1 缓冲溶液对酶活的影响
称取杨树、刺槐根际土壤各1 g,分别加入1.4.1中不同的缓冲溶液30 mL,摇床摇匀1 h,25 ℃培养5 h,酶活测定结果见图1.

a.杨树;b.刺槐图1 缓冲溶液对酶活的影响Fig.1 Effect of buffer solutions on the enzyme activities
由图1可知,不同树种之间对缓冲溶液的反应是一致的.AKP、βG、LAP在以超纯水为缓冲溶液的情况下,酶活最高;CBH、NAG在乙酸钠为缓冲溶液的情况下,酶活最高.
本研究的土壤均呈弱碱性,而乙酸钠、柠檬酸-柠檬酸钠缓冲溶液属于酸性.由乙酸钠缓冲溶液测得的CBH、NAG酶活最高,但是测得的βG酶活很低.PBS作为缓冲溶液测得的AKP酶经计算得出的酶活为负值(图1中取0),PBS可能并不适合作为测定土壤胞外酶酶活的缓冲溶液,至少不适合本研究土壤中的AKP酶活的测定.
2.2 混匀方式对酶活的影响
称取5份刺槐根际土壤各1 g,加入超纯水30 mL,分别以1.4.2中5种方法混匀处理,25 ℃培养4 h.所用底物从4 ℃冰箱中取出,置于室温避光处放置12 h,酶活测定结果见图2.
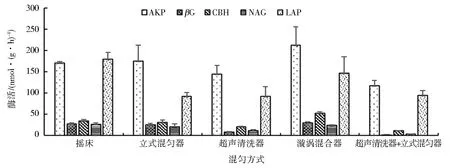
图2 混匀方式对酶活的影响Fig.2 Effect of mixing methods on the enzyme activities
由图2可知,使用漩涡混合器提取出的AKP、βG、CBH酶活最高.摇床1 h,提取出的NAG、LAP酶活最高.使用超声清洗器提取的酶活较小,可能由于超声时间过长,破坏了酶的结构.超声后又经立式混匀器混匀提取的βG、CBH、NAG酶活非常低,AKP、LAP酶活也有所降低.使用立式混匀器可能由于转速不够的原因,所测得LAP酶活与摇床相比较低.虽然经不同混匀方式提取的酶活不同,但每种方式下5种酶的酶活趋势基本一致(AKP>LAP>CBH>βG/NAG).
2.3 培养温度对酶活的影响
称取杨树根际土壤1 g,加入30 mL超纯水,漩涡混匀5 min后,将土壤悬浊液稀释10倍,25 ℃培养5 h.所用底物、标准品从4 ℃冰箱中取出,置于室温避光处放置24 h,酶活测定结果见图3.
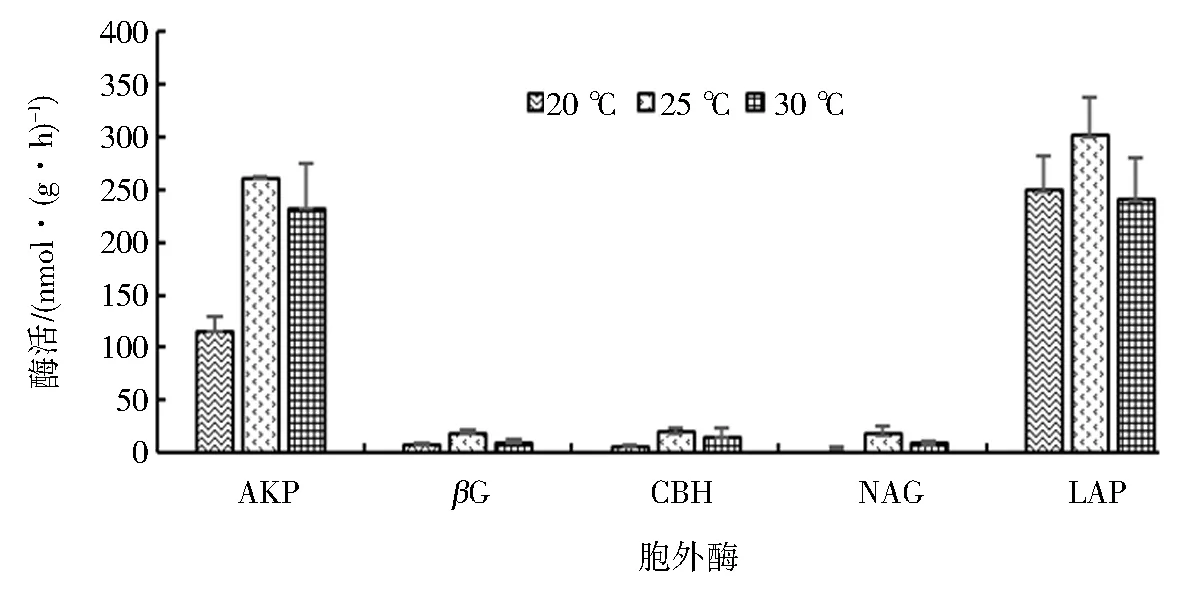
图3 培养温度对酶活的影响Fig.3 Effect of culture temperatures on the enzyme activities
由图3可知,除LAP经30 ℃和20 ℃培养相差不大以外,其余酶的趋势基本为25 ℃培养的酶活>30 ℃培养的酶活>20 ℃培养的酶活.
2.4 培养时间对酶活的影响
称取杨树根际土壤1 g,加入30 mL超纯水,漩涡混匀5 min后,将土壤悬浊液稀释10倍,25 ℃培养.根据酶的培养时间曲线,判断5种酶最佳的培养时间,结果见图4.
由图4可知,在培养4 h的情况下,AKP、βG的酶活随着培养时间延长呈上升趋势,在4 h时达到最高值.随后继续分别培养5、6 h,AKP的酶活在培养5、6 h呈现下降趋势(酶活分别为303.63、253.25 nmol/(g·h)),βG的酶活也在培养5、6 h呈现下降趋势(酶活分别为12.25、8.76 nmol/(g·h)).LAP酶活最高点在1 h,然后随着时间呈波浪变化,但始终没有超过1 h时的酶活.CBH、NAG的酶活随时间不断变化,CBH酶活在2 h时达到最高值,NAG的酶活在3 h时达到最高值.
2.5 优化后参数的应用
根据1.4实验设计优化后的条件,选取杨树根际土壤进行5种酶酶活的测定,结果见图5.

图4 培养时间对酶活的影响Fig.4 Effect of culture times on the enzyme activities

图5 杨树根际土壤胞外酶的酶活Fig.5 Activities of extracellular enzymes in the rhizosphere soil of poplar
由图5可知,杨树根际土壤中AKP、LAP的酶活远高于其他3种酶,βG、CBH、NAG的酶活均小于40 nmol/(g·h).上述实验中5种土壤胞外酶AKP、βG、CBH、NAG、LAP的活性(平均值±标准差)分别为(237.70±74.72)、(24.68±6.20)、(17.05±2.76)、(26.38±3.03)、(289.70±130.60)nmol/(g·h).
3 讨论
采用荧光法测定土壤胞外酶活性,是一种高通量且简便的方法.标准品 MUB 和AMC较难溶解,本研究中用甲醇作溶剂,再用超纯水稀释到相应浓度.研究过程中发现SynergyHTX酶标仪(使用钨丝灯,用滤光片作为光源)的检测范围较低(100~6 000),测得的荧光值较小;Cytation5酶标仪(使用氙闪灯,单色器作为光源)的检测范围较高(10 000~3 000 000)、灵敏度高,故本研究采用Cytation5酶标仪进行测定.研究还发现文献中使用的水土比30∶1(mL∶g)较低[26],实验过程中用此水土比测得的荧光值较大,所以本研究加大了水土比,图3为在水土比30∶1(mL∶g)再稀释10倍的条件下计算出的土壤胞外酶酶活,此时实际水土比为300∶1(mL∶g).
测试土壤样本均来自相同类型的土壤,因其宿主植物差异,根际土壤的理化性质并不完全一致,其有机质是影响土壤酶活性的关键因子[2, 27].本研究中不同样本之间的pH、有机质的含量相似.乙酸钠是测定这5种土壤胞外酶酶活常用的缓冲溶液,其所测定的土壤多呈酸性[9, 28-29].本研究发现CBH、NAG在用乙酸钠缓冲液提取时测得的酶活最高,AKP、βG、LAP在用超纯水提取时测得的酶活最高.
对于混匀方式来说,使用XH-C漩涡混合器混匀5 min,测得AKP、βG、CBH酶活性最高,摇床混匀60 min所得NAG、LAP酶活最高.可能XH-C漩涡混合器的功率及时间、摇床的转速及时间都对酶活有影响,这就需要根据不同样本性质多次测定所得的经验进行选择.有研究发现,不同酶之间有着不同的最佳搅拌时间[8].梅孔灿等[28]在测定βG、CBH中,使用磁力搅拌器搅拌5 min.当样本较少时,选择漩涡混合器省时省力;当样本数较多时,选择摇床可一次混匀所有的样本.
在水解酶的培育时间上各学者都有不同选择,李欢等[30]在对这5种酶的测定中,采用黑暗下培育2 h;杜璨[26]在对CBH、βG、NAG的测定中采用黑暗下培育4 h;Brockett等[24]在对CBH、βG、NAG的测定中分别培育3、7、3 h;贾淑娴等[8]在对CBH、βG、NAG测定方法探究上,证明这3种酶培养4 h是最佳的.培养时间在4 h内是多数研究者所采用的时间.本研究设置培养时间为1~6 h,发现AKP、βG的最优培养时间是4 h,LAP是1 h,CBH是2 h,NAG是3 h.温度对土壤胞外酶活性有着重要的影响[27].通过实验测定,发现在25 ℃下5种土壤胞外酶的酶活均为最高,在20 ℃下培养的5种酶的酶活均为最低,这5种酶的最佳培养温度为25 ℃左右(较20 ℃和30 ℃来说),培养温度可能需要根据实际采样时的温度来设置,比如:福建省4月份采样,实验设置的培养温度为20 ℃[28];云南元谋县采样土壤年均温度23.4 ℃,实验设置的培养温度为25 ℃[29].25 ℃几乎是本研究中土壤样本采集时的温度,也比较符合实际的情况.徐国庆[31]用荧光法测定施加污泥生物碳的杨树土壤酶的酶活,βG、LAP、NAG酶活依次是140~240、10~20、50~80 nmol/(g·h).本研究结果与之相比较,βG活性较小,LAP活性较大.βG是有关C分解的酶,LAP是有关N分解的酶,根据土壤酶化学计量学[26],本研究样本可能受到了微生物的N限制.
4 结论
本研究依据荧光法优化了土壤中常见的5种胞外酶酶活的测定方法,考察了不同的混匀方式、不同缓冲溶液提取、不同培养温度、不同培养时间等因素对酶活的影响.结果得出:在使用Cytation5等高灵敏度的酶标仪测定时所采用水土比值应高于300∶1(mL∶g).转速会影响土壤胞外酶提取,若选择较高转速则应相对减少混匀时间.基于以下土壤胞外酶测试的关键参数可获得最大酶活:测定AKP、βG时用超纯水作为缓冲溶液,用XH-C漩涡混匀器(功率60 W)混匀土壤5 min,在25 ℃培养4 h;测定CBH时用乙酸钠(0.2 mol/L,pH 5.8)作为缓冲溶液,用XH-C漩涡混匀器(功率60 W)混匀土壤5 min,在25 ℃培养2 h;测定NAG时用乙酸钠(0.2 mol/L,pH 5.8)作为缓冲溶液,摇床(150 r/min)混匀60 min,在25 ℃培养3 h;测定LAP时用超纯水作为缓冲溶液,摇床(150 r/min)混匀60 min,在25 ℃培养1 h.本研究结果可为提高荧光法准确测定土壤胞外酶活性提供依据.

