中枢胰岛素抵抗与脑血管病的关系
胥智超,李润芝,米东华
胰岛素的外周作用、外周胰岛素抵抗以及2型糖尿病相关的胰岛素抵抗等主题一直以来是许多研究的重点内容,随着研究的深入,人们逐渐发现中枢神经系统也存在胰岛素抵抗,中枢胰岛素抵抗与脑血管病的发生发展有着密切的联系[1-5]。最近几年,相关的研究开始成为大家关注的热点。本篇综述将分别阐述胰岛素在中枢神经系统的作用,中枢胰岛素抵抗的概念、提出过程、与脑血管病的关系和研究现状,中枢胰岛素抵抗的评估方法以及研究方向和临床应用前景。
1 胰岛素在中枢神经系统的作用
胰岛素是胰腺β细胞分泌的肽类激素,在糖脂代谢、血管调节和细胞生长方面起着重要的作用。外周组织利用胰岛素来转运和激活细胞膜上的葡萄糖转运蛋白,进而促进循环中葡萄糖的摄取利用。然而,中枢神经系统摄取和利用葡萄糖的过程却不需要胰岛素的介导,葡萄糖可以通过扩散作用直接穿过血脑屏障进入大脑被利用[6]。因此,长期以来中枢神经系统一直被认为是不依赖胰岛素的组织。直到后来有研究发现,脑组织提取物中存在高水平的胰岛素[7],大脑中广泛分布胰岛素受体[6],大脑才被认为是胰岛素敏感器官。目前已知,中枢胰岛素参与大脑的多种生理功能,包括食物摄入和体质量控制、生殖、学习和记忆、神经调节和神经营养等[8],对人的多种行为和代谢产生影响。
在中枢神经系统,循环中的胰岛素可以与血脑屏障内皮细胞上的胰岛素受体结合,通过胞吞-胞吐机制主动转运进入脑脊液后浓缩至比外周组织高50倍的水平[7]。进入中枢神经系统后,胰岛素可以与分布在嗅球、大脑皮质、海马、下丘脑、杏仁核和隔膜的大量胰岛素受体结合,发挥酪氨酸激酶的作用,这种作用将引起受体自身的磷酸化以及胰岛素受体底物酪氨酸残基的磷酸化,随后激活下游信号级联反应[6]。中枢神经系统的胰岛素除了来自外周组织,也可以由具有锥体细胞的脑区如海马、前额叶皮质、嗅球和内嗅皮质产生[7]。
首先,胰岛素在中枢神经系统可以调节外周代谢和进食行为,其对外周代谢的调节作用取决于其在哪部分脑区发挥作用以及不同脑区之间的相互作用[9]。胰岛素作用于中枢神经系统可调节外周代谢、增强全身胰岛素敏感性并抑制内源性葡萄糖产生。胰岛素也可作为厌食因子发挥作用,其可以通过降低食物美味程度的显著性和增强人的认知控制来抑制进食[9]。Kullmann等[6]的动物实验表明,向狒狒的侧脑室注射胰岛素可以减少其食物摄入、减轻体质量。其次,胰岛素可以通过其促生存、营养和抗凋亡的作用来促进神经突起生长和轴突再生;通过磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/Akt/糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)信号通路来阻止β淀粉样蛋白在神经元内的积聚并调节tau蛋白的代谢。总之,胰岛素及其受体在脑内广泛分布,可作为一种对整体神经生理和健康心理过程(如行为、情绪、认知、学习和记忆)的保护[10]。再次,近年来,人们开始认识到中枢神经系统胰岛素在精神疾病和神经退行性疾病发生发展中起着重要作用(图1)[6,9-10]。
2 中枢胰岛素抵抗
胰岛素抵抗是指靶组织对胰岛素不能产生正常的反应,或者未产生完全反应[9],表现为胰岛素对血液循环中葡萄糖清除能力的减低、进入靶组织能力的降低或参与靶组织经典信号通路的能力降低[11]。通常认为,外周胰岛素抵抗是肥胖和2型糖尿病的标志,且与代谢紊乱有关。
外周胰岛素水平的长期持续升高将影响中枢神经系统胰岛素的功能,产生中枢胰岛素抵抗。为了满足长期升高的葡萄糖水平和大量增加的脂肪组织需要胰岛素进行糖代谢的需求,胰腺释放的胰岛素量会增加[11],出现外周高胰岛素血症。持续的外周高胰岛素血症可导致血脑屏障上胰岛素受体减少,从而减少外周胰岛素向中枢神经系统的转运。胰岛素摄取的减少将导致中枢胰岛素作用受损。另外,随着年龄的增长,中枢胰岛素受体的数量也会随之减少,也可导致中枢胰岛素作用降低[6]。
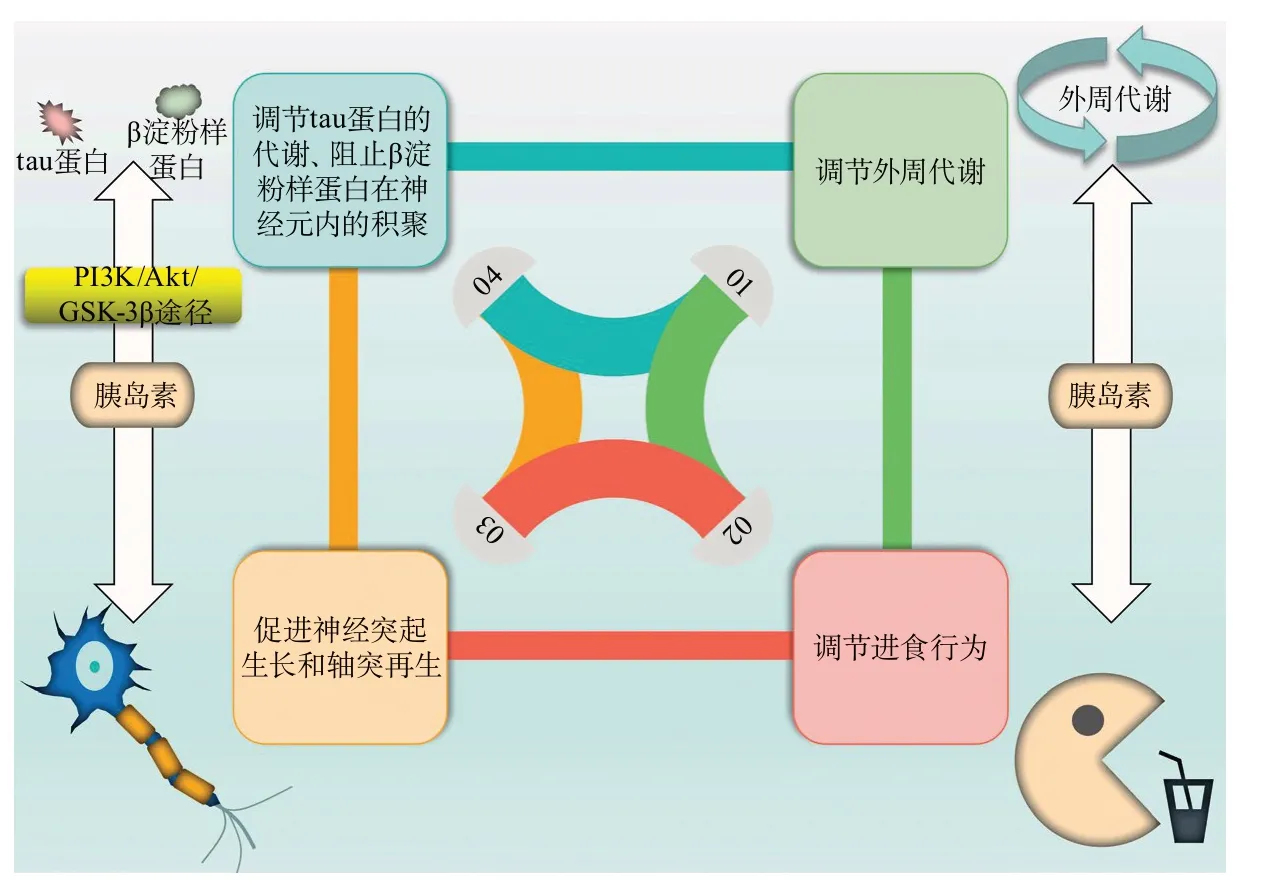
图1 胰岛素在中枢神经系统的作用[6,9-10]
中枢胰岛素抵抗是指脑细胞不能对胰岛素作出反应。胰岛素受体的表达下调、胰岛素受体不能结合胰岛素或胰岛素信号级联反应错误激活等原因都有可能导致中枢胰岛素抵抗。在细胞水平上,这种功能障碍可能表现为神经元的神经可塑性、受体调节或神经递质释放的损害,或与胰岛素代谢关联更密切的过程的损害,如表达葡萄糖转运体4(glucose transporter 4,GLUT4)的神经元的葡萄糖摄取过程[12]。从功能上来说,中枢胰岛素抵抗可以表现为大脑或外周代谢调节能力的受损、认知和情绪功能障碍以及脑特异性神经病理学改变和神经变性[12]。中枢胰岛素作用的缺乏或胰岛素功能的紊乱有可能导致记忆、神经保护作用、突触传递的损伤,在神经退行性疾病和神经精神疾病的发展和进展中起到重要作用[11]。中枢胰岛素作用障碍,将会导致神经细胞和神经胶质细胞功能产生多种改变(包括多巴胺信号、血脑屏障、海马突触可塑性、线粒体功能以及淀粉样β蛋白和微管相关tau蛋白表达的变化),这些改变可能影响精神疾病和神经退行性疾病的病理过程和临床表现[9]。
随着研究的不断进展,人们逐渐提出了中枢胰岛素抵抗的概念(图2)。1992年,Mielke等[13]研究发现,早期散发性阿尔茨海默病患者大脑的葡萄糖利用率整体降低且其氧利用率轻微下降。1994年,Hoyer等[14]提出假设,认为是中枢胰岛素受体转导失败导致氧化葡萄糖代谢和相关代谢的异常,同时认为散发性阿尔茨海默病类似于局限在大脑的非胰岛素依赖型糖尿病。1998年,Frölich等[15]第一次观察到阿尔茨海默病患者的中枢胰岛素及其受体变化情况,首次表明大脑中的胰岛素浓度、C肽浓度以及中枢胰岛素受体密度与年龄相关,随着年龄的增长而降低。在生化水平上,散发性阿尔茨海默病患者大脑内的胰岛素和C肽水平降低、中枢胰岛素受体密度降低,胰岛素信号通路调节异常、下游神经元存活和可塑性机制降低。1998年,Hoyer[16]提出局限于大脑的非胰岛素依赖型糖尿病引起散发性晚发型阿尔茨海默病的假说,即中枢胰岛素抵抗假说。2003年,Feldman[17]认为在产生高血糖症时,葡萄糖介导的氧化应激可以损伤感觉神经元,并且最终导致糖尿病神经病变的发展。
2011年,Kim等[18]提出猜测,认为神经元会像脂肪和肌肉等代谢组织一样发生胰岛素抵抗。其研究结果表明,慢性刺激PI3K/Akt通路是发生胰岛素抵抗的部分原因,证明了体内长期胰岛素刺激导致Akt信号和线粒体生物发生中断是导致背根神经节神经元中胰岛素抵抗的一种形式。这个结果为糖尿病神经病变的发病机制引入了一个新概念,即与代谢组织类似,神经元也会发生胰岛素抵抗[18]。
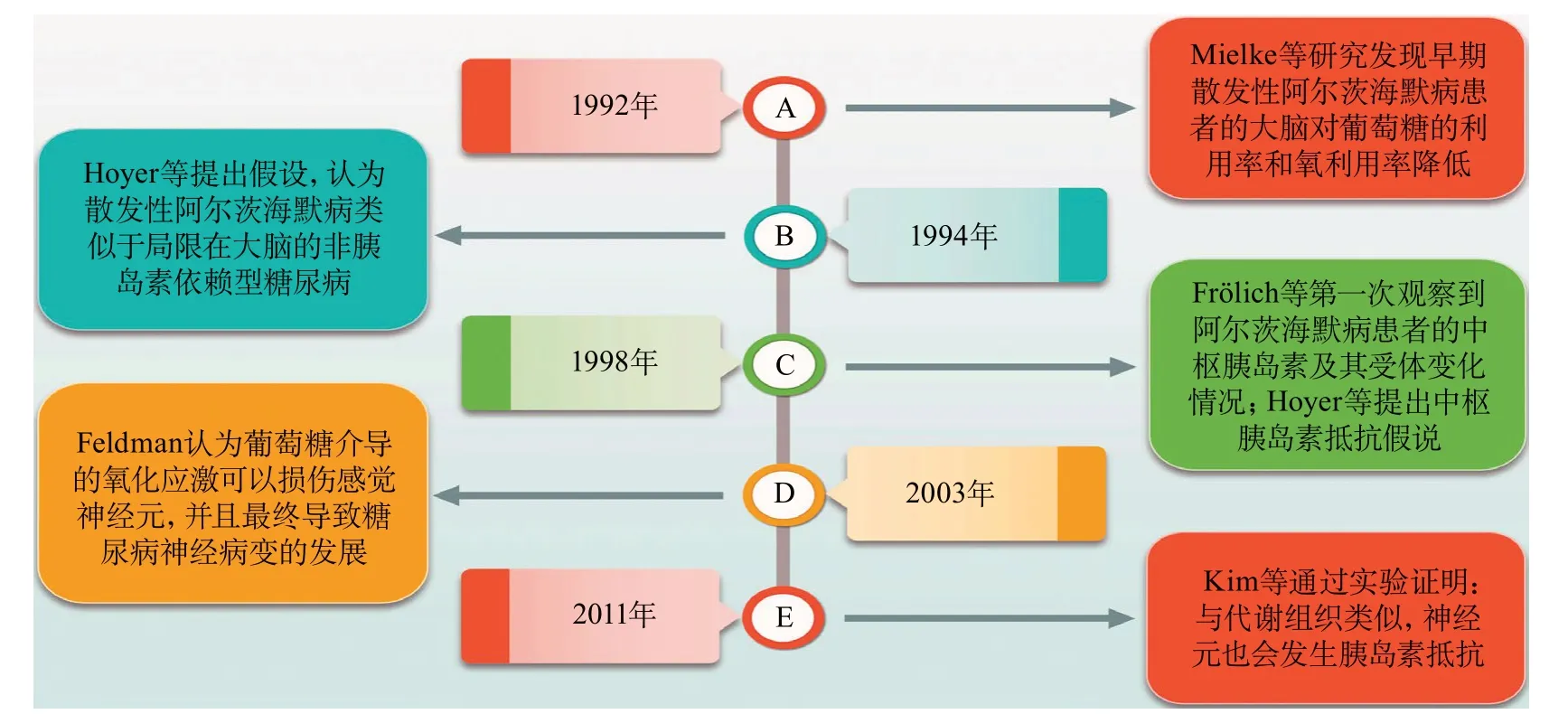
图2 中枢胰岛素抵抗的历史沿革
从散发性阿尔茨海默病患者的大脑中发现葡萄糖利用率降低与氧利用率下降,到提出中枢胰岛素抵抗的假说,再到实验发现神经细胞可发生胰岛素抵抗,如今已经证明大脑不仅是胰岛素敏感器官,同时也可发生胰岛素抵抗。中枢胰岛素抵抗的现象经历了一定的时间之后才逐渐受到人们的关注,其以中枢胰岛素受体的减少和中枢胰岛素信号通路的破坏为表现,导致胰岛素作用障碍,引发神经病变。
目前发现,肥胖或2型糖尿病患者体内的代谢障碍所致的高胰岛素血症会降低中枢胰岛素作用,导致中枢胰岛素抵抗。除此情况外,人们将存在单纯的中枢胰岛素抵抗而无全身胰岛素抵抗的状态定义为3型糖尿病,这种状态由外周代谢改变、代谢应激和炎症等原因造成,导致细胞功能障碍和神经元死亡,引起阿尔茨海默病的发展。对于发生阿尔茨海默病之前出现的中枢胰岛素抵抗,有研究认为其发生与脑炎症相关,与糖尿病或肥胖导致的外周胰岛素抵抗具有类似的机制,然而相关研究有限,具体原因和机制都有待进一步探索[19-23]。
有证据表明,胰岛素受体的低活化是除高胰岛素血症、代谢应激和炎症之外的另一种常见的、但较少讨论的中枢胰岛素抵抗机制[24-25]。下调线粒体过氧化氢(hydrogen peroxide,H2O2)信号可能会导致胰岛素受体的激活减少,引起中枢胰岛素抵抗。有研究提出,在这种情况下,以改善线粒体代谢为目的的干预措施可以改善神经元中胰岛素介导的H2O2信号,是一种在受体激活水平上改善中枢胰岛素抵抗的合理方法[24]。
3 中枢胰岛素抵抗和脑血管病的关系
胰岛素除了在体内能量代谢中起到重要的作用以外,还作为血管活性激素调节脑部的血流及神经元功能[26]。在中枢神经系统中,胰岛素作用对神经血管有着重要的保护作用。
目前,国内外已有实验证明,经鼻胰岛素给药对大脑具有神经保护的潜在作用,并可改善其功能预后。其中有实验观察到,经鼻胰岛素给药可激活慢性脑缺血小鼠模型缺血侧海马区的胰岛素通路相关蛋白的磷酸化水平,改善小鼠近记忆能力、空间学习能力及空间记忆能力[1]。有研究发现,鼻腔滴入胰岛素样生长因子1可降低缺氧缺血性脑损伤大鼠脑组织中半胱氨酸天冬氨酸蛋白酶3蛋白的表达,对损伤部位脑组织产生保护作用[2]。Shen等[3]实验证明,鼻内骨髓间充质干细胞和胰岛素样生长因子-1组合给药可以改善神经血管化和局灶性脑缺血后的功能预后。因此,中枢胰岛素作用与脑血管病的预后之间存在密切的联系,对脑功能具有一定的保护作用。
在胰岛素抵抗模型的动物实验中,人们发现中枢胰岛素信号胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)/Akt介导的p53下调能够减轻新生儿缺血缺氧后的神经血管损伤,表明中枢胰岛素信号在脑血管病发生神经血管损伤的相关过程中起作用[4]。有实验研究证明胰岛素作用通过多种机制调节脑血管反应性,中枢胰岛素作用将增加脑血流灌注[27-28]。因此,中枢胰岛素抵抗将可能导致脑血管功能障碍,这种变化将带来进一步的损伤,可能与脑血管病之间存在联系。
Arvanitakis等[5]在一项基于社区的流行病学临床病理研究中证明中枢胰岛素抵抗程度与脑梗死等脑血管病有联系。该研究通过记录研究对象死后额叶中回皮质组织中的IRS-1和丝氨酸/苏氨酸蛋白激酶等分子信号指标,发现该区域内中枢胰岛素抵抗程度越高,脑梗死的发生率越高;体外刺激人类死亡脑组织后,pT308Akt1的升高与更多的脑血管病有关;pS616IRS1免疫标记水平越高,胰岛素抵抗程度越严重,与包括严重梗死和微梗死在内的脑梗死等脑血管病有关;与非糖尿病患者相比,糖尿病患者存在程度更严重的中枢胰岛素抵抗[5]。由于糖尿病与脑血管病发生相关[29-30],由此可推测中枢胰岛素抵抗可能是导致脑血管病的原因之一。
除此之外,鉴于中枢胰岛素的作用,有研究认为血管性认知功能障碍与中枢胰岛素抵抗之间的关系值得更进一步的研究[31]。
综上所述,目前研究证明中枢胰岛素具有保护神经血管功能的作用,中枢胰岛素抵抗的存在将影响该作用的实现,并与脑梗死、血管性认知功能障碍等脑血管病的发生有密切的关系。现有的研究大多围绕外周胰岛素抵抗开展,与中枢胰岛素抵抗相关的较少。中枢胰岛素抵抗与脑血管病之间的具体联系仍有待探索,明确其潜在的病理生理机制将有助于解决与中枢胰岛素抵抗相关的脑血管病的临床问题。
4 中枢胰岛素抵抗的评估方法
中枢胰岛素抵抗的发展将导致许多中枢神经系统病变,因此,能够在具有发生中枢神经系统疾病危险因素的人群中进行中枢胰岛素抵抗程度的评估,将有助于提前对其进行干预、减慢疾病的进程、防止疾病发生发展。但在目前的研究中,评估中枢胰岛素抵抗的方法有限。常用评价方法如下所述。
4.1 高胰岛素-正葡萄糖钳夹结合影像技术在外周,高胰岛素-正葡萄糖钳夹是评估胰岛素抵抗的“金标准”,该方法以恒定的速率静脉输注胰岛素的同时,以可变速率输入葡萄糖来维持正常血糖。葡萄糖输注速率越高,胰岛素敏感性越高。高胰岛素-正葡萄糖钳夹增加了中枢神经系统中胰岛素的浓度,将其与MRI、脑电图和脑磁图等技术相结合,可以检测胰岛素对大脑的影响以及大脑和外周胰岛素敏感性的关系[6,12,31-32]。
4.2 丝氨酸磷酸化与总磷酸化胰岛素受体底物比率 在分子水平上,丝氨酸磷酸化胰岛素受体底物与总磷酸化胰岛素受体底物的比率可作为大脑或外周组织中胰岛素抵抗的标志物,该比率越大表明胰岛素抵抗程度越严重。将该比率与胰岛素对脑组织的体外刺激一起应用,可显示阿尔茨海默病患者的中枢胰岛素抵抗[31]。
4.3 经鼻给药 经鼻输注胰岛素后未能引起神经的影像学变化或神经生理反应被认为是产生中枢胰岛素抵抗的证据。经鼻给药法将胰岛素以鼻喷雾的形式给药,胰岛素进入鼻黏膜后经嗅觉器官和三叉神经通路绕过血脑屏障被转运进入中枢神经系统。经鼻给药的实验中,只有少量胰岛素被吸收入循环,从而将外周胰岛素的增加降低到最小。该方法可以选择性地评估胰岛素的中枢刺激对大脑的激活与抑制以及对外周代谢的影响[31]。
4.4 测定神经源性血浆外泌体中胰岛素受体底物-1的水平及其磷酸化状态 IRS-1/-2的磷酸化模式调节其稳定性、受体结合和信号传导能力。IRS-1/-2的部分酪氨酸残基的磷酸化促进信号功能,而酪氨酸的去磷酸化和(或)一些丝氨酸和苏氨酸残基的磷酸化是导致IRS-1/-2从胰岛素受体解离并减少胰岛素信号的生理机制。因此,IRS-1/-2中酪氨酸和丝氨酸/苏氨酸的磷酸化失调可能导致胰岛素抵抗的病理状态。神经源性血浆外泌体通过与抗神经细胞黏附分子-1或抗神经细胞黏附分子L1抗体结合而被吸收分离,并已成为可量化的阿尔茨海默病致病蛋白的来源。目前已有研究通过检测阿尔茨海默病患者血浆外泌体中IRS-1的水平及其磷酸化状态来评估其中枢胰岛素抵抗[33]。
目前与中枢胰岛素抵抗相关的研究重点大多数落在2型糖尿病、肥胖症或阿尔茨海默病等疾病上,普遍认为中枢胰岛素抵抗与神经退行性变、记忆功能障碍和认知障碍等有关。现在,研究发现中枢胰岛素抵抗与脑血管病存在联系,但相关研究数量较少,更深层次的机制还有待进一步发现。探索中枢胰岛素抵抗的发生机制、阐明其与脑血管病的关系将有助于为疾病的治疗提供新的方向和靶点,解决更多的临床问题。

