AD患者18F-FDG PET/CT脑显像糖代谢改变模式亚型研究
贾琛皓 梁梦琳 郭瑞杰 刘霖雯 袁晶 崔瑞雪
阿尔茨海默病(Alzheimer disease,AD)是一种以进行性加重的认知障碍为主的神经变性病,其标志性病理学改变是细胞外β-淀粉样蛋白(amyloid beta,Aβ)沉积形成的神经炎性斑块和细胞内异常磷酸化Tau蛋白形成的神经纤维缠结[1]。AD患者临床表现复杂且存在明显异质性,典型AD患者早期以记忆力下降为主,但也存在多种非典型临床综合征如后皮质萎缩、语言功能障碍和额叶变异型[2]。早期与其他神经变性病如额颞叶变性病(frontotemporal lobe degeneration,FTLD)及路易体痴呆(dementia with Lewy bodies,DLB)等疾病难以鉴别。以正电子发射断层显像(positron emission tomography,PET)为代表的分子显像能提供敏感和特异的客观指标。反映脑糖代谢的示踪剂18F-脱氧葡萄糖(fluorodeoxyglucose,FDG)为 PET/计算机体层成像(computed tomography,CT)显像最常用的显像剂。各种神经变性病在病程早期甚至临床前期即出现特征性脑糖代谢改变,18F-FDG PET/CT显像可对神经变性病的早期诊断和鉴别诊断提供很大帮助,已逐渐得到临床认可并且得到越来越广泛应用。
AD患者典型的18F-FDG PET脑显像为对称性的颞顶叶皮层代谢减低,早期颞叶内侧、海马区和后扣带回代谢减低最明显[3],本文作者团队既往工作经验及文献均表明AD患者的脑显像表现也存在异质性[4],除典型的颞顶叶对称性代谢减低外,有些患者两侧大脑皮层代谢改变不完全对称,有些患者也会出现额叶或枕叶代谢不均匀减低[5-6],与FTLD和DLB代谢改变累及脑区有交叉重叠。本研究对一组Aβ蛋白PET显像阳性、临床诊断为很可能AD患者的18F-FDG PET脑显像进行定量分析和分型,总结各亚型代谢减低脑区分布特点,并分析不同亚型间临床表现的差异,以期更全面地认识AD患者的18F-FDG PET脑代谢改变模式和临床表现的异质性,帮助临床更好地进行早期诊断和鉴别诊断。
1 对象和方法
1.1 研究对象收集2020年1月至2022年3月间于北京协和医院神经科诊断为很可能AD患者(AD组)共51例,其中男15例、女36例,年龄50~84岁,平均年龄(67.8±17.8)岁。纳入标准:(1)很可能AD患者β淀粉样蛋白(18F-AV45)PET/CT显像根据《淀粉样PET脑显像技术规范专家共识》[7]诊断为阳性(图1)。(2)年龄≥50岁,男女不限。排除标准:(1)合并中枢神经系统感染性疾病、中枢神经系统肿瘤、头部外伤、有颅脑手术史及酒精和/或药物滥用者;(2)有严重心、肝、肾功能不全者。
纳入认知功能正常的健康体检者10名(资料来源于作者医院18F-FDG PET/CT检查数据库)为对照组,其中男、女各5例,年龄50~72岁,平均年龄(62.2±10.2)岁。纳入标准:(1)与很可能AD患者同期行18F-FDG PET/CT检查且图像质量合格;(2)年龄≥50岁,男女不限。排除标准:(1)无神经系统疾病;(2)无与认知障碍有关的神经系统性疾病家族史。
AD组与对照组年龄、性别差异无统计学意义(均P>0.05)。
本研究已经过北京协和医院伦理审查委员会审批(审批号JS2423)。
1.2 方法
1.2.1PET/CT显像剂制备、注射及图像采集:显像剂18F-FDG及18F-AV45均由北京协和医院核医学科PET中心自行制备(放化纯>95%),给药方式均为静脉注射。所有受试者(很可能AD患者和对照组)18F-FDG注射前需禁食6 h以上且血糖<7 mmol/L,18F-FDG注射剂量为按体重3.7 MBq/kg;很可能AD患者18F-AV45注射剂量为按体重5.55 MBq/kg。
静注示踪剂后在安静、避光环境中闭目休息约60 min后使用PET/CT机器(赛诺公司Pole star m680)进行脑部图像采集。低剂量头部CT扫描用于衰减矫正;10 min脑部PET三维图形(three-dimensional,3D)扫描。采用有序子集最大期望值方法(ord-ered subsets expectation maximization,OSEM)进行PET图像重建。

注:红色区域为18F-FDG代谢最高区域和Aβ沉积最多区域;MMSE:简易智力状态检查量表;MoCA:蒙特利尔认知评估量表;Aβ:β-淀粉样蛋白图 1 一例很可能AD患者典型的18F-FDG及18F-AV45 PET/CT连续横断层图像,18F-FDG PET/CT示部分顶叶(A)、后扣带回(B)、部分额叶皮层(C)代谢减低及双侧颞叶内侧(D)代谢对称性明显减低(图中箭头所示);18F-AV45 PET/CT示大脑皮质Aβ弥漫沉积。患者为77岁女性,主要表现为记忆力下降,焦躁不安,MMSE评分25分,MoCA评分17分
1.2.218F-FDG PET图像分析:(1)视觉分析:视觉分析是就是根据PET图像18F-FDG代谢减低或者增高的不同进行视觉判读,对不同疾病进行诊断及鉴别诊断。由两位高年资核医学科医师在不参考临床资料的情况下对18F-FDG PET图像判读,参考既往研究[4-6,8],并根据所见18F-FDG代谢异常脑区分布情况,将本组很可能AD患者分为不同亚型组。
(2)参数统计图(statistical parametric mapping,SPM)12软件基于体素的脑18F-FDG PET代谢图像定量分析:首先使用MRIcroGL软件将所有受试者的18F-FDG PET原始图像进行格式转化,医学数字成像和通信(digital imaging and communications in medicine,DICOM)格式转为神经影像学信息技术计划(Neuroimaging Information Technology Program,NIfTI)格式。然后采用SPM12软件以蒙特利尔神经病学研究所PET脑模型对图像进行标准化处理,并对标准化图像进行平滑处理,之后对预处理图像进行定量分析,分别将视觉分析所获得不同AD亚型组与对照组的图像进行基于体素的两样本t检验,将具有统计学差异(P<0.001)的脑区作为显著异常代谢改变脑区,并使用xjview软件将统计学差异的脑区投射至横断面T1加权(T1 weighted image,T1WI)标准模板上进行显示。
1.3 统计学处理使用SPSS 26.0软件进行分析。使用Kolmogorov-Smirnov进行正态性检验,计量资料数据符合正态分布,以均数±标准差表示,AD组与对照组两组间比较使用独立样本t检验;不同亚型组间比较使用多组间单因素方差分析。计数资料以频数(百分比)表示,AD组与对照组间比较使用卡方检验;不同亚型组间比较使用卡方检验。所有多组间两两比较均采用事后多重检验。以P<0.05的差异具有统计学意义。
2 结果
2.1 视觉分析结果视觉分析显示,所有患者18F-FDG在脑内代谢均明显减低。根据每位患者18F-FDG在脑内代谢减低最明显的部位,初步分为4种亚型:(1)以边缘系受累为主(A型)31例,主要以双侧颞叶内侧皮层,后扣带回和顶叶18F-FDG代谢减低为著;(2)以顶颞叶外侧皮层及额叶受累为主(B型)4例,颞叶内侧皮层代谢活性相对保留;(3)以后皮质代谢减低为著(C型)8例,以顶枕叶和颞叶后外侧皮层代谢减低为主;A、B、C三种亚型两侧大脑皮层代谢减低区基本对称性分布。(4)两侧不对称(D型)8例,表现为两侧半球代谢减低区不对称,其中7例患者以左侧颞叶代谢减低为主,1例患者为右侧颞叶代谢减低为主。
2.2 SPM基于体素的脑代谢图像定量分析结果对视觉分析产生的4种AD代谢模式亚型与对照组基于体素的脑代谢图像定量分析的SPM处理结果见图2。差异有统计学意义(P<0.001)脑皮层代谢减低区投射到横断面T1WI标准模板上,用黄红色伪彩显示脑代谢减低区域,黄色区域为减低最明显区域。
与对照组相比,A型患者的颞叶内侧皮层及后扣带回代谢减低最为明显,两侧顶叶背外侧皮层亦可见代谢减低。B型患者的顶叶背外侧皮层及颞叶外侧皮层代谢减低最为显著,双侧颞叶内侧未见明显代谢减低,后扣带回减低程度也低于A型,但额叶代谢减低程度较A型明显。C型患者的顶叶皮层、枕叶皮层、颞叶后外侧皮层及后扣带回代谢减低最显著,后皮质减低程度及范围明显高于额叶,颞叶前外侧皮层及颞叶内侧皮层代谢减低不明显。D型患者以单侧颞叶18F-FDG代谢为主,左侧颞叶代谢减低多见(7例),在定量处理过程中已对右侧颞叶受累患者(1例)18F-FDG PET图像进行左右翻转。
2.3 AD不同低代谢亚型的临床特征分析结果见表1。所有患者均有记忆功能下降表现,各组间差异无统计学意义(P>0.05)。在执行功能下降、视幻觉及空间障碍及语言功能下降方面,四组间具差异有统计学意义(P<0.05),其中A型主要以记忆功能下降为主,其他方面功能减低不明显;B型组更易出现执行功能下降〔4(100.0%)〕,C型组视空间障碍表现更为明显〔7(87.5%)〕,D型组患者语言障碍突出〔7(87.5%)〕,差异具统计学意义(均P<0.05)。
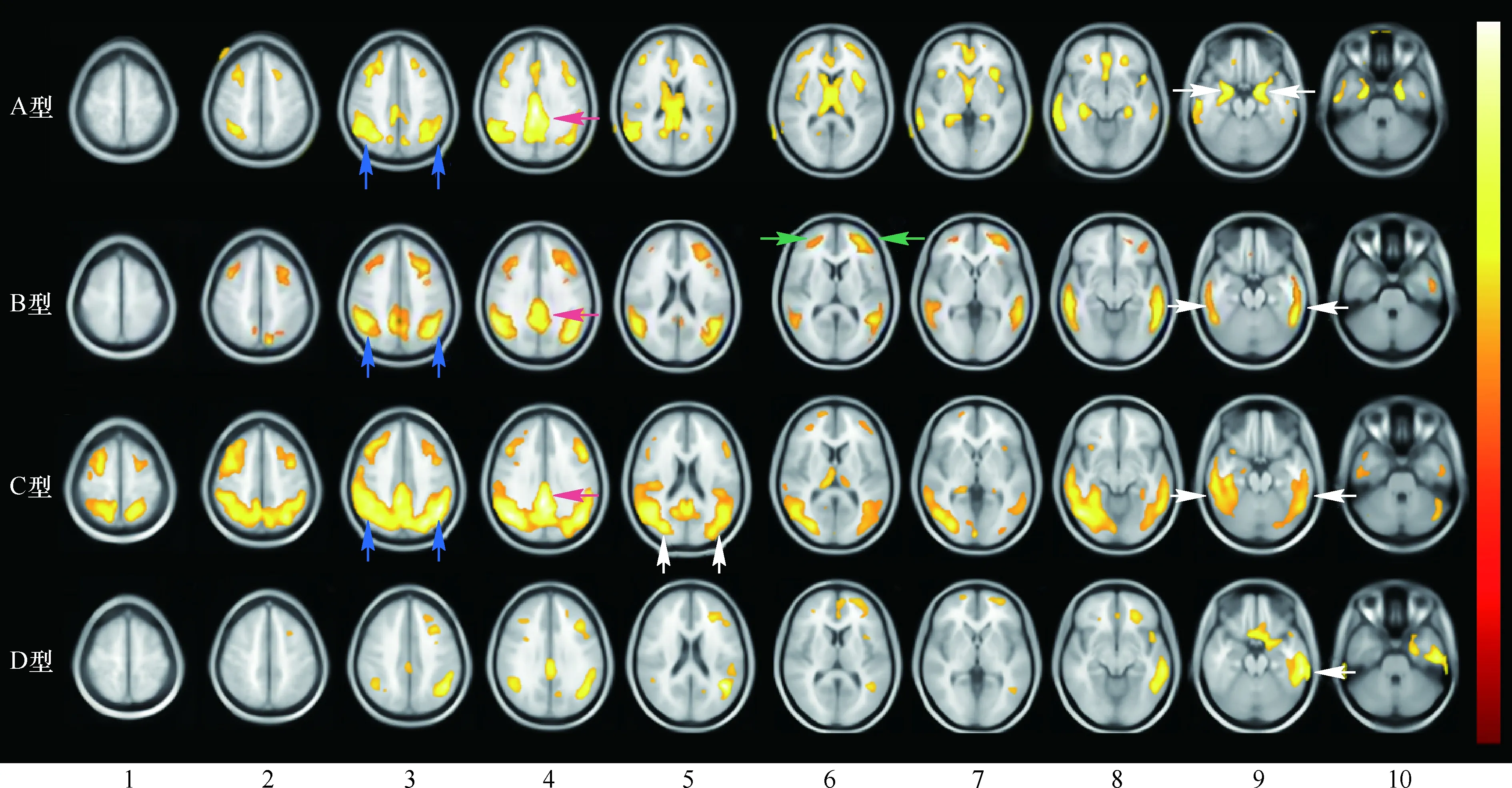
注:AD:阿尔兹海默病;A型:边缘系受累组;B型:顶颞叶外侧皮层及额叶皮层组;C型:后皮质组;D型:不对称单侧颞叶组;横向图像1~10为软件把FDG代谢有差异的脑区叠加在脑部断层解剖的连续显像,第3~6列分别为顶叶背外侧层面、后扣带回层面、枕叶层面和额叶层面,第9列为颞叶外侧层面 图 2 4种AD代谢模式亚型与对照组基于体素的脑代谢图像SPM定量分析结果: A型组两侧顶叶背外侧皮层(3列蓝箭头)、后扣带回(4列红箭头)及颞叶内侧皮层(9列白箭头)代谢减低; B型组顶叶背外侧皮层(3列蓝箭头)、后扣带回(4列红箭头)、额叶(6列绿箭头)及颞叶外侧皮层(9列白箭头)代谢减低; C型组顶叶皮层(3列蓝箭头)、后扣带回(4列红箭头)、枕叶皮层(5列白箭头)及颞叶后外侧皮层(9列白箭头)代谢减低; D型组左侧颞叶代谢减低(9列白箭头)

表1 AD不同低代谢亚型临床特征的差异
3 讨论
由于AD存在异质性,因此许多研究从症状学、影像学、基因型及神经病理机制等不同角度对AD进行了分型研究。不同亚型的AD患者可能对疾病治疗有不同的反应,区别并全面认识这些不同亚型很重要,可以增强对AD发病机制的理解,提高临床早期诊断及鉴别诊断,有望改善患者预后[9]。
影像学方面,磁共振成像(magnetic resonance imaging,MRI)根据局部皮层萎缩的模式将AD主要分为3种亚型[10]。Vogel等[8]对1143例AD患者的Tau蛋白的沉积部位和扩散模式进行纵向研究,将AD分为了4四种亚型。Levin等[4]对177例淀粉样蛋白阳性AD患者的18F-FDG PET数据进行定量分析,提出了3种主要的AD低代谢亚型。
18F-FDG PET可在MRI发现,脑萎缩之前,即能够更早更灵敏地检测到大脑葡萄糖代谢降低[11]。Aβ显像及Tau蛋白 PET/CT显像成本昂贵,普及度低,许多PET中心难以常规开展相关工作,相比之下,18F-FDG 是PET最常用的示踪剂,且在各种神经变性病中均有特征性的代谢改变模式。所以对AD患者18F- FDG PET的图像进行分型研究,在目前最具指导意义和临床应用价值。
本组患者的特异性病理显像-淀粉样蛋白显像均为阳性,结合临床表现和认知量表评分等综合判断,诊断为很可能AD。
既往研究表明,AD患者的Tau蛋白异常沉积部位与18F-FDG代谢减低区存在着高度一致,且二者存在反向定量关系[12],本文作者团队前期相关Tau PET与18F-FDG PET显像经验也证明这一点。因此,本研究参照Vogel等[8]提出的Tau沉积部位和扩散模式的分型,通过视觉分析将这组AD患者18F-FDG脑代谢改变分为4种不同的亚型,并进一步将各亚型图像与对照组进行体素基础上的SPM定量分析,证明了不同AD患者18F-FDG脑代谢改变存在异质性。
本组AD患者中,通常认为的AD典型表现(A型)者例数最多,边缘系受累明显,主要表现为近期记忆进行性下降。B型颞叶内侧活性大体保留,患者均表现为执行功能下降,这可能与前额叶受累相关。C型视幻觉及空间障碍显著〔7(87.5%)〕,这一表现与枕叶的代谢减低相符合,且与其他三组均存在统计学差异(P<0.05)。D型患者多为左颞叶受累〔7(87.5%)〕,出现语言障碍比例更高。
本研究结果显示,AD患者存在这些不典型的代谢改变亚型,在图像判读时要密切结合临床。其中,B型须与FTD鉴别,C型须与DLB进行鉴别[13]。DLB患者的扣带回代谢相对保留,此特征具有高度特异性[14],可与AD进行区分。D型的语言障碍易与FTLD引起的语义性痴呆(semantic dementia,SD)或进行性非流利性失语(progressive non-fluent aphasia,PNFA)表现混淆[15]。必要时可结合其他更特异的分子显像,如Aβ、Tau蛋白或多巴胺能PET显像进一步鉴别。
AD病程不同则临床表现可能不同,对代谢减低脑区分布必然也有影响。本研究入组的样本量偏少,且仅为单次显像的横断面研究,对AD各代谢亚型的病程未进行分层研究,可能存在一定偏倚。后期需扩大样本量及进行纵向系列PET显像,对不同亚型的病理发展机制及其代谢减低脑区的发展变化进行更深入研究。
综上,本研究通过总结AD患者的18F-FDG PET上低代谢改变模式的多种亚型,及初步分析各亚型临床表现的差异,可帮助更全面的认识不同AD患者18F-FDG PET图像表现,提高AD的早期诊断和鉴别诊断水平。

