基于高分辨率熔解曲线技术的CRISPR/Cas9介导的细胞基因突变快速检测研究
陈黎 卢茜 杨红兰 张鹏,2 何志旭,2,3
(1.贵州医科大学基础医学院免疫学教研室 组织工程与干细胞实验中心,贵阳550004;2.中国医学科学院成体干细胞转化研究重点实验室,贵阳 550004;3.遵义医科大学附属医院儿科,遵义 563000)
基于CRISPR/Cas9基因编辑技术的位点特异性突变在生命科学领域越来越普遍[1],该技术已应用于基因治疗、基因功能研究、动物模型制作及农作物品种改良等领域[2]。由于载体构建简单、靶向位点选择灵活等优点,CRISPR/Cas9基因编辑技术被广泛用于各类细胞的基因编辑[3]。该技术利用人工设计的向导RNA(single-guide RNA,sgRNA)介导外源表达的Cas9蛋白与基因组的靶位点特异性地结合,进而实现对基因组DNA特异性地切割。靶位点被切割后,一般会通过DNA损伤修复机制进行修复,在此过程中多会引入碱基的插入或缺失,从而导致基因突变。目前,检测细胞基因突变的金标准为DNA测序法,但进行测序的周期较长,不利于CRISPR/Cas9基因编辑产物的快速及高通量筛选。因此,建立一种高效快速地检测CRISPR/Cas9介导的细胞基因突变的方法具有广阔的应用前景。
高分辨率熔解曲线(high-resolution melting,HRM)分析技术是近年来发展起来的用于突变扫描和基因分型的新技术。其原理为:熔解曲线与DNA的序列长度、GC含量及双链互补性相关[4],碱基序列发生替换、缺失、插入等改变均可引起DNA熔解曲线的变化,通过高灵敏度荧光定量PCR仪检测的熔解曲线变化,把野生型、纯合突变型及杂合突变型予以鉴别[5]。不同与其他突变扫描方法,高分辨率熔解曲线技术进行突变分析为闭管操作,降低了污染风险,减少了分析时间,不需要在PCR后进行样品处理或分离[6]。该技术已广泛应用于疾病诊断、耐药菌株基因分型、单核苷酸多态性分型、甲基化检测等方面的研究[7-11]。
本研究建立的高分辨率熔解曲线法能够鉴别野生型、纯合突变及杂合突变小鼠胚胎干细胞,同时应用建立的高分辨率熔解曲线分析方法能对CRISPR/Cas9介导的小鼠胚胎干细胞基因突变进行快速检测,是一种灵敏、准确、简便、高通量的方法。该高分辨率熔解曲线方法将为细胞基因突变快速筛选及细胞基因功能研究奠定坚实的基础。
1 材料与方法
1.1 材料
配制的细胞裂解液成分为:①Tris 50 mmol/L,②CaCl210 mmol/L,③蛋白酶K 250 ng/mL,④SDS 1.7 μmol/L, ⑤ 双 蒸 水 ;KnockOut DMEM、KSR、NEAA、Glutamine及β-巯基乙醇均购买于Thermo Scientific公司;双抗购买于Biological Industries公司;LIF购买于Merck公司;PD0325901及CHIR99021购买于MedChemExpress公司;Lipofectamine 3000转染试剂购买于invitrogen公司;小鼠胚胎干细胞制备参考文献[12];甲基结合蛋白1基因的Cas9/sgRNA表达载体构建参考文献[13];TB Green Premix Ex Taq II为日本TaKaRa公司产品;CFX96荧光定量PCR仪为美国BIO-RAD公司产品。
1.2 方法
1.2.1 小鼠胚胎干细胞培养及质粒转染 小鼠胚胎干细胞培养在经0.2%明胶包被过的细胞培养皿内,细胞培养液为KnockOut DMEM含15% KSR,1%NEAA,1% 双 抗,1% Glutamine,0.1 mmol/L β-巯基 乙 醇,1 000 units/mL LIF,1 μmol/L PD0325901,3 μmol/L CHIR99021。将甲基结合蛋白1基因的Cas9/sgRNA表达载体使用Lipofectamine 3000转染试剂按照说明书转入小鼠胚胎干细胞内,转染2 d后将培养液换为含有终浓度为1 mg/L的嘌呤霉素培养液,嘌呤霉素筛选2 d后消化细胞,然后重悬细胞,在不含嘌呤霉素的培养液中继续培养6 d。
1.2.2 基因突变细胞的鉴定 使用10 μL枪头在体视显微镜下挑取小鼠胚胎干细胞单克隆,将胚胎干细胞单克隆消化后,分别将30%(板1)及70%(板2)的细胞培养在两个不同的96孔板中。96 h后,板2中的小鼠胚胎干细胞融合度达70%-80%时,弃掉培养基,用PBS清洗细胞一遍,然后加入50 μL的细胞裂解液。用封板膜将96孔板封板后,按以下条件处理:-20℃,30 min;55℃,150 min;85℃,10 min。最终以细胞裂解液为DNA模板,进行HRM分析及DNA测序鉴定。
1.2.3 引物设计与合成 根据甲基结合蛋白1基因敲除位点设计上下游引物,敲除位点位于甲基结合蛋白1基因的第2号外显子转录起始位点附近。
HRM1 上游引物为 :5′-CGGGAGACGTTGGAAACTCA-3′,HRM1 下游引物为 :5′-GAGCACACCCGTTACCTCTG-3′,扩增产物长度为394 bp。
HRM2 上游引物为 :5′-CTTGCAGGCTTCTGTTCTGT-3′,HRM2 下游引物为 :5′-ACTCTCGGCGTTTCCAGCCA-3′,扩增产物长度为91 bp。
DNA测序引物同HRM1引物。
1.2.4 反应体系及条件的优化 荧光定量PCR反应体系如下:0.8 μL细胞裂解液、0.8 μL上游引物(HRM1、HRM2)、0.8 μL下 游 引 物(HRM1、HRM2)、TB Green Premix Ex Taq II:10 μL、无酶无菌水补足至总体积20 μL。
采用HRM1引物时,反应条件如下:95℃预变性3 min;39个扩增循环(95℃变性30 s,63℃退火30 s,72℃延伸30 s);95℃ 3 min;95℃ 30 s;40℃1 min;熔解温度60-94.5℃,0.3℃/步,增加0.3℃/10 s。
采用HRM2引物时,反应条件如下:95℃预变性3 min;39个扩增循环(95℃变性30 s,57℃退火30 s,72℃延伸30 s);95℃ 3 min;95℃ 30 s;40℃1 min;熔解温度60-94.5℃,0.3℃/步,增加0.3℃/10 s。
1.2.5 HRM分析结果验证甲基结合蛋白1基因突变 对30个测序结果已知的CRISPR/Cas9技术编辑过的小鼠胚胎干细胞单克隆进行HRM检测,根据熔解温度与熔解曲线的差异区分野生型、纯合突变型和杂合突变型,以验证建立的HRM方法的可行性和准确性。
2 结果
2.1 HRM检测方法的建立与优化
根据甲基结合蛋白1基因敲除位点设计进行HRM分析的上下游引物,分别以野生型、纯合突变及杂合突变小鼠胚胎干细胞的细胞裂解液为DNA模板进行PCR,PCR结束后直接进行HRM分析。结果表明,野生型PCR扩增产物为394 bp时,野生型、纯合突变型及杂合突变型的模板所产生的熔解曲线差异较小,另外熔解温度与温度变化梯度(导数)结果显示,394 bp扩增产物出现两个峰值(图1)。为了提高HRM检测的灵敏度,缩短了进行HRM分析的扩增产物长度。当野生型PCR扩增产物为91 bp时,野生型、纯合突变型及杂合突变型的熔解曲线具有明显差异,并且导数图峰值只有一个(图2)。表明优化后的HRM检测方法能准确地鉴别野生型、纯合突变及杂合突变小鼠胚胎干细胞。测序结果见图3。

图1 野生型PCR扩增产物为394 bp时,野生型、纯合突变型及杂合突变型高分辨率熔解曲线分析图Fig.1 Analysis of high-resolution melting of wild-type mESCs,homozygous mutation mESCs and heterozygous mutation mESCs when the PCR product of wild-type mESCs is 394 bp

图2 野生型PCR扩增产物为91 bp时,野生型、纯合突变型及杂合突变型高分辨率熔解曲线分析图Fig.2 Analysis of high-resolution melting of wild-type mESCs,homozygous mutation mESCs and heterozygous mutation mESCs when the PCR product of wild-type mESCs is 91 bp

图3 野生型、杂合突变型和纯合突变型的测序结果Fig.3 Sequencing results of wild-type mESCs,heterozygous mutation mESCs and homozygous mutation mESCs
2.2 HRM分析结果验证甲基结合蛋白1基因突变
用本研究建立的HRM方法对30个测序结果已知的CRISPR/Cas9技术编辑过的小鼠胚胎干细胞单克隆进行检测和分析。测序结果表明,14个小鼠胚胎干细胞单克隆为野生型,未发生基因突变。16个突变的小鼠胚胎干细胞单克隆中,14个单克隆为杂合突变型,2个单克隆为纯合突变型。代表性测序结果见图4。HRM结果显示,14个杂合突变型、2个纯合突变型与14个野生型小鼠胚胎干细胞单克隆的熔解温度有明显区别(图5)。此外,通过高分辨率熔解曲线图可以明显区分出野生型、杂合突变型和纯合突变型(图6)。表明该HRM分析法准确地鉴别出甲基结合蛋白1基因突变的小鼠胚胎干细胞单克隆,并且与测序结果一致,灵敏度与特异性均为100%。

图4 代表性野生型、杂合突变型和纯合突变型的测序结果Fig.4 Sequencing results of typical wild-type mESCs,heterozygous mutation mESCs and homozygous mutation mESCs

图5 30例CRISPR/Cas9技术编辑过的小鼠胚胎干细胞单克隆熔解温度结果Fig.5 Results of melting temperature of 30 monoclones of mESCs edited by CRISPR/Cas9 techniqe
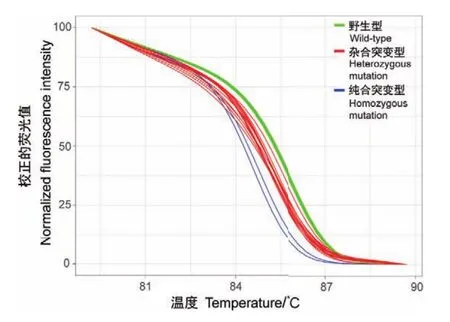
图6 30例CRISPR/Cas9技术编辑过的小鼠胚胎干细胞单克隆高分辨率熔解曲线图Fig.6 High-resolution melting curve of 30 monoclones of mESCs edited by CRISPR/Cas9 technique
3 讨论
CRISPR/Cas9系统是一类广泛存在于细菌和古生物菌体内的免疫防御系统,可以用来抵御外源核酸的入侵[14-15],CRISPR/Cas9技术基于这一系统改造而来。近年来,CRISPR/Cas9基因编辑技术成为科研领域一项很热门的技术,具有设计简单、操作方便,成本低、效率高且可同时进行多位点编辑等优势[16],该技术已广泛应用于多种模式生物及细胞的基因编辑[17-19]。因此,对CRISPR/Cas9介导的细胞基因突变进行快速检测具有广阔的应用前景及重要的实践意义。本研究优化并建立了筛选细胞基因突变的方法,为CRISPR/Cas9介导的基因突变检测提供了一种操作简便、分析周期短的新选择。
目前,常采用酶错配切割方法和DNA测序法对CRISPR/Cas9技术切割产物进行验证。酶错配切割方法是一种低成本、经济的检测基因突变的方法[20],但该方法灵敏度较低,且产物进行电泳后需肉眼观察,可能会引入人为的误差,导致检测结果产生偏差[21]。DNA测序法是检测细胞基因突变的金标准,但样本进行DNA测序前实验操作流程繁琐,需进行PCR扩增目的DNA条带、琼脂糖凝胶电泳及PCR纯化等步骤。样本送检后,检测周期较长,需几天才能得到测序结果。因此,采用DNA测序法检测细胞基因突变,需较长的时间完成突变筛选,不能对CRISPR/Cas9基因编辑产物进行快速检测。且DNA测序的成本较高,不利于大规模的基因突变筛选。有研究报道,在DNA测序前应用高分辨率熔解曲线进行突变扫描是一种有效、灵敏、经济的检测基因突变和减少测序工作的方法[22]。本研究建立的高分辨率熔解曲线法可以快速高效地检测CRISPR/Cas9介导的细胞基因突变,实验操作流程简单,无需提取基因组DNA,无需进行琼脂糖凝胶电泳,无需序列特异性探针。只需设计特异性引物,以细胞裂解液为DNA模板,荧光定量PCR完成后,直接进行熔解曲线分析即可。与酶错配切割方法和DNA测序法相比,该高分辨率熔解曲线法具有简便、经济、准确、检测周期短等优点,详见表1。

表1 3种检测CRISPR/Cas9基因编辑产物方法比较Table 1 Comparison of three methods of detecting gene products edited by CRISPR/Cas9 technique
本研究采用的高分辨率熔解曲线技术是通过实时监测升温过程中双链DNA荧光染料与扩增产物之间的结合情况而完成,碱基序列发生替换、缺失、插入等均可引起DNA熔解曲线的变化,进而能有效区分出野生型、纯合突变型及杂合突变型。扩增产物长度是影响高分辨率熔解曲线关键问题之一,有研究表明,进行HRM分析的扩增产物较短时,能够提高HRM检测的灵敏度[23]。本研究中,野生型PCR扩增产物为394 bp时,野生型、纯合突变型及杂合突变型的模板所产生的熔解曲线差异较小。而缩短了进行熔解曲线分析的扩增产物长度,野生型PCR扩增产物变为91 bp时,野生型、纯合突变型及杂合突变型的熔解曲线具有明显差异,熔解曲线辨识度非常好,能清晰辨别基因型。表明优化后的HRM分析方法具有较高的检测灵敏度,能够准确地鉴别野生型、纯合突变型及杂合突变型。应用本研究建立的HRM方法对30个CRISPR/Cas9技术编辑过的小鼠胚胎干细胞单克隆进行分析,检测出14个杂合突变型、2个纯合突变型及14个野生型,灵敏度和特异性均为100%,纯合突变型及杂合突变型可以根据熔解温度与熔解曲线的差异有效地与野生型进行区分。提示该HRM法能对CRISPR/Cas9介导的基因突变进行快速筛选,是一种高效、准确的分子诊断方法。
本研究建立了细胞基因突变的高分辨率熔解曲线检测方法,该方法简便、快速、可靠、重复性好,可用于大规模的CRISPR/Cas9介导的细胞基因突变分析,为细胞基因突变快速筛选及细胞基因功能研究奠定坚实的基础。
4 结论
本研究针对CRISPR/Cas9介导的细胞基因突变缺乏灵敏、快速的检测方法问题,建立了一种简便、准确、经济、高通量的高分辨率熔解曲线分析方法。经过条件的优化,该高分辨率熔解曲线法能明显区分出野生型、纯合突变型及杂合突变型,同时应用建立的高分辨率熔解曲线分析方法能对CRISPR/Cas9介导的细胞基因突变进行高效快速地检测。

