深圳市康宁医院精神卫生专业药物临床试验不良事件的特征分析
胡四琴,张 璇,沈小丹,秦 转
(深圳市精神卫生中心<深圳市康宁医院>药物临床试验机构办公室 广东 深圳 518118)
精神疾病往往会导致患者身心均遭受创伤,增加患者家庭以及社会的经济负担,其中药物在精神疾病治疗中扮演着至关重要的角色,但新药的临床应用需完成有关药物临床试验后方能申请[1-2]。药物临床试验指以人体为对象的临床试验,目的在于发现或验证某种试验药物临床医学、药理学以及其他药效学作用,抑或是试验药物吸收、分布、代谢以及排泄等情况,从而明确药物的疗效和安全性[3-4]。药物临床试验不良事件指受试者接受试验用药品后出现的所有不良医学事件,可以表现为症状体征、疾病或者实验室检查异常,但不一定与试验用药物有因果关系[5-7]。本文通过研究深圳市康宁医院精神卫生专业药物临床试验中不良事件与试验药物的相关性,旨在为药物临床试验不良事件的处理和管理提供指导,现报道如下。
1.资料与方法
1.1 一般资料
选取2015 年—2021年深圳市康宁医院精神卫生专业药物临床试验所发生的637例不良事件作为研究对象。
1.2 方法
收集内容涵盖下述几项:①不良事件和所有相关症状描述;②发生的时间;③终止时间;④严重程度以及发作频率;⑤因不良事件所开展的检查;⑥是否需要治疗,若治疗则需记录相关治疗情况;⑦不良事件最终结果;⑧是否和试验药物有关。其中重度含严重不良事件,即药物临床试验期间发生的需住院治疗、延长住院周期、致残、影响日常生活或工作能力、危及生命安全以及引发先天畸形等事件。
1.3 观察指标
分析不良事件严重程度(包括轻度、中度以及重度)分布情况,不良事件发生和试验药物的关系(分为肯定有关、可能有关、可能无关以及无关),受试者转归情况(囊括痊愈/已缓解、仍存在/未缓解、不明/未知。
1.4 统计学方法
采用Excel 软件对数据进行清洗整理,删除数据缺失与不明确的病例记录,利用SPSS 23.0 软件对发生不良反应事件患者的严重程度、和试验药物的关系及转归情况进行描述分析。
2.结果
2.1 药物临床试验中不良事件严重程度分布情况
637 例药物临床试验不良事件中,严重程度为轻度、中度以及重度患者例数分别为516 例、115 例、6 例,占比分别为81.00%、18.06%、0.94%,见表1。
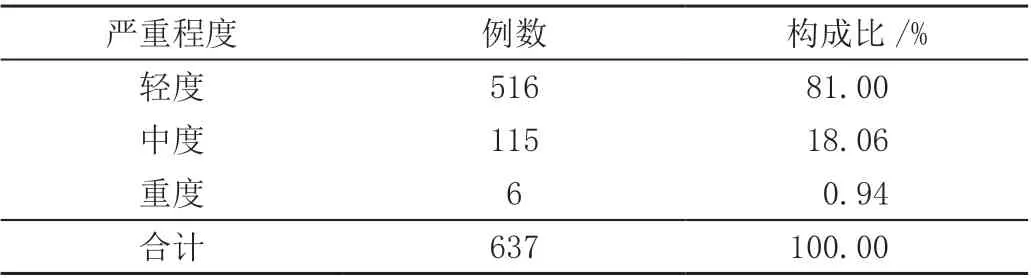
表1 641 例药物临床试验不良事件严重程度分布情况
2.2 不良事件与试验药物的关系分析
637 例药物临床试验不良事件,其发生与试验药物的关系中,肯定有关、可能有关、可能无关以及无关例数分别为53 例、308 例、103 例以及173 例,占比分别为8.32%、48.35%、16.17%、27.16%,见表2。
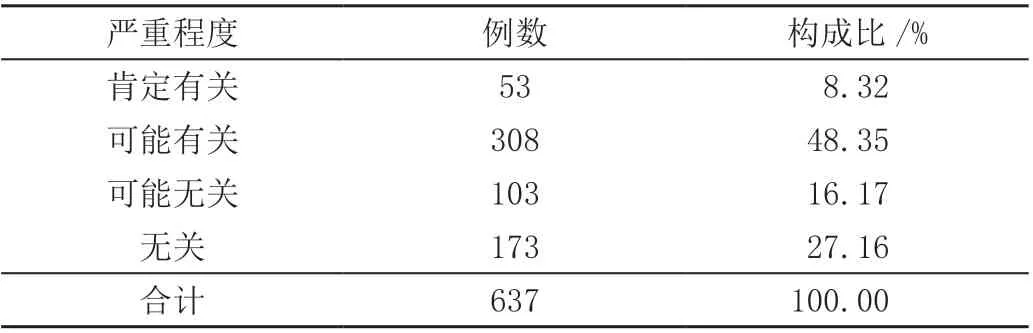
表2 不良事件与试验药物的关系分析
2.3 药物临床试验中不良事件转归情况分析
637 例药物临床试验发生不良事件,受试者转归情况为,痊愈/已缓解526 例、仍存在/未缓解88 例、不明/未知23 例,占比分别为82.57%、13.82%、3.61%,见表3。
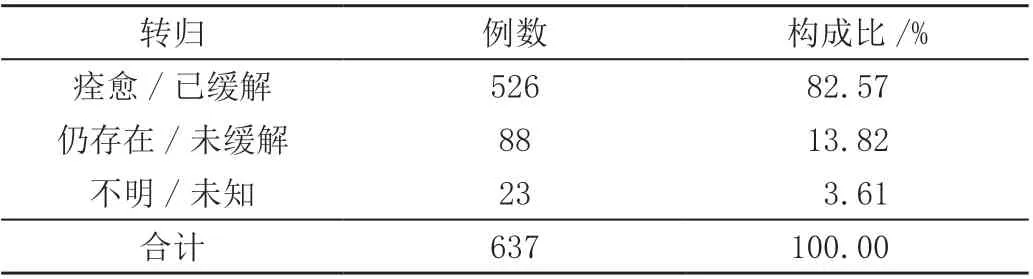
表3 药物临床试验中不良事件转归情况分析
3.讨论
药物临床试验的目的在于证实药物作用效果、不良反应,明确其疗效和安全性[8-10],是新药研发不可或缺的重要环节,试验药物能否获批上市并应用于临床实际,需要结合药物的有效性及安全性结果,通过科学的方法对其获益和风险比来确定。目前,药物临床试验包括Ⅰ~Ⅳ四期,其中Ⅰ期为初步明确药物在人体内的吸收、分布、代谢以及排泄;Ⅱ期为评估药物作用初评阶段,探索药物治疗效果以及安全性;Ⅲ期即药物治疗效果确证阶段,以评估药物效益和风险;Ⅳ期即上市后监测,也是申请人开展的应用研究阶段[11-12]。正常而言,新药在批准上市之前,务必完成Ⅰ~Ⅲ期临床试验。而在上述药物临床试验过程中,难以避免会发生一些不良事件,从而对受试者造成不同程度的损害,更会直接影响药物的上市,已得到国内外各级医疗机构的广泛关注[13]。
不良事件是药物临床试验的安全性评价指标之一,正确收集及评估不良事件对药物临床试验具有重要意义,少记和漏记不良事件、对不良事件与试验药物相关性的误判、不良事件处理不及时或未对不良事件进行跟踪随访等均会对试验药物的安全性评价造成影响,导致受试者权益及安全得不到有效保障。需要注意的是,研究前应当对参与临床药物试验的对象进行不良事件相关知识的培训,掌握不良事件的评价标准,并加强跟踪随访。
不良事件的收集中需要具备以下要素[14]:①与试验方案规定的基线相比较,受试者在接受试验药品后新出现的症状、体征、疾病或实验室检查异常等列为不良事件。原有的症状、体征、疾病或实验室检查异常加重的也作为不良事件。②不良事件应当在试验药品治疗后出现,严格意义上受试者在签署知情同意书后意味着临床药物试验的开始,在签署后若不慎发生骨折,广义上应当属于不良事件,但在收集过程中应当区分是在试验药品治疗后还是治疗前。③不良事件收集包括症状(恶心呕吐、头痛头晕)、体征(发热、皮疹、黄疸)、疾病或实验室检查异常等。其中,症状、体征及疾病相对而言容易收集,而实验室检查异常依赖于研究者的主观判断,通常选择具有临床意义的实验室指标。④需要考虑该不良事件是否是受试者疾病进展的表现或伴随疾病在试验期间的择期治疗,如果是则不应当作为不良事件收集。
本文结果显示,637 例药物临床试验不良事件严重程度为轻度、中度以及重度患者例数占比分别为81.00%、18.06%、0.94%。与既往研究结果基本一致[15-16]。提示精神卫生专业药物临床试验中所发生的不良事件以轻、中度为主,仅少数受试者会发生重度不良事件。分析原因可能和精神卫生专业药物的特点有关,大多精神卫生专业药物是选择性作用于体内特异的受体。不良事件的及时发现与受试者的主动倾诉、医务工作者对受试者的及时问诊、体格检查以及相关实验室指标检查密切相关。因此,扎实的医学专业水平以及良好医学素养极为重要,可及时发现药物相关特殊或(和)早期不良反应,及时处理,继而避免了进一步进展或者加重,也为临床处置方案的制定和实施提供参考依据[17-19]。值得注意的是不良事件的确认务必由授权的有资质医师完成,以保证结果判定的准确性。
此外,本研究637 例药物临床试验不良事件的发生与试验药物的关系中,肯定有关、可能有关、可能无关以及无关患者例数占比分别为8.32%、48.35%、16.17%、27.16%。反映了深圳市康宁医院精神卫生专业药物临床试验,仅少部分不良事件确定和试验药物有关,部分不良事件确定和试验药物无关,另有大部分不良事件和试验药物的相关性不确定。分析原因,可能和法规或管理所需有关。我国国家药品监督管理局在2020 年所颁布的中国版本《药物临床试验质量管理规范》中将不良事件定义为受试者在接受相关试验药物之后所出现的所有不良医学事件,包括症状体征、疾病或实验室相关检查的异常,但不一定均和试验药物存在因果关系。与此同时,我院相关管理制度/SOP 亦规定了药物临床试验中不良事件包括试验期间所出现的所有可能对受试者症状体征、疾病或实验室指标产生影响的不良事件,而非单独指由药物所引发的对人体有害或非期望反应[20-22]。
本研究637 例药物临床试验不良事件的受试者转归情况中,痊愈/已缓解、仍存在/未缓解、不明/未知占比分别为82.57%、13.82%、3.61%。分析原因可能是因为受试者不良事件严重程度普遍较轻,且临床干预及时有效密不可分。总体而言,我院精神卫生专业药物临床试验具有一定的安全性。
综上所述,我院精神卫生专业药物临床试验,仅很少数受试者会发生重度不良事件,少部分不良事件与试验药物有关,且我院发生的大部分不良事件都能治愈或缓解。

