环状RNA hsa_circ_0018574在结直肠癌组织中的表达及其对结直肠癌细胞增殖的影响
马锐,田进海,马荣,万巧凤,刘河涛,王立斌
0 引言
结直肠肿瘤(colorectal cancer,CRC)是消化道常见的恶性肿瘤之一,其发病率和死亡率分别位列全球恶性肿瘤的第3位和第2位[1]。结直肠癌早期患者多无自觉症状,临床表现不典型,患者的生存期与诊断时疾病的分期密切相关。因此,筛选一种有效的结直肠癌的早期诊断标志物,对延长患者生存期具有重要的意义[2]。环状RNA(circRNAs)是一种新型的非编码RNA分子,它不存在3’端和5’端,直接由外显子、内含子或两者共存,反向剪切,形成一个共价闭合的连续环状结构。circRNA在外泌体和血浆中含量丰富且稳定,检测方便,且在真核生物转录组中具有组织特异性,能够对基因转录进行调控[3]。同时,有研究报道,circRNA可以与具有生物学功能的蛋白质结合进而影响细胞的生物学活性[4],并作为分子支架使得多种生物分子趋化,形成多元复合物,在细胞活动中发挥作用[5]。
多种多样的生物学功能使circRNA可以成为一种新的诊断生物标志物和基因治疗的靶点,研究显示circRNA在多种疾病中均发挥重要作用,如乳腺癌、大肠癌、神经胶质瘤等[6-8]。前期工作中,我们通过基因芯片分析了在结直肠癌和邻近正常组织中的特征性表达情况,共有13 198个环状RNA,其中6 697个基因上调,6 501个基因下调[9]。而本研究旨在探讨hsa_circ_0018574在结肠癌组织中的表达及其对肿瘤细胞周期、增殖和凋亡的影响,为circRNA在结直肠肿瘤发生、发展机制提供数据支持。
1 资料与方法
1.1 研究对象
收集2017年6月—2018年8月在宁夏医科大学总医院结直肠外科确诊为结直肠癌的50例患者术后癌组织和癌旁组织标本。纳入标准:(1)无肿瘤病史;(2)结直肠癌组织样本病理诊断明确;(3)无艾滋病毒感染;(4)行结直肠癌肿瘤切除术;(5)收集标本前均无放疗或化疗史;(6)临床信息完整。排除标准:(1)既往腹部手术者;(2)伴有远处转移与肠梗阻者。结直肠癌组织样本储存于液氮中。所有患者在取样前都签署知情同意书,本研究已获得宁夏医科大学总医院伦理委员会的批准。
1.2 RNA提取及反转录
患者组织样本总RNA的分离提取按TRIzol试剂(美国Invitrogen公司)说明书进行,Nano-Drop2000分光光度计(美国 Thermo Fisher Scientific公司)测定RNA的纯度和浓度,OD260/280比值为1.9~2.0。用1%甲醛变性凝胶电泳检测RNA完整性;将提取的总RNA通过反转录试剂盒(美国Thermo Fisher Scientific公司)合成cDNA,反转录体系为:1 μl总RNA(约500 ng),1 μl random primer,10 μl ddH2O,2 μl dNTP,4 μl反转录buffer,1 μl RNA 酶抑制剂,1 μl反转录酶,总体积20 μl;反应条件为:25℃ 5 min,42℃ 60 min,70℃5 min。RNA及cDNA置于-80℃贮存备用。
1.3 微阵列分析
1.4 RT-qPCR检测
采用TB Green qPCR MasterMix(TaKaRa,日本)于LightCycler®480实时PCR平台进行RTqPCR,GAPDH的表达为内参对照。引物由生工生物工程(上海)有限公司合成,hsa_circ_0018574(正向引物:5’-ACAGAAATACAGG CCGAGGAGT-3’;反向引物:5’-TGTCCGTGCCTGTGCAATTA-3’)。RT-qPCR反应的总体积为20 μl系统,每孔加入上下游引物各0.8 μl(引物浓度为10 μmol/L),TB Green qPCR MasterMix 10 μl,cDNA 2 μl,6.4 μl双蒸馏水。RT-qPCR反应条件:95℃ 30 s,95℃ 15 s,60℃ 15 s,40个循环,60℃ 2 min,收集荧光信号。基因的相对表达量采用2-ΔΔCT法进行计算。
1.5 细胞培养与转染
人结肠癌HT-29细胞由中国科学院细胞库提供,RPMI1640培养基、FBS和青/链霉素均购自美国Gibco公司,TRIzol试剂和转染试剂Lipofectamine TM2000均购自美国Invitrogen公司,将HT-29细胞接种至6孔板,待细胞贴壁12 h后,用脂质体2000将si-circ_0018574质粒转染至细胞中,使用RT-qPCR检测HT-29细胞中circ_0018574表达水平。
1.6 平板克隆形成分析
取HT29细胞,按600个/孔分别接种于12 孔板中,放入37℃、5%CO2细胞培养箱中,3~5 d换液,培养10~15 d后弃去培养液,PBS清洗后结晶紫染色,流水冲洗后晾干,拍照计数。
1.7 蛋白质印迹法检测
将转染后的HT-29细胞培养至对数期,按照每孔1×105个细胞接种于6孔板内。分为未转染细胞的空白对照组(control)、空载体阴性对照组(si-NC)和hsa_circ_0018574沉默组(sicirc_0018574)。在细胞培养孔内加入100 μl细胞裂解液,在冰上反应裂解30 min,使用细胞刮板收集裂解细胞。在12 000 r/min,4℃条件下离心10 min,上清液即为蛋白样本。BCA蛋白定量试剂盒检测蛋白浓度,super block调整蛋白浓度,取20 μg蛋白进行SDS-PAGE(120 g/L电泳凝胶),80 V反应40 min,120 V反应2.5 h。完成电泳后,湿转仪将凝胶上蛋白转印至PVDF膜(200 mA 1.5 h),super block封闭1 h。封闭后的PVDF膜分别加1:1 000稀释的抗体:兔抗CDK2抗体、兔抗CDK4抗体、兔抗CDK6抗体、兔抗cyclinD1抗体和兔抗cyclinE抗体(美国Abcam公司)。20 r/min平板摇床4℃孵育过夜;TBST清洗3次,每次10 min,加入HRP标记的山羊抗兔IgG(1:10 000),平板摇床室温孵育1 h;TBST清洗后,ECL发光检测,使用蛋白成像系统曝光,观察条带,以β-actin蛋白为内参蛋白观察相对表达。
1.8 流式细胞术检测
采用MUSE™ Caspase-3/7试剂盒(密理博)检测细胞凋亡,收集1×106个细胞,取50 μl细胞悬液加入5 μl caspase-3/7工作液37℃培养30 min,然后加入150 μl 7-AAD工作液(武汉,普诺赛生命科技有限公司)充分混匀后上机检测。
1.9 生物信息学和数据分析
采用Cluster3.0软件进行聚类分析生成聚类图,火山图采用ggPlot2软件(R)进行分析。circRNA引物由circPrimer1.2软件设计。所有数据采用SPSS23.0软件进行统计学分析,数据以均数±标准差()表示,每个circRNA的实验组与对照组之间差异倍数筛选,差异表达基因采用单因素方差分析或ANOVA。ROC曲线采用SPSS23.0软件绘制,当AUC=0.5时,circRNA被定义为无诊断价值。检验水准为α=0.05。
2 结果
2.1 hsa_circ_0018574的序列结构示意图和siRNA设计原则
circbaseID: hsa_circ_0018574,来源基因DDX21,染色体位置:chr10:70723046-70741337+,全长1 475 bp,该circRNA跨DDX21基因的4-14号外显子环化而成。引物设计必须要跨环化位点,hsa_circ_0018574(Forward:5’-ACAGAAATACAGG CCGAGGAGT-3’;Reverse: 5’-TGTCCGTGCCTGTGCAATTA-3’)引物特异性高,跨越环化接头,见图1。

图1 hsa_circ_0018574的序列结构示意图Figure 1 Sequence structure diagram of hsa_circ_0018574
环状RNA的siRNA设计原则:使siRNA序列跨过环状RNA的反向连接位点,首先让反向连接位点置于siRNA序列中间,降低siRNA的脱靶效应,然后将设计好的正义链和反义链通过化学方法合成,同时在siRNA的3’端添加两个TT脱氧核糖核苷酸,呈单链悬挂结构,增强siRNA序列的在体内和体外的稳定性,防止siRNA序列发生降解。本身siRNA是跨circRNA反向链接位点设计的,siRNA转染细胞后又做了定量分析确定hsa_circ_0018574表达量降低了,这就证明我们设计的siRNA就是针对hsa_circ_0018574,排除作用于其他mRNA。
在堤坝的使用过程中,经常会遇到渗水、开裂及滑坡等的情况,在这些堤坝病害中,渗水是最常见的堤坝病害,但是因为形成堤坝渗水的原因不一,因此,堤坝的渗水类型也有所不同。经过实地考察,发现堤身渗水是堤坝渗水类型之一。出现堤身渗水的情况主要是因为在堤坝施工的过程中,堤身填充或压实不均匀,长期受水的冲刷作用,密度与湿度欠缺的堤身部分就会出现渗水的情况[1]。
2.2 hsa_circ_0018574的筛选及验证
本研究共收集了4例结直肠癌患者的肿瘤组织(C1-C4)和相邻癌旁正常组织(N1-N4)进行测序分析,通过微阵列基因芯片对这4对结直肠癌患者肿瘤组织及癌旁正常组织进行表达谱芯片分析。获得差异表达的circRNA,其中高表达6 697个,低表达6 501个,见图2A。按照差异倍数(FC值)≥5和P<0.01,筛选5个表达上调,5个表达下调的circRNA,筛选确定hsa_circ_0018574,见图2B。通过RT-qPCR在50对结直肠癌及癌旁组织中验证发现,hsa_circ_0018574在结直肠癌组织中显著上调(P<0.01),见图2C。
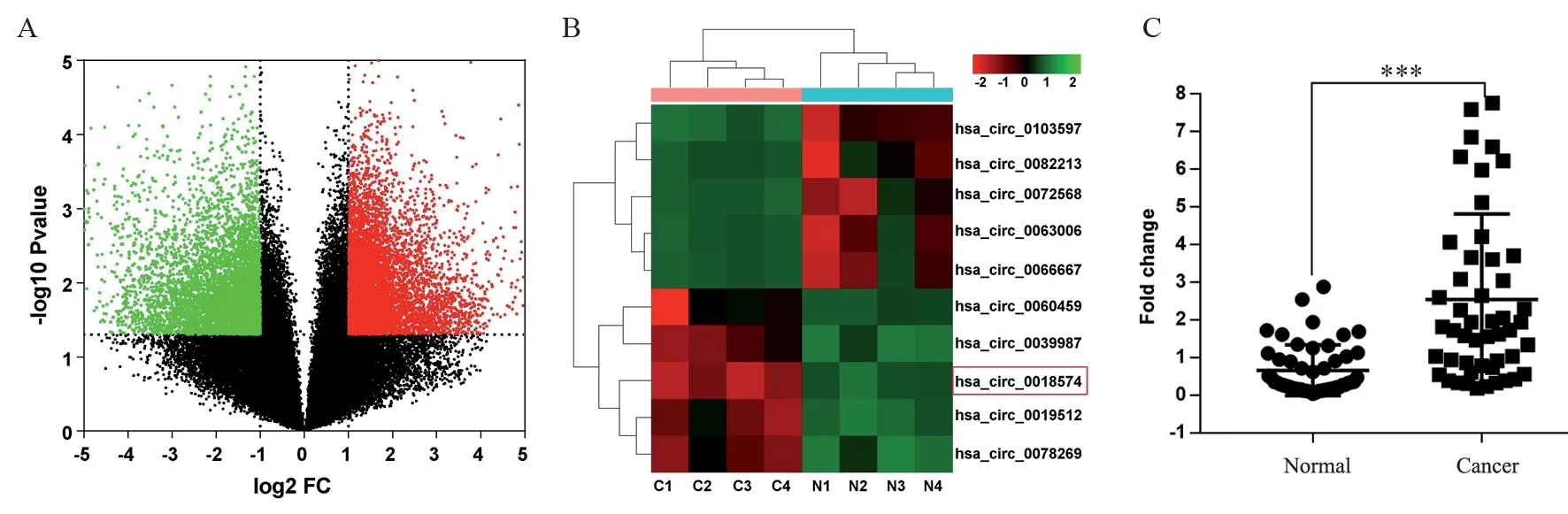
图2 微阵列分析hsa_circ_0018574在结肠癌组织中的表达Figure 2 Microarray assay of hsa_circ_0018574 expression in CRC tissues
2.3 人结肠癌细胞中hsa_circ_0018574沉默效果的检测
转染si-circ_0018574 48 h后,与Control组、si-NC组相比,实验组(si-circ_0018574组)在转染si-circ_0018574后,HT29细胞内circRNA_0018574的表达水平明显降低(P<0.01),见图3。
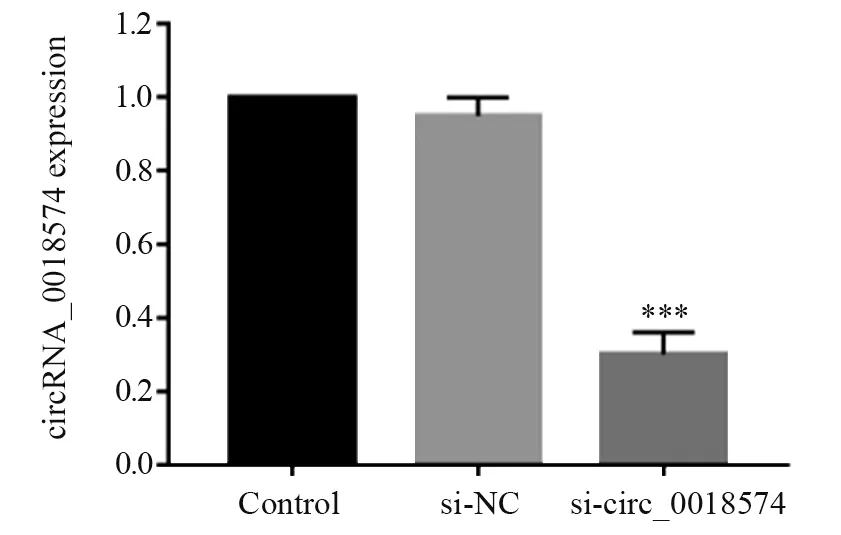
图3 转染s i-circ_0018574后结肠肿瘤细胞中circRNA_0018574的表达Figure 3 The expression level of circRNA_0018574 after si-circ_0018574 transfection
2.4 沉默circRNA-0018574表达抑制人结肠癌HT29细胞的增殖
结果显示,与s i-N C 组相比,沉默c i rcRNA_0018574结肠癌细胞增殖和集落形成能力明显降低,差异有统计学意义(P<0.01),见图4。

图4 平板克隆实验观察si-circ_0018574转染后HT29细胞集落形成能力Figure 4 Colony formation assay to observe the colony forming ability of HT29 cells after transfection of si-circ_0018574
2.5 沉默circRNA-0018574表达对人结肠癌HT29细胞周期蛋白的影响
Western blot结果显示,si-circ_0018574组的CDK2、CDK4、CDK6以及cyclinD1、cyclinE周期蛋白较si-NC组显著下调(均P<0.01),见图5。

图5 Western blot法检测si-circ_0018574对HT29细胞周期相关蛋白表达的影响Figure 5 The expression of HT29 cells cycle-associated proteins after transfection of si-circ_0018574 was detected by Western blot analysis
2.6 沉默circRNA_0018574表达促进人结肠癌HT29细胞的凋亡
流式细胞术细胞凋亡实验表示,CASPASE-3/7是促进细胞凋亡的因子,而与阴性对照组si-NC相比,转染si-circ_0018574后的人结肠癌HT29细胞凋亡加速,差异有统计学意义(P<0.01),见图6。

图6 流式细胞术观察转染si-circ_0018574后HT29细胞凋亡情况Figure 6 Flow cytometry assay to observe the apoptosis of HT29 cells after transfection of si-circ_0018574
3 讨论
结肠癌是全球范围内常见恶性肿瘤之一,具有发病率高及早期症状隐匿等特点。肿瘤的发生、发展涉及多基因介导和多酶促反应参与的复杂生物学调控机制。既往研究显示,癌基因的激活或抑癌基因表达的降低、失活均可增强肿瘤恶性进展,如促进癌细胞增殖及转移等[10]。结肠癌诊疗技术(手术切除联合放、化疗)虽在不断进步和完善,但患者预后仍较差。因此,探寻结肠癌新型生物治疗靶标,尤其对于早期筛查结直肠癌患者是当前临床研究攻克的重点。
circRNA为单链共价环状结构,这种封闭环形结构使其具有独特的稳定性、进化保守性、多样性以及在不同组织、生长阶段中的特异性。有研究发现,许多circRNA参与结直肠癌的发生、发展、侵袭与转移[11]。例如,circDDX17在结直肠癌组织中明显下调,并与不良的临床病理参数有关[12]。miR-876-5p可以识别circRNA CDR1as,其作为miR-876-5p的“海绵”,反向负调控CDR1as在肝癌中的表达和功能,抑制肝癌细胞的增殖、迁移和侵袭[13]。随着生命科学技术的不断进步,circRNA越来越多的功能被不断挖掘出来。目前,已发现circRNA的表达谱与结直肠癌患者的临床病理学特征有关,如组织分化、TNM分类和远处转移等[14];circRNA的差异表达也通过肿瘤相关信号通路调节结直肠癌细胞的增殖和进展[15];由于circRNA不易被核酸酶降解,具有保守性高、细胞内稳定性高的特点,为其作为诊断癌症的理想生物标志物奠定了基础[16]。
本研究采用circRNA表达谱芯片技术检测在结直肠肿瘤组织和癌旁组织标本中差异表达的circRNA,该芯片包含13 198条环状RNA探针,经过微阵列基因芯片筛选,确定hsa_circ_0018574为研究目标。对结直肠肿瘤组织及癌旁正常组织进行表达谱芯片分析和RT-qPCR结果显示,hsa_circ_0018574在人结直肠肿瘤组织中的表达明显高于癌旁组织。
在确定circ_0018574在结直肠癌中的保守性和稳定性,并对其在结直肠癌中的功能进行预测后,本研究进一步通过circ_0018574沉默技术研究其对人结直肠癌HT29细胞增殖、周期及凋亡的影响。平板克隆法实验结果表明,将si-circ_0018574和空载体转染至HT29细胞中,si-circ_0018574能够明显抑制人结肠癌HT29细胞的增殖能力和克隆形成能力。细胞周期停滞与许多细胞周期调节蛋白和细胞周期相关激酶的表达有关。之前有研究表明,细胞依赖性激酶(cyclin dependent kinases,CDKs)CDK2、CDK4和CDK6是细胞由G1期转入S期的重要调节因子,而且cyclinD和cyclinE通过结合CDK4和CDK6,进而调节其活性,调控细胞周期进展[17-18]。本实验结果显示,转染sicirc_0018574后,人结肠癌HT29细胞中CDK2、CDK4、CDK6以及cyclinD1和cyclinE周期蛋白表达明显降低。提示干扰circRNA_0018574可延长细胞周期的S期,阻滞于G1/S期,抑制纺锤体形成,以减少细胞分裂,进而抑制结直肠癌细胞的增殖作用。Caspase在凋亡信号的作用下首先激活启动型Caspase引发Caspase级联反应,然后通过活化的Caspase裂解底物导致细胞凋亡[19-20]。MUSE DEVD caspase-3/7试剂含一种DNA结合染料,该染料与DEVD肽底物相连,当它与DEVD结合时,染料不能结合DNA。活性Caspase-3/7在细胞内的裂解导致染料释放,移位到细胞核,染料与DNA结合,并表现出高荧光。当观察到Caspase-3/7参数的荧光增加时,很容易获得细胞中存在活性Caspase-3/7的信息。在流式细胞术细胞凋亡实验中,转染si-circ_0018574后可以促进人结肠癌HT29细胞凋亡,通过抑制其表达可延缓肿瘤的发展。
综上所述,has-circ_0018574在结直肠肿瘤患者组织和细胞中高表达,si-circ_0018574能够显著抑制人结肠癌HT29细胞增殖和克隆形成能力,将HT29细胞阻滞于G1/S期,减少细胞分裂,促进细胞凋亡。这些结果为结直肠肿瘤的早期诊断、治疗及预后评估提供新的证据,但has_circ_0018574在结直肠肿瘤中的靶基因及调节机制尚不清楚,仍需要进一步深入研究。
致谢:感谢宁夏医科大学总医院结直肠外科为本实验提供临床样本。

