白藜芦醇对白内障小鼠晶状体透明度的作用
李 振,刘丹丹,付开岩,李晓华
鞍钢集团公司总医院眼科,鞍山 114002
白内障临床表现为晶状体浑浊,从而影响光线从晶状体到达视网膜,导致视力下降及损伤[1]。白内障的发生与紫外线照射密切相关,部分紫外线可穿过角膜和房水被晶状体所吸收,受到紫外线照射的细胞可启动一系列细胞内信号转导通路,导致细胞凋亡[2]。白藜芦醇是一种多酚类化合物,具有抗炎、抗肿瘤和抗氧化等多种药理活性。白藜芦醇具有抗细胞凋亡作用,在椎间盘退变及糖尿病心肌病中可通过抑制细胞凋亡发挥治疗作用[3-4]。白藜芦醇可抑制动物糖尿病性白内障进展过程[5]。本研究通过紫外线照射建立白内障小鼠模型,探讨白藜芦醇对白内障小鼠晶体透明度的改善作用及其作用机制。
1 仪器与材料
1.1 仪器
流式细胞仪购自美国BD公司,Mini-Protean4电泳仪购自美国Bio Rad公司。
1.2 试药
复方托吡卡胺滴眼液(美多丽)购自日本参天制药株式会社;白藜芦醇(质量分数≥99%,批号R5010)购自美国Sigma公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)和丙二醛(malondialdehyde,MDA)检测试剂盒均购自南京建成生物研究所;miR-125b-inhibitor由广州锐博生物科技有限公司合成;兔抗大鼠p53、B细胞淋巴瘤/白血病-2基因(B-cell lymphoma/leukemia-2gene,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 assaciated X protein,Bax)一抗和HRP标记的二抗均购自美国Abcam公司。
1.3 实验动物
SPF级雄性C57BL/6小鼠90只,6周龄,体质量20~22 g,购自上海斯莱克实验动物有限责任公司,许可证号为SCXK(沪)2017-0005。购入后适应性饲养7 d。实验前经裂隙灯检查,排除眼球疾病。
2 方法
2.1 建模
随机选取65只小鼠,参照文献用紫外线照射法[6]建立白内障模型,将复方托吡卡胺滴眼液滴入双侧眼球进行扩瞳,5 min后腹腔注射10 mg·L-1戊巴比妥钠(40 mg·kg-1)麻醉小鼠,用紫外线(360 μW·cm-2)照射右眼,照射时间为5 min,1日1次,连续7 d,左眼不照射。
2.2 晶状体miR-125b表达
末次紫外线照射后2 h,随机选取5只建模小鼠,另取5只未建模小鼠,处死后取晶状体前囊膜,Trizol法提取总RNA,逆转录合成cDNA,进行RT-qPCR扩增。反应体系:SYBR Premix Ex Taq TM 10 μL,模板cDNA2 μL,上下游引物各1 μL,加ddH2O至总体积20 μL。反应条件:95 ℃预变性1 min,95 ℃变性5 s,55 ℃退火5 s,60 ℃延伸10 s,共40个循环。以U6为内参,根据2-△△CT法进行相对定量。引物由上海生工生物工程有限公司合成,引物序列:miR-125b上游5′-ACAGATGGTCCGGCTAGCTC-3′,下游5′-GTCCGACAAGTCGGCATGCT-3′;U6上游5′-GCAAGGGCGCGATC-TAGCTC-3′,下游5′-GCCGATAGCAGAATCCCGCT-3′。
2.3 分组及干预
剩余60只建模小鼠随机分为模型组、白藜芦醇组和白藜芦醇+inhibitor组,每组各20只,另设20只对照组。白藜芦醇组灌胃给予100 mg·kg-1白藜芦醇且玻璃体内注射PBS 3 μL;白藜芦醇+inhibitor组灌胃给予100 mg·kg-1白藜芦醇,1日1次,连续14 d,第8 d灌胃完毕后2 h,玻璃体内注射miR-125b-inhibitor 3 μL,仅注射1次;模型组和对照组灌胃等体积生理盐水且玻璃体内注射等体积PBS,干预频次同上。玻璃体内注射方法:小鼠麻醉后,碘伏消毒眼表,显微镜下,使用微量注射器于巩膜侧后垂直进针,随后向眼球壁倾斜避开晶状体,到达视网膜中央,进行注射,注射完毕后复位眼球,滴典必殊滴眼液。
2.4 裂隙灯观察晶状体浑浊度
用复方托吡卡胺滴眼液散瞳,裂隙灯观测各组小鼠右眼晶状体浑浊度。依据文献标准[7]对晶状体进行分级评分:0级为透明无浑浊,记为0分;Ⅰ级为轻度浑浊,周边有少量空泡,记为1分;Ⅱ级为中度浑浊,空泡向中心聚集,记为2分;Ⅲ级为高度浑浊,空泡聚集至中心部位,呈现雾状混浊;Ⅳ级为完全浑浊,记为4分。
2.5 检测晶状体SOD、GSH和MDA水平
评分完毕后,各组随机选取5只小鼠,处死后摘取眼球,取右眼晶状体放入离心管中,按1∶9加入生理盐水,制备100 mg·L-1组织匀浆,离心取上清,按照试剂盒说明书加入试剂和样品,充分混匀,反应结束后用酶标仪测定吸光度值,计算SOD、GSH和MDA活力。
2.6 晶状体上皮细胞(lens epithelial cells,LEC)凋亡情况
各组随机选取5只小鼠,处死,取右眼晶状体前囊膜,剪碎,磷酸盐缓冲液悬浮,300目网筛过滤,制备上皮细胞单细胞悬液,以1 000 r·min-1离心3 min,PBS洗涤,调整细胞密度为1×106个·mL-1,加入Annexin V-FITC和PI工作液,室温避光染色5 min,用流式细胞仪检测细胞凋亡情况,记录各组细胞凋亡率。
2.7 小鼠晶状体病理学变化
各组随机选取5只小鼠,处死,取右眼晶状体前囊膜,于40 mg·L-1多聚甲醛中固定后,石蜡包埋,制备4 μm切片,脱蜡、复水,苏木素染色5 min,蒸馏水洗涤,10 mg·L-1盐酸乙醇分化,伊红染色5 min,蒸馏水洗涤,中性树胶封片,光学显微镜下观察晶状体病理学变化。
2.8 晶状体凋亡相关mRNA表达
处死各组剩余小鼠,取右眼晶状体前囊膜,Trizol法提取总RNA,进行RT-qPCR扩增。引物序列:p53上游5′-TGACTAGCATCAGGCATTAG-3′,下游5′-AGCTAGCGATGCATCGATGA-3′;Bcl-2上游5′-CGACTAGCTAATAGCTATCG-3′,下游5′-TGACGTTAGCTAGTAGCGAT-3′;Bax上游5′-ACTCGATCGATTAGACCTAGC-3′,下游5′-AGGTACGTACTCGTACATAGT-3′;β-actin上游5′-ATGCAGTAGCGATATCATCGCT-3′,下游5′-ATCCGACGCTACGACTAGCAGT-3′。
2.9 晶状体凋亡相关蛋白表达
取右眼晶状体前囊膜,PBS洗涤,加入裂解液制备组织匀浆,离心取上清,BCA法测定蛋白质量浓度,煮沸使蛋白变性,以12 000 r·min-1(离心半径12 cm)离心5 min,留取上清。蛋白上样进行SDS-PAGE电泳、转膜,封闭液封闭2 h。加入p53、Bcl-2、Bax和β-actin(1∶800)一抗,4 ℃孵育过夜,洗膜后加入HRP标记的二抗,室温孵育1 h。ECL发光、显影。Image J软件对蛋白条带灰度值进行分析,各目的蛋白相对表达水平以其与内参条带灰度比值表示。
2.10 统计学方法
3 结果
3.1 白内障小鼠晶状体miR-125b低表达
造模小鼠晶状体miR-125b相对表达量为(0.37±0.05),未造模小鼠晶状体miR-125b的相对表达量为(1.00±0.00),造模小鼠显著低于未造模小鼠(t=28.174,P<0.05)。
3.2 小鼠晶状体浑浊度评分
对照组小鼠晶状体均透明,无浑浊现象。与模型组比较,白藜芦醇组晶状体浑浊程度和评分降低(P<0.05);与白藜芦醇组比较,白藜芦醇+inhibitor组晶状体浑浊程度和评分升高(P<0.05)。见表1。
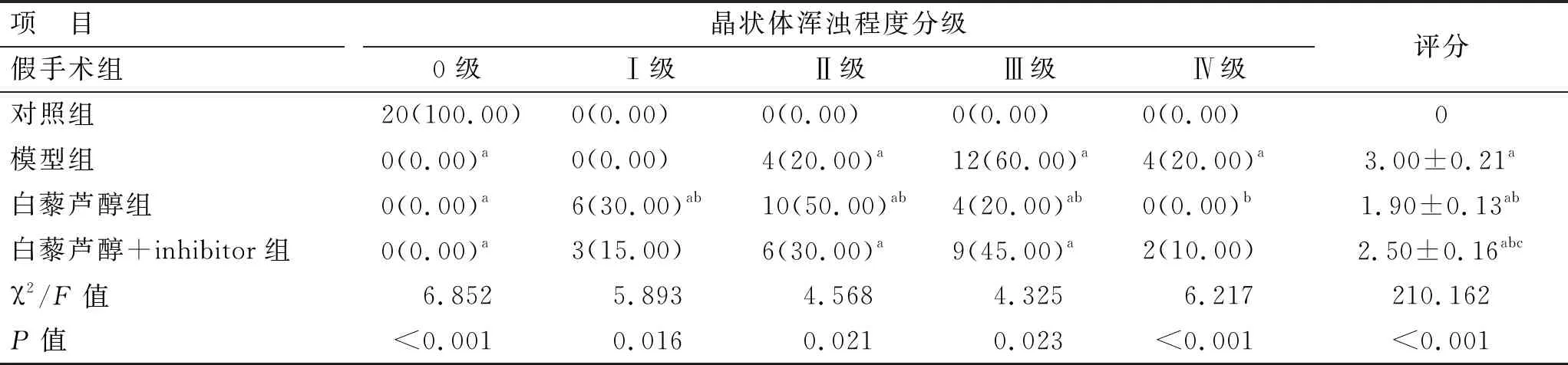
表1 各组小鼠晶状体浑浊度及评分比较 [n=20,n(%)]
3.3 小鼠晶状体SOD、GSH和MDA水平
与对照组比较,模型组小鼠晶状体SOD、GSH水平降低,MDA水平升高(P<0.05);与模型组比较,白藜芦醇组小鼠晶状体SOD、GSH水平升高,MDA水平降低(P<0.05);与白藜芦醇组比较,白藜芦醇+inhibitor组晶状体SOD、GSH水平降低,MDA水平升高(P<0.05)。见表2。
表2 各组小鼠晶状体SOD、GSH、MDA水平比较
3.4 小鼠LEC凋亡率
与对照组比较,模型组LEC凋亡率升高(P<0.05);与模型组比较,白藜芦醇组LEC凋亡率降低(P<0.05);与白藜芦醇组比较,白藜芦醇+inhibitor组LEC凋亡率升高(P<0.05)。见表3。
3.5 HE染色观察小鼠晶状体病理变化
HE染色结果显示,对照组LEC形态规则、排列整齐;模型组LEC大小不一、排列紊乱、核固缩,晶状体纤维出现断裂;白藜芦醇组LEC排列基本整齐,细胞损伤较轻,晶状体纤维偶见断裂;白藜芦醇+inhibitor组较模型组有所改善,但仍较白藜芦醇组损伤严重,LEC紊乱,可见断裂的晶状体纤维。见图1。

表3 各组小鼠LEC凋亡率比较

注:A.对照组;B.模型组;C.白藜芦醇组;D.白藜芦醇+inhibitor组。
3.6 小鼠晶状体凋亡相关mRNA表达水平
与对照组比较,模型组p53、Bax mRNA相对表达量升高,Bcl-2蛋白相对表达量降低(P<0.05);与模型组比较,白藜芦醇组p53、Bax mRNA相对表达量降低,Bcl-2 mRNA相对表达量升高(P<0.05);与白藜芦醇组比较,白藜芦醇+inhibitor组p53、Bax mRNA相对表达量升高,Bcl-2 mRNA相对表达量降低(P<0.05)。见表4。

表4 各组小鼠晶状体mRNA表达水平比较
3.7 小鼠晶状体凋亡相关蛋白表达水平
与对照组比较,模型组p53、Bax蛋白相对表达量升高,Bcl-2蛋白相对表达量降低(P<0.05);与模型组比较,白藜芦醇组p53、Bax蛋白相对表达量降低,Bcl-2蛋白相对表达量升高(P<0.05);与白藜芦醇组比较,白藜芦醇+inhibitor组p53、Bax蛋白相对表达量升高,Bcl-2蛋白相对表达量降低(P<0.05)。见表5、图2。
表5 各组小鼠晶状体蛋白表达水平比较
4 讨论
本研究用紫外线照射建立白内障小鼠模型,结果显示模型组小鼠晶状体浑浊度明显升高,表明紫外线诱导白内障模型成功。MDA是脂质过氧化物反应的最终产物,其水平高低反映了组织细胞受自由基损伤的严重程度[8];SOD是体内一种抗氧化剂,对维持机体氧化与抗氧化平衡具有重要作用[9];GSH是抗氧化系统重要组成部分,可清除活性氧保护组织细胞[10]。白藜芦醇是一种天然抗氧化剂,安全有效,副作用少,体外实验显示,白藜芦醇可减少胰岛中自由基的产生,减少细胞凋亡,提高胰岛存活能力和功能性[11]。
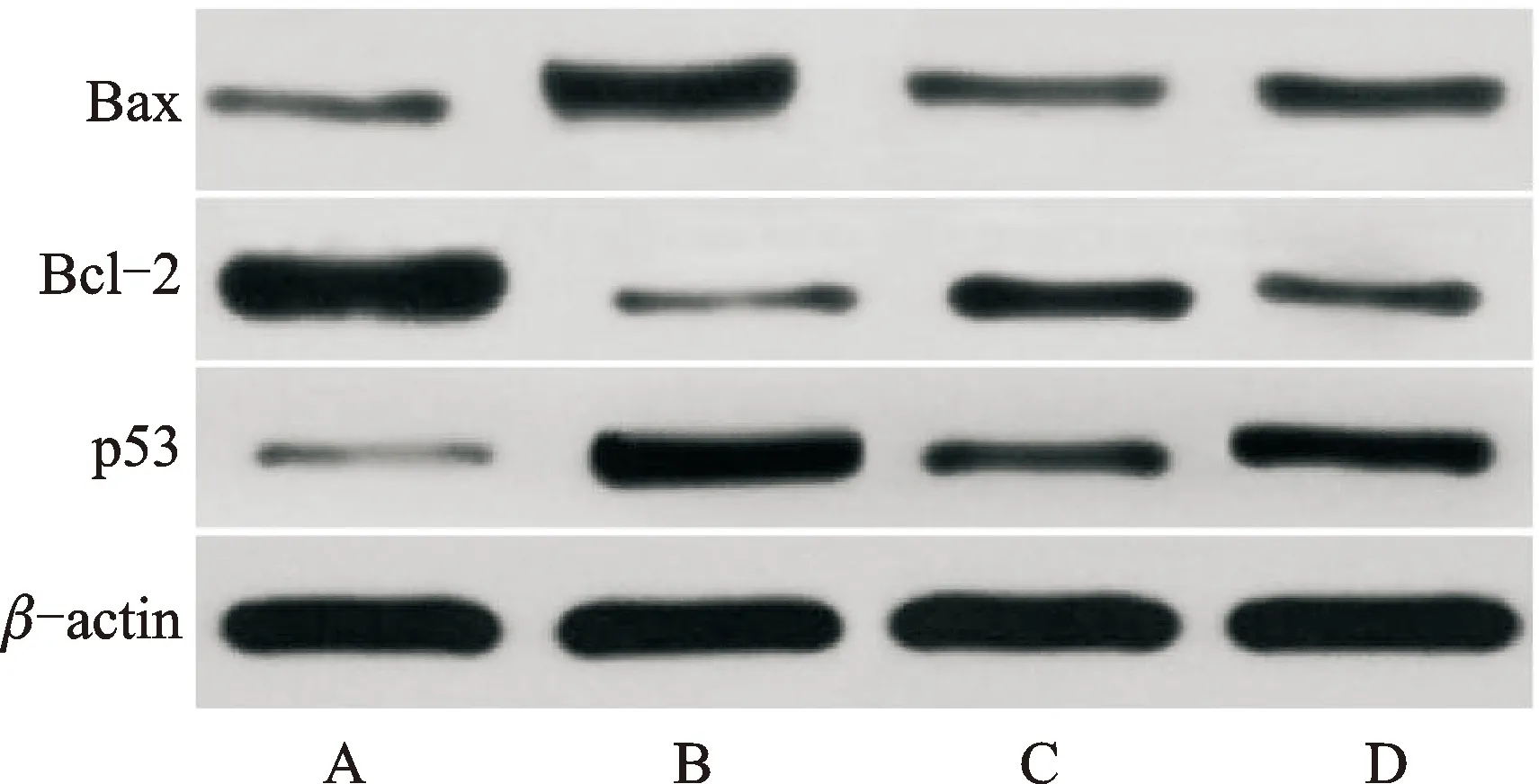
注:A.对照组;B.模型组;C.白藜芦醇组;D.白藜芦醇+inhibitor组。
动物实验研究表明,白藜芦醇在肾脏缺血再灌注大鼠模型中通过抑制相关通路发挥抗氧化作用,并可减少肾组织细胞凋亡[12-13]。紫外线通过氧化损伤LEC引起晶状体浑浊[14],白藜芦醇可通过减轻氧化损伤减少LEC凋亡,在细胞受到紫外线辐射时发挥抗辐射作用,从而保护晶状体[15]。目前白藜芦醇的抗氧化活性已经得到证实,本研究采用白藜芦醇治疗白内障小鼠,检测小鼠晶状体浑浊度,结果显示较模型组显著下降,同时晶状体SOD、GSH水平显著升高,MDA水平下降,LEC凋亡率下降,晶状体病理变化得到明显改善,提示白藜芦醇可减轻紫外线的氧化应激损伤,减少细胞凋亡,改善晶状体透明度。
研究显示,miRNA通过调控细胞增殖、分化、凋亡等病理生理过程,与白内障发生发展关系密切。已有研究显示,多个miRNA与白内障发病机制有关,为相应靶向治疗提供了依据[16-17]。因紫外线辐射氧化损伤导致LEC凋亡增加,被证实与miRNA有密切联系[18]。miR-125b是重要肿瘤调节因子,与细胞增殖、凋亡、迁移及侵袭过程密切相关,可作为多发性肿瘤诊断和预后指标。已有研究证实,miR-125b可改善缺血性心肌细胞凋亡,促进心脏修复[19]。Bcl-2和Bax同属于Bcl-2家族,Bcl-2为抑凋亡基因,Bax为促凋亡基因,二者在决定细胞生存和死亡方面发挥关键作用。p53可抑制Bcl-2表达及功能,提高Bax表达,促进细胞凋亡。王建民等[20]报道,miR-125b在年龄相关性白内障患者晶状体前囊膜中表达水平明显低于正常人,过表达miR-125b可抑制LEC凋亡。本研究结果显示,造模小鼠晶状体miR-125b表达显著低于未造模小鼠,提示miR-125b在白内障小鼠中表达水平存在异常,并在给予miR-125b-inhibitor后,小鼠晶状体抗氧化能力下降,LEC凋亡增加,p53、Bax mRNA和蛋白表达升高,Bcl-2 mRNA和蛋白表达降低,表明miR-125b可能参与白内障发展过程,与LEC凋亡有关。为进一步探讨白藜芦醇的可能作用机制,本研究在用白藜芦醇治疗白内障小鼠基础上,同时给予miR-125b-inhibitor,结果显示,白藜芦醇的改善作用显著降低,抑制miR-125b表达可抵消部分白藜芦醇对白内障小鼠的治疗作用,证实白藜芦醇降低白内障小鼠晶状体浑浊度、减少氧化应激对LEC的损伤,可能是通过促进miR-125b表达发挥保护作用的。
综上所述,白藜芦醇降低白内障小鼠晶状体浑浊度、减轻氧化应激、减少LEC凋亡,与促进miR-125b表达有关,可为临床治疗白内障提供理论依据。miR-125b通过何种机制发挥抗凋亡作用,有待进一步研究证实。

