白藜芦醇基于NF-κB p65通路对脑胶质瘤细胞的作用
晋 涛,陶胜忠,范鲁鼎,李卓伦
1.郑州颐和医院神经外科,郑州 450000;2.郑州大学第二附属医院神经外科,郑州 450000;3.河南中医药大学(河南省中医院)神经外科,郑州 450000;4.郑州大学第一附属医院神经外科,郑州 450000
脑胶质瘤(glioma)是发生于神经外胚层的原发性中枢神经系统恶性肿瘤,是颅内常见肿瘤,恶性程度高,浸润性强,复发率高。白藜芦醇是从多种植物中分离出的一种酚类化合物,具有抗癌、抗炎和抗氧化应激等功效[1-3]。白藜芦醇可增强脑胶质瘤细胞对替莫唑胺的敏感性,抑制肿瘤生长[4]。上皮间质转化(epithelial-mesenchymal transition,EMT)是上皮细胞在某些刺激因子作用下获得间质细胞表型的一种现象,广泛存在于胚胎发育、肿瘤转移及组织纤维化过程中。本研究以脑胶质瘤细胞U251为研究对象,探讨白藜芦醇是否通过核因子κB(nuclear factor kappa-B,NF-κB)信号通路介导EMT过程,促进脑胶质瘤细胞的增殖和浸润,为临床治疗脑胶质瘤提供新的治疗靶点。
1 仪器与材料
1.1 仪器
多功能酶标仪购自美国BioTek公司;培养箱购自美国Thermo公司;高速冷冻离心机购自湖南湘仪实验室仪器开发有限公司;双垂直电泳仪购自北京六一仪器厂。
1.2 试药
白藜芦醇(质量分数>98%)购自美国Sigma公司;脂多糖(lipopolysaccharide,LPS)购自美国Sigma公司;细胞培养基购自美国Gibco公司;白细胞介素6(interleukin 6,IL-6)和IL-1β、肿瘤坏死因子α(tumor necrosis factor,TNF-α) ELISA试剂盒均购自美国Abclonal公司;上皮钙黏蛋白(epithelial cadherin,E-cad)、神经钙黏蛋白(neural cadherin,N-cad)、波形蛋白(vimentin)、NF-κB p65和p-p65抗体均购自美国Cell Signaling Technology公司;Annexin V-FITC/PI凋亡检测试剂盒购自美国BD公司。
1.3 细胞系
人脑胶质瘤U251细胞株购自美国ATCC公司。
2 方法
2.1 细胞培养与分组
将脑胶质瘤细胞U251培养于含体积分数10%的胎牛血清、100 mg ·L-1链霉素和1×105u·L-1青霉素的DMEM培养基中,37 ℃、体积分数5%CO2、饱和湿度的培养箱中培养,每2 天更换1次培养基,细胞达到80%融合时,胰蛋白酶消化传代,培养至第3代的U251细胞用于实验。
对数生长期U251细胞随机分为对照组、白藜芦醇组、激动剂组和激动剂+白藜芦醇组。DMEM培养基将细胞重悬,以每孔1×105个·孔-1的密度将细胞接种于96孔板,细胞贴壁生长后,对照组细胞不做处理,白藜芦醇组细胞加入白藜芦醇50 μmol· L-1处理12 h,激动剂组细胞加入LPS 1 μg·mL-1刺激12 h,激动剂+白藜芦醇组细胞先用LPS刺激12 h后,再加入白藜芦醇50 μmol·L-1处理12 h,进行实验。
2.2 MTT法检测细胞存活率
细胞培养24 h后,避光条件下每孔加入5 mg·mL-1MTT溶液10 μL,置于培养箱中继续培养4 h,弃去原有培养基,每孔加入二甲基亚砜150 μL,37 ℃低速振荡10 min后,置于酶标仪上,设定波长为490 nm,测定吸光度(A值)。细胞存活率(%)=实验组A值/对照组A值×100%。
2.3 流式细胞仪检测细胞凋亡率
细胞培养24 h后,用DMEM培养基重悬细胞,以3 000 r·min-1离心10 min,离心半径8 cm,PBS清洗 2 次后,制成单细胞悬液,调整细胞密度为1×105个·mL-1,先加入 Annexin V-FITC 5 μL充分混匀后再加入碘化丙啶5 μL,振荡混匀,室温避光孵育15 min,流式细胞仪检测细胞凋亡情况。
2.4 ELISA法检测IL-6、IL-1β和TNF-α表达
收集各组细胞上清液,根据说明书进行对照品稀释,取出酶标板设定空白孔、标准孔和待测样品孔,标准孔中加入稀释后的对照品50 μL,待测样品孔先加入样品稀释液40 μL,再加入待测上清液10 μL,37 ℃水浴锅中孵育30 min,洗涤液洗涤5次,拍干板子,除空白孔外,其余每孔加入酶标抗体50 μL,37 ℃水浴锅中孵育30 min,洗涤液洗涤5次,拍干板子,再加入显色液,37 ℃显色10 min,每孔加入终止液50 μL终止反应,酶标仪波长调至450 nm处,测量吸光度(A)值。
2.5 Transwell实验检测侵袭细胞数
Transwell小室的上室中铺上30 μg基质胶,DMEM培养基将细胞重悬,调整细胞密度为105个·mL-1,在Transwell小室的上室中加入细胞悬液200 μL,在Transwell小室的下室中加入含体积分数10%胎牛血清的DMEM培养基500 μL,置于培养箱中培养24 h,弃掉培养基,用棉签擦掉小室上室中的细胞,PBS清洗2次,用多聚甲醛固定15 min,用质量浓度为1 g·L-1结晶紫染色30 min,显微镜下观察并拍照。
2.6 蛋白印迹法检测细胞中蛋白相对表达量
收集细胞,PBS清洗2次,加入RIPA裂解液冰上裂解30 min,在4 ℃ 以12 000 r·min-1离心10 min,离心半径为10 cm,收集上清。BSA法测定蛋白质量浓度,依据标准曲线计算蛋白质量浓度。加入RIPA和蛋白上样缓冲液调整细胞密度,100 ℃煮沸10 min使蛋白变性。进行凝胶电泳,每孔加入蛋白样品20 μL,80 V电泳30 min,120 V电泳2 h,结束电泳。0.3 A湿转2 h,TBST洗膜5 min,3次,室温封闭1 h,E-cad、N-cad、vimentin、NF-κB p65、p-p65和GAPDH蛋白一抗(1∶1 000)于4 ℃孵育过夜,TBST洗膜5 min,3次,二抗(1∶5 000)于低速摇床上室温孵育1 h,ECL发光液A液和B液1∶1配制,显色,Image J软件分析蛋白条带灰度值,目的蛋白条带灰度值/GAPDH蛋白条带灰度值为目的蛋白条带相对表达量。
2.7 统计学方法
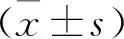
3 结果
3.1 细胞存活率检测结果
细胞存活率组间比较,差异有统计学意义(P<0.05)。与对照组比较,白藜芦醇组细胞存活率降低(P<0.05),激动剂组细胞存活率差异无统计学意义(P>0.05);与白藜芦醇组比较,激动剂+白藜芦醇组细胞存活率升高(P<0.05);与激动剂组比较,激动剂+白藜芦醇组细胞存活率降低(P<0.05)。见表1。

表1 细胞存活率比较
3.2 细胞凋亡率检测结果
细胞凋亡率组间比较,差异有统计学意义(P<0.05)。与对照组比较,白藜芦醇组细胞凋亡率升高,激动剂组细胞凋亡率降低(P<0.05);与白藜芦醇组比较,激动剂+白藜芦醇组细胞凋亡率降低(P<0.05);与激动剂组比较,激动剂+白藜芦醇组细胞凋亡率升高(P<0.05)。见表2、图1。

表2 细胞凋亡率比较
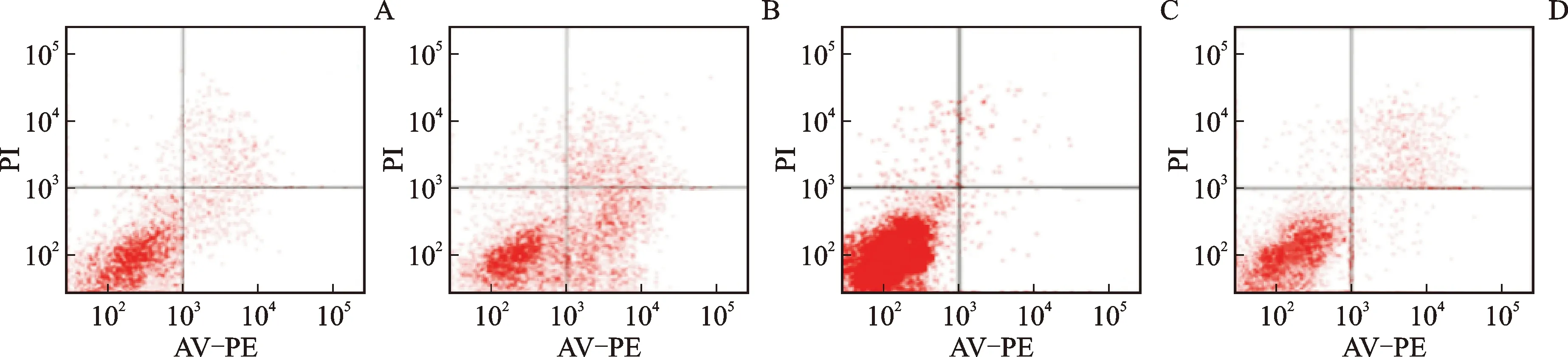
注:A.对照组;B.白藜芦醇组;C.激动剂组;D.激动剂+白藜芦醇组。
3.3 ELISA检测结果
IL-6、IL-1β和TNF-α含量组间比较,差异有统计学意义(P<0.05)。与对照组比较,白藜芦醇组IL-6、IL-1β和TNF-α含量降低,激动剂组IL-6、IL-1β和TNF-α含量升高(P<0.05);与白藜芦醇组比较,激动剂+白藜芦醇组IL-6、IL-1β和TNF-α含量升高(P<0.05);与激动剂组比较,激动剂+白藜芦醇组IL-6、IL-1β和TNF-α含量降低(P<0.05)。见表3。

表3 IL-6、IL-1β和TNF-α含量比较
3.4 Transwell实验检测结果
侵袭细胞数组间比较,差异有统计学意义(P<0.05)。与对照组比较,白藜芦醇组侵袭细胞数减少,激动剂组侵袭细胞数增多(P<0.05);与白藜芦醇组比较,激动剂+白藜芦醇组侵袭细胞数增多(P<0.05);与激动剂组比较,激动剂+白藜芦醇组侵袭细胞数减少(P<0.05)。见表4、图2。
3.5 蛋白印迹法检测结果
E-cad、N-cad、vimentin和p-p65蛋白相对表达量组间比较,差异有统计学意义(P<0.05)。与对照组比较,白藜芦醇组E-cad蛋白相对表达量升高,N-cad、vimentin和p-p65蛋白相对表达量降低,激动剂组E-cad蛋白相对表达量降低,N-cad、vimentin和p-p65蛋白相对表达量升高(P<0.05);与白藜芦醇组比较,激动剂+白藜芦醇组E-cad蛋白相对表达量降低,N-cad、vimentin和p-p65蛋白相对表达量升高(P<0.05);与激动剂组比较,激动剂+白藜芦醇组E-cad蛋白相对表达量升高,N-cad、vimentin和p-p65蛋白相对表达量降低(P<0.05)。见表5、图3。

表4 侵袭细胞数比较
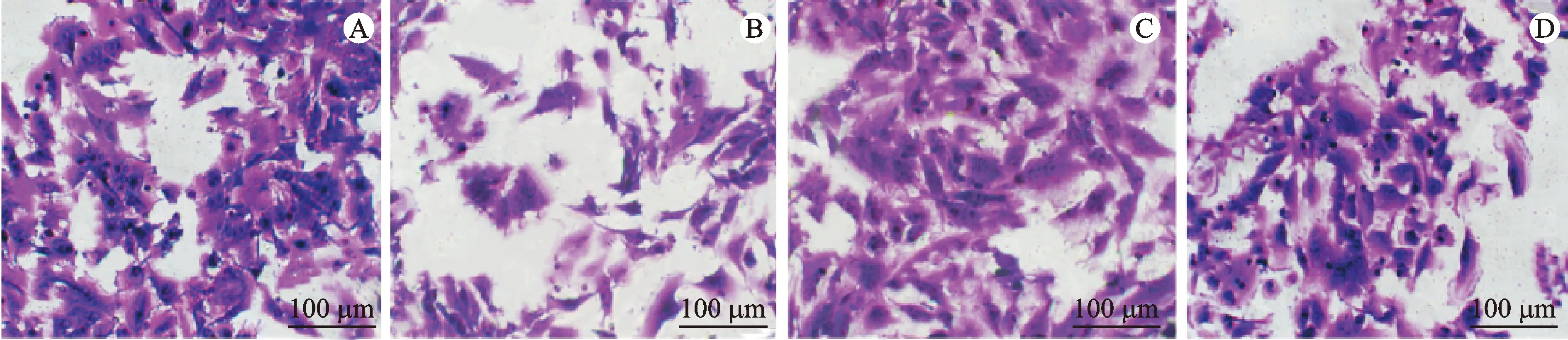
注: A.对照组;B.白藜芦醇组;C.激动剂组;D.激动剂+白藜芦醇组。
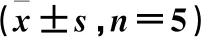
表5 E-cad、N-cad、vimentin和p-p65蛋白相对表达量比较

注:A.对照组;B.白藜芦醇组;C.激动剂组;D.激动剂+白藜芦醇组。
4 讨论
脑胶质细胞瘤常引起患者神经系统功能损伤,根据病理分级,可将脑胶质细胞瘤分为4级,Ⅰ级:癌细胞增殖能力低,手术治愈性高;Ⅱ级:癌细胞具有浸润性,有向高级别肿瘤进展的趋势;Ⅲ级:癌细胞具有恶性肿瘤特点,术后需进行辅助性放化疗;Ⅳ级:癌细胞具有恶性细胞学表象,生长快,进展快,复发率高,术后需要辅助性放化疗[5-6]。临床上常见的症状包括癫痫发作、颅内压升高、头痛、皮质脊髓束受累以及脑神经损伤等,但由于缺乏特异性常被误诊为急性脑血管疾病。目前,对于脑胶质细胞瘤的发病机制尚未明确。
中药由于其多靶点、毒副作用小、疗效佳等优点,在肿瘤的临床治疗上已受到广泛关注,例如三七皂苷可降低胃癌细胞增殖、侵袭和迁移能力,诱导癌细胞凋亡[7],淫羊藿苷抑制非小细胞肺癌A549细胞存活和转移[8]。白藜芦醇又称芪三酚,存在于葡萄、虎杖和大麦草等多种植物中,ZHANG W等[9]研究发现白藜芦醇通过激活Nrf2通路发挥抗炎作用,减轻糖尿病大鼠神经病变的严重程度。HU Y等研究报道白藜芦醇可抑制缺氧复氧诱导的心肌细胞凋亡[10]。白藜芦醇作为一种药理活性广泛的传统中药,其在抗肿瘤方面的作用已被报道,白藜芦醇可增强肝癌细胞A549对辐射损伤的敏感性,提高肝癌的治疗效果[11]。XU Q H等[12]研究发现,白藜芦醇可通过逆转EMT过程抑制缺氧诱导的胃癌细胞迁移和侵袭,既往研究表明,白藜芦醇具有良好的抗肿瘤效用,但是其在脑胶质细胞瘤中是否具有抑制肿瘤细胞增殖、促进肿瘤细胞凋亡的作用仍待研究,因此本实验以脑胶质瘤细胞U251为研究对象,探讨白藜芦醇在脑胶质细胞瘤中的作用。实验结果显示,白藜芦醇可抑制U251细胞增殖和侵袭、促进其凋亡,同时可降低炎症因子释放。
EMT是一个复杂的生理过程,涉及多种基因,与肿瘤细胞的迁移和浸润密切相关。EMT发生过程中,原发灶癌上皮细胞失去上皮表型获得间质表型,细胞骨架重构、细胞形态及生物学行为发生改变、细胞之间或细胞基质间黏附性减弱,转变为具有迁移和侵袭能力的间质细胞,通过血液和淋巴循环转移到远处组织形成新的病灶。E-cad主要表达于上皮细胞,N-cad是间质细胞标志物,细胞骨架成分蛋白vimentin增高诱导EMT的发生,因此E-cad的减少和N-cad、vimentin的增加标志着EMT的发生[13]。NF-κB信号通路在细胞增殖、分化和凋亡过程中具有重要作用,而且与炎症反应密切相关[14],正常情况下,NF-κB主要以p65和p50二聚体形式与IKB结合于胞浆,未见生物活性,当细胞受到外界刺激时,IKB发生磷酸化而被降解,暴露NF-κB二聚体从胞浆转移入细胞核,从而调控多种基因的转录,其中包括促炎细胞因子基因的表达。既往研究表明,NF-κB信号通路的激活与乳腺癌、非小细胞肺癌的增殖活性和迁移浸润密切相关[15-16]。LIU F F等[17]研究发现,阻断NF-κB信号通路可抑制喉癌细胞增殖迁移以及EMT过程。WANG Y S等[18]研究报道NF-κB信号通路参与调控EMT过程。黄芩素通过抑制NF-κB p65通路介导的EMT过程和炎症反应以改善肺纤维化,白细胞介素17A激活NF-κB信号通路介导EMT促进胆囊癌侵袭[19-20]。本实验以脑胶质瘤细胞U251为研究对象,探讨白藜芦醇抑制脑胶质细胞瘤增殖和侵袭是否与该信号通路有关。实验结果显示,LPS激活该信号通路后,E-cad蛋白表达减少,N-cad、vimentin蛋白表达增加,白藜芦醇预处理后,E-cad蛋白表达增加,N-cad、vimentin蛋白表达减少,此结果提示在脑胶质瘤细胞中,白藜芦醇可通过阻断NF-κB信号通路抑制EMT过程。
综上所述,白藜芦醇可抑制脑胶质瘤细胞增殖和侵袭,促进凋亡,其可能是通过调节NF-κB信号通路抑制EMT过程、减轻炎症反应发挥调控作用,为临床治疗脑胶质瘤提供理论依据。

