新绿原酸抑制血管生成的研究
袁红芹,王荣春,段秀英,王梦婷,陈锡强*
1.陕西步长制药有限公司,咸阳 712000;2.齐鲁工业大学生物研究所,济南 250103;3.陕西国际商贸学院,西安 710075;4.山东省生物检测技术工程实验室,济南 250103
恶性肿瘤是一类常见疾病,具有细胞分化和增殖异常、浸润性及转移性等生物学特征,已成为世界性难题。抑制血管生成是抗肿瘤的重要防治手段之一[1-3]。血管内皮生长因子(VEGFR)在新生血管的生成中发挥重要的调控作用[4],其中VEGFR2是核心调控因子,抑制VEGFR2可抑制肿瘤细胞的增殖和迁移,是抗肿瘤的重要机制[5]。
目前肿瘤血管新生过程参与肿瘤生长和转移的研究已取得显著进展,临床研究已证实, 抑制内皮细胞VEGF信号通路可作为治疗肿瘤的策略[6]。斑马鱼由于具有与人类基因组同源性较高、个体小、可大规模快速繁殖、胚体透明易于观察,以及成本低等优势,已经在抗肿瘤药物研发和临床治疗研究中有着广泛的应用[7],由于斑马鱼早期免疫功能缺失因而容易成瘤,还可以利用斑马鱼的成像能力进行体内深层次的研究[8]。新绿原酸(5-CQA)是广泛分布于中药材中的活性成分,研究表明5-CQA具有广泛的抗肿瘤活性,包括抗氧化、抗炎等活性[9-10],本研究利用体外细胞模型和斑马鱼模型,考察5-CQA对肿瘤血管生成的影响,并研究其抗肿瘤作用机制。
1 仪器与材料
1.1 仪器
Multiskan FC型酶标仪(美国Thermo公司);超净工作台(苏州安泰净化消毒设备厂);二氧化碳细胞培养箱(赛默飞世尔科技有限公司);IX51型倒置显微镜、SZX61型体视荧光显微镜和FV1000型激光共聚焦显微镜均购自奥利巴斯有限公司;ZGENE biopco 1500型微量注射仪(力钧生物科技有限公司);HPG 280BX型光照培养箱(哈尔滨东联电子科技公司);斑马鱼养殖饲养设备(北京爱生科技发展有限公司)。
1.2 试药
新绿原酸(质量分数≥96.5%,南通飞宇生物科技有限公司);基质胶、DMEM高糖培养基和新鲜胎牛血清均购自美国Gibco公司;链霉蛋白酶E、Tricaine均购自北京索莱宝科技有限公司;实时定量荧光PCR试剂盒SYBR Primix ExTaqTM(Takara公司)。
1.3 材料
HUVEC购自 ATCC 公司;人乳腺管癌细胞T-47D由聊城大学严守升博士提供;野生型斑马鱼、AB品系斑马鱼和TG(flk1:EGFR)血管荧光品系由山东省科学院生物研究所斑马鱼药物筛选平台提供;SD大鼠由山东济南朋悦实验动物有限公司提供[SCXK(鲁)20190003]。本研究经山东省科学院生物研究所实验动物福利伦理委员会审查并批准。
2 方法
2.1 5-CQA对HUVEC增殖的影响
取处于对数生长期的HUVEC,用含体积分数10%胎牛血清的DMEM重悬细胞,调整细胞密度为5×104个·mL-1,每孔100 μL接种于96孔板,置于CO2细胞培养箱中培养24 h后,每个剂量设置3个复孔, 分别设置空白对照组、5-CQA不同梯度浓度组(按照0~320 μmol·L-1梯度设置)。继续培养48 h,加入质量浓度为5 mg·mL-1的MTT溶液20 μL,37 ℃继续孵育2 h后终止培养,移除培养基,加入DMSO置于脱色摇床20 min,吸取上清移入96孔板,用全自动酶标仪测定各孔490 nm处的吸光度值(A)。
2.2 5-CQA对HUVEC迁移能力的影响
预先在6孔板底部画上标记线,将HUVEC收集计数后,按每孔4×105个细胞的密度接种于 6 孔板。待细胞生长铺满皿底后,用已消毒的枪头沿纵轴划线,用PBS反复清洗2次,除去残留漂浮细胞,分别加入无血清的不同浓度的5-CQA(2、4、8 μmol·L-1),继续培养,同时设置对照组。12 h后于倒置显微镜下观察和记录HUVEC的迁移情况,实验重复3次,取平均值。
2.3 PCR检测HUVEC血管相关基因的表达
将HUVEC收集、计数后,按每孔4×105个细胞的密度接种于6孔板。待细胞贴壁后,加入不同浓度的5-CQA(28、56、112 μmol·L-1)并设置对照组,48 h后收集细胞,依据Trizol RNA标准分离方法抽提RNA,采用Invitrogen反转录试剂盒进行cDNA合成。以合成的cDNA为模板进行PCR扩增,引物序列由上海生工生物技术有限公司合成,引物序列见表1。以GAPDH作为内参。反应体系:cDNA 4 μL,上游引物0.4 μL,下游引物0.4 μL,SYBR Mixture 5 μL,ROX 0.2 μL,加双蒸水使总体积为20 μL。反应条件:预变性95 ℃ 5 min,变性95 ℃ 5 s,退火、延伸60 ℃ 35 s。反应终止后,基因表达水平用2-△△Ct计算,实验重复3次,取平均值。

表1 引物序列
2.4 5-CQA对大鼠动脉环微血管生成的影响
检测5-CQA对大鼠动脉环血管生成的影响参照NICOSIA R F等[11]的方法进行并加以改进。取4周SD雄性大鼠2只,适应性饲养3 d,麻醉后处死、解剖,取出其主动脉,用预冷PBS清洗并剔除结缔组织,剪成面积约为1 mm2的动脉环,加入已预制混合胶的48孔板中,分别加入阳性药PTK787和不同浓度的5-CQA,平放动脉环后置于CO2培养箱中,40 min后加入0.2 mL完全培养基,每2~3 d更换1次含药培养基,第5天用倒置显微镜观察动脉内皮细胞和新生血管的生成情况,拍照记录,用Image J软件处理图像。
2.5 5-CQA对斑马鱼血管生成模型的影响
斑马鱼饲养方法、取卵方法和移植瘤的造模方法参照已发表文献[12-13]。取健康发育的TG(flk1:EGFR)斑马鱼24 h受精卵,用质量浓度为1.0 mg·mL-1的链酶蛋白酶E溶液脱去卵膜。在体视显微镜下挑选正常的斑马鱼胚胎,移入24孔培养板中,每孔12~14枚,每次每组设2个重复孔,用不同浓度的5-CQA处理孵育斑马鱼,置于28 ℃光照培养箱中让胚胎继续发育。48 h受精后于荧光显微镜下观察,计算节间血管生成长度,并观察胚胎死亡或畸形情况。
将斑马鱼移植瘤模型T-47D细胞置于37 ℃、体积分数为5%的CO2培养箱中培养。在无菌条件下将培养瓶中的T-47D细胞除去培养基,用PBS清洗2次,胰酶消化后加入含少量血清的培养基终止其消化,离心后更换新的培养基,每1 mL细胞悬液加入活细胞染色剂CM-DiL 7.5 μL,37 ℃孵育5 min,于4 ℃孵育15 min,离心弃上清,PBS清洗2次后加入无血清培养基重悬,镜下调整细胞密度至1×106个·mL-1。
在受精卵发育48 h后,在体视显微镜下挑选正常的斑马鱼胚胎,移入6孔培养板中,并进行显微注射,注射体积5 nL,4 h后在荧光倒置显微镜下挑选注射部位一致的斑马鱼,并加药处理,每孔15枚,设置正常对照组、模型组、224 μmol·L-15-CQA组,然后置于28 ℃光照培养箱中让胚胎继续发育。48 h后将各组胚胎麻醉后用激光共聚焦显微镜观察、拍照,并统计荧光面积。
2.6 统计学方法

3 结果
3.1 MTT结果
与对照组比较,经5-CQA处理24 h后的细胞存活率明显降低,在320 μmol·L-1时可显著抑制细胞的增殖(P<0.05),320 μmol·L-1及以下浓度对HUVEC的增殖无明显影响(P>0.05)。结果见表2。

表2 5-CQA对HUVEC增殖的影响
3.2 5-CQA对 HUVEC体外迁移能力的影响
用不同浓度5-CQA处理HUVEC 12 h,镜下可见大量细胞从划痕边缘向空白区域迁移,其中经5-CQA处理的HUVEC向空白区域迁移的距离较对照组明显缩短,且细胞迁移的距离随着5-CQA浓度的增加而缩短,见表3,表明5-CQA能够抑制HUVEC体外迁移能力并呈剂量依赖性。

表3 5-CQA对HUVEC迁移的影响
3.3 5-CQA对HUVEC成血管相关基因表达的影响
用不同浓度5-CQA(28、56、112 μmol·L-1)处理细胞48 h,按2-△△Ct计算其VEGF、bFGF基因的表达量,与对照组相比,5-CQA可显著抑制HUVEC中 VEGF、bFGF mRNA的表达量,见表4,表明5-CQA可通过抑制VEGF、bFGF基因的表达,抑制HUVEC成血管化并呈剂量依赖性。

表4 5-CQA对HUVEC中血管相关基因表达的影响
3.4 5-CQA对大鼠动脉环模型的影响
与对照组相比,PTK787组的微血管形成被显著抑制(P<0.001);与对照组比较,56、112 μmol·L-15-CQA组的微血管形成被显著抑制(P<0.05,P<0.01),且具有明显的剂量依赖性,28 μmol·L-15-CQA组的微血管无明显变化,见表5、图1。

表5 5-CQA对大鼠动脉环模型的影响
3.5 5-CQA对斑马鱼血管生成模型的影响
对照组节间血管完整,无荧光缺失。与对照组相比,阳性药PTK787组节间血管基本消失(P<0.001),表明阳性对照在此条件下具有明显活性。与PTK787组相比,224 μmol·L-15-CQA组的血管长度总值显著降低。5-CQA各组呈现出荧光血管缺失的情况,与对照组比较,56 μmol·L-15-CQA组与112 μmol·L-15-CQA组的节间血管总长度明显缩短(图2A)(P<0.01);在斑马鱼移植瘤模型中(图2B),可以观察到移植瘤组SIV网状增加,分支增多,荧光明显增强,SIV的A值与对照组有显著性差异(P<0.01),224 μmol·L-15-CQA组出现SIV生长缺失,与模型组比较SIV荧光A值有显著性差异(P<0.05)。结果见表6。
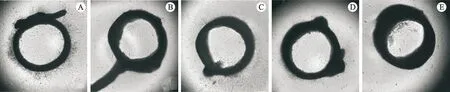
注:A.对照组;B.PTK787组;C.5-CQA 28 μmol·L-1组;D.5-CQA 56 μmol·L-1组;E.5-CQA 112 μmol·L-1组。
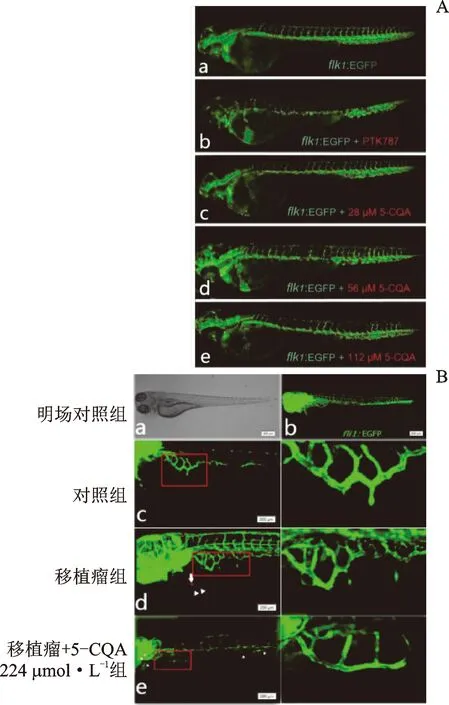
注:A.5-CQA对转基因荧光血管斑马鱼模型血管生成的影响;a.对照组;b.PTK787组;c.5-CQA 28 μmol·L-1组;d.5-CQA 56 μmol·L-1组;e.5-CQA 112 μmol·L-1组;B.5-CQA对转基因荧光血管斑马鱼移植瘤模型肠下静脉的影响;a.明场对照组;b.荧光血管图;c.对照组;d.移植瘤组;e.移植瘤+5-CQA 224 μmol·L-1组。箭头所示为红色肿瘤细胞;方框所示肠下静脉区域。
4 讨论
5-CQA是咖啡酰奎宁酸系列化合物中的一种,该化合物在植物中的分布非常广泛[14],是中药材金银花、杜仲的主要活性成分,文献调研发现该类化合物具有广泛的药理活性,可通过抗氧化、抗炎和诱导凋亡发挥抗肿瘤的作用,但5-CQA抑制血管生成的作用尚未见报道。内皮细胞的迁移是血管新生的重要阶段,本研究结果表明,5-CQA不仅可以显著抑制HUVEC的增殖,并且对其迁移具有抑制作用,且呈剂量依赖性。众多生长因子可调控血管内皮细胞的增殖、迁移及分化,从而促进生理状态和病理状态下的血管新生,其中最重要的生长因子是血管内皮细胞因子(VEGF)、碱性成纤维细胞生长因子(bFGF)[15]。VEGF参与血管内皮细胞中多种生物学状态的调控,bFGF可与内皮细胞表面受体直接结合,诱导内皮细胞迁移、增殖以及蛋白酶分泌[16]。本研究发现5-CQA通过抑制内皮细胞中VEGF、 bFGF mRNA的表达从而发挥抑制血管生成的作用。

表6 5-CQA对转基因荧光血管斑马鱼移植瘤模型肠下静脉的影响
本研究利用斑马鱼模型的优势,发现5-CQA具有抑制血管生成的活性。研究结果显示,在不影响HUVEC增殖的条件下,112 μmol·L-1的5-CQA对大鼠动脉环微血管生成、斑马鱼的节间血管模型和移植瘤引起的SIV增生具有明显的抑制作用。
血管内皮生长因子受体2(VEGFR2)是内皮细胞中VEGF诱导的信号转导的主要受体,在内皮细胞参与血管增殖和出芽步骤中起重要的调控作用[17-18]。绿原酸类化合物是由咖啡酸(caffeic acid)与奎尼酸(quinic acid)形成的缩酚酸,近年的研究发现,咖啡酸具有抑制血管生成和间接抑制VEGFR2表达的作用[19]。在本研究中,5-CQA能够引起转基因斑马鱼/移植瘤肠下静脉VEGFR2(flk1)荧光血管的缺失,表明5-CQA具有抑制血管生成的作用,其作用机制与抑制斑马鱼VEGFR2的表达有关。
虽然CQA类化合物抗肿瘤活性一直是当今研究的热点,但大部分集中在新靶点及体外研究,缺乏体内研究。本研究前期利用斑马鱼模型可视化和高通量的特性,完成了咖啡酸奎宁酸系列化合物的初筛,并进行斑马鱼模型的体内活性研究[20],报道了5-CQA抑制血管生成的作用,表明5-CQA可作为潜在抗肿瘤候选天然化合物。

