生物信息学分析TMEM8A在卵巢癌中的表达水平及其与患者预后的关系*
王 献,刘 冲,郜赵伟,朱晓明,3△
1.空军军医大学第二附属医院妇产科,陕西西安 710038;2.空军军医大学第二附属医院检验科,陕西西安 710038;3.解放军总医院海南医院妇产科,海南三亚 572013
卵巢癌是女性生殖系统三大恶性肿瘤之一,占女性所有恶性肿瘤的2.5%[1]。2020年统计显示,全球卵巢癌新增约31.4万,在所有癌症中占1.6%;死亡人数约20.7万,在所有癌症中占2.1%,卵巢癌死亡率位居女性生殖系统三大肿瘤之首[2]。近年来,卵巢癌的诊断率和治疗技术均有所提高,但仍有诸多问题亟待解决。因此,研究卵巢癌中表达水平显著改变的基因,对卵巢癌患者的临床诊断、预后监测及靶向治疗药物开发具有重要意义。
TMEM8A,或称PGAP6,是一种对糖基磷脂酰肌醇(GPI)具有特异性的磷脂酶A2,在多种细胞表面表达,参与GPI锚成熟的脂质重塑步骤及通过维持富含cav1的质膜亚区稳定的数量,间接参与了RAC1从细胞质到质膜的易位,稳定了质膜上的RAC1[3-4]。笔者前期利用卵巢癌组织的转录组测序,发现TMEM8A在卵巢癌组织中表达水平升高。本文利用生物信息学分析TMEM8A表达在卵巢癌患者的预后价值、免疫细胞浸润的关系和相关基因的筛选及功能富集分析,为探讨TMEM8A在卵巢癌发生发展中的作用及临床诊疗价值提供参考。
1 资料与方法
1.1TMEM8A表达差异分析 基于卵巢癌TCGA及GTEx数据库,利用GEPIA2(http://gepia2.cancer-pku.cn/)分析TMEM8A在卵巢癌组织中表达水平的变化。|Log2FC|>1及P<0.01为差异有统计学意义。利用UALCAN(http://ualcan.path.uab.edu.)分析TMEM8A与卵巢癌患者年龄、肿瘤分级、肿瘤分期的相关性。
1.2TMEM8A预后价值分析 基于不同的GSE数据集,利用KMPlotter(http://www.kmplot.com/)分析TMEM8A与卵巢癌患者的总生存期(OS)进行相关性分析,自动选择最优截断点。利用GraphPad Prism 9.0绘制不同数据集生存分析森林图。
1.3TMEM8A与免疫浸润相关性分析 利用TIMER(http://timer.cistrome.org/)分析TMEM8A表达与卵巢癌组织免疫细胞浸润的相关性及TMEM8A表达与免疫细胞浸润预后价值。
1.4TMEM8A表达相关基因筛选及功能富集分析 利用LinkedOmics数据库,筛选卵巢癌中与TMEM8A表达相关的基因(正相关及负相关基因Top50),并利用DAVID对基因进行GO及KEGG通路分析,利用R绘制气泡图对功能分析结果进行可视化。
1.5统计学处理 表达水平差异采用t检验,|Log2FC|>1及P<0.01视为差异有统计学意义。生存分析采用log-rank检验,以P<0.05为差异有统计学意义。免疫浸润结果以P<0.05为差异有统计学意义。GO及KEGG通路分析结果,以P<0.05为差异有统计学意义。
2 结 果
2.1TMEM8A在卵巢癌中表达水平显著升高 卵巢肿瘤组织中TMEM8A表达水平显著高于正常组织,差异有统计学意义(P<0.01)(图1A)。TMEM8A在Ⅲ期和Ⅳ期卵巢癌组织中的表达水平显著低于Ⅱ期肿瘤(图1B);TMEM8A表达水平与卵巢癌患者年龄呈现一定程度的正相关(图1C),TMEM8A表达水平在不同肿瘤分级、不同种族、不同TP53突变状态的患者之间差异无统计学意义(P>0.05)(图1D、E、F)。

注:A为GEPIA2分析显示TMEM8A在卵巢癌组织表达水平升高;B为TMEM8A在不同分期卵巢癌组织中的表达水平;C为TMEM8A在不同年龄段卵巢癌患者的表达水平;D为TMEM8A在不同分级卵巢癌中的表达水平;E为TMEM8A在不同种族卵巢癌患者的表达水平;F为TMEM8A在具有不同TP53突变状态卵巢癌患者中的表达水平差异分析;*代表P<0.05,**代表P<0.01。
2.2TMEM8A在卵巢癌的预后价值分析 KMplotter分析结果显示,TMEM8A高表达水平与卵巢癌患者预后差相关(HR=1.57,P<0.000 1),高表达水平组患者OS中位值为35个月;低表达组患者OS中位值为50.69个月(图2A)。森林图结果显示,7组卵巢癌生存数据集中,TMEM8A高表达在6组中与预后差相关(HR>1),其中,在GSE19829与GSE276512比较,差异有统计学意义(P=0.033;P=0.003)(图2B)。
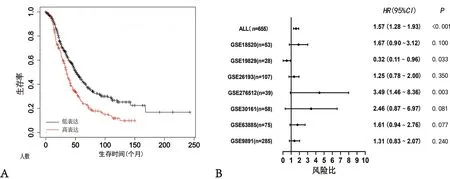
注:A为生存曲线图显示TMEM8A的预后价值;B为森林图显示TMEM8A的预后价值。
2.3TMEM8A在卵巢癌中的表达水平与免疫细胞浸润相关性分析 TMEM8A与肿瘤组织免疫细胞浸润的相关性分析显示,肿瘤组织中TMEM8A表达水平与CD4+T细胞、调节性T细胞、中性粒细胞、单核细胞、肿瘤相关树突状细胞、自然杀伤细胞、癌症相关成纤维细胞、内皮细胞浸润水平呈正相关(P<0.05);与CD8+T细胞、CD4+Th1细胞、B细胞、单核细胞、浆细胞样树突状细胞、常见淋巴祖细胞浸润水平呈负相关(P<0.05),见表1。
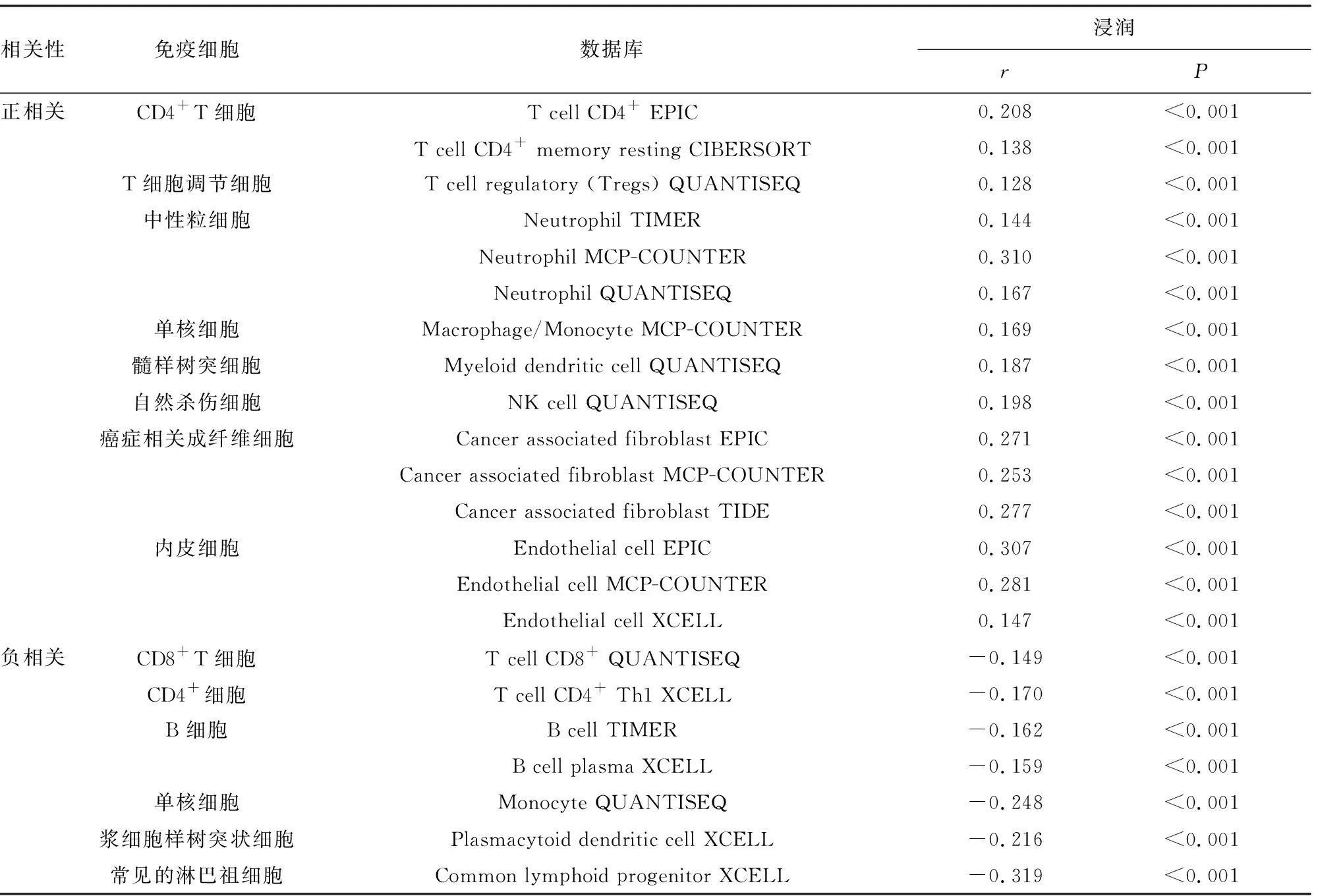
表1 TMEM8A表达与免疫细胞浸润的相关性分析
2.4TMEM8A结合免疫细胞浸润在卵巢癌的预后价值分析 在TMEM8A高表达的卵巢癌患者中,B细胞幼细胞高浸润患者预后差(HR=2.84,P=0.003);中性粒细胞高浸润患者预后差(HR=2.89,P<0.001)。在TMEM8A低表达的卵巢癌患者中,浆细胞高浸润患者预后好(HR=0.56,P=0.017;HR=0.39,P<0.001);M1巨噬细胞高浸润患者预后好(HR=0.55,P=0.027);M2巨噬细胞低浸润患者预后差(HR=2.11,P=0.003);滤泡辅助T细胞高浸润患者预后好(HR=0.49,P=0.005;HR=0.44,P=0.001)。见表2。
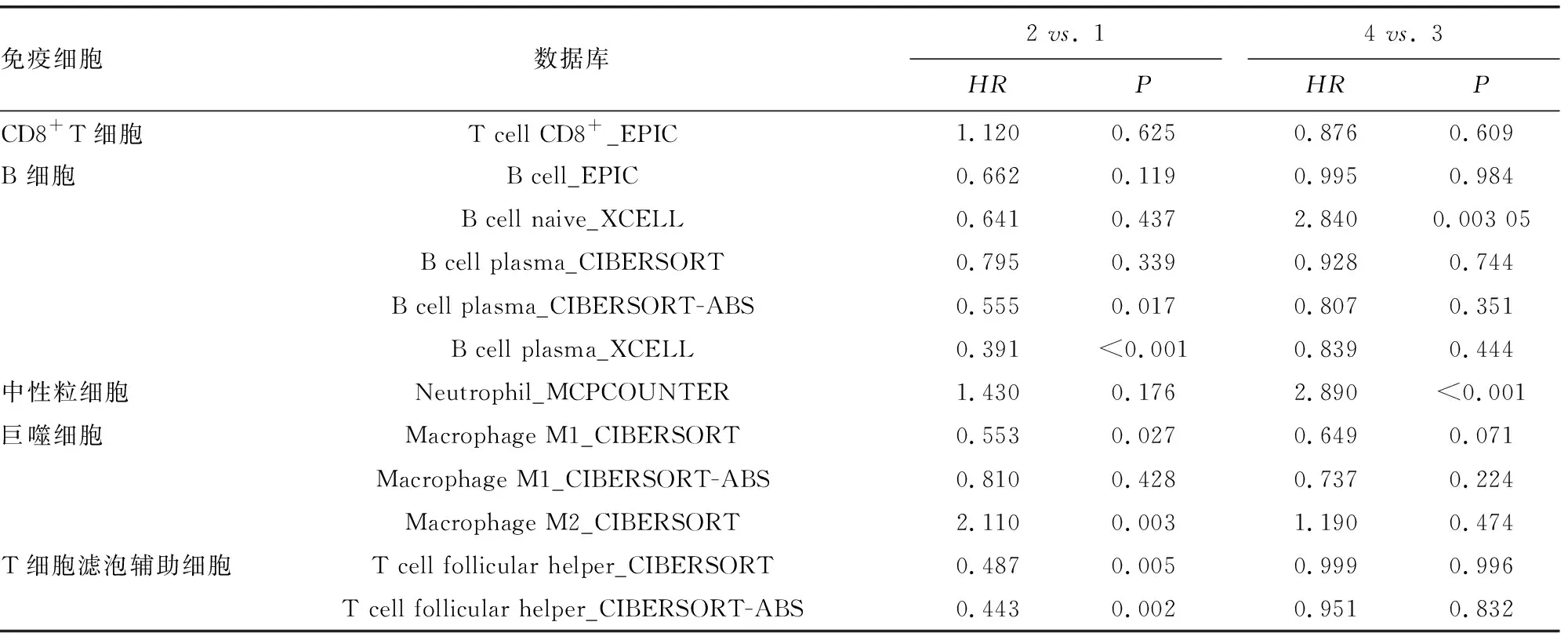
表2 TMEM8A表达结合免疫细胞浸润在卵巢癌的预后分析
2.5TMEM8A表达相关基因筛选及功能富集分析 利用LinkedOmics数据库筛选了TMEM8A表达水平呈正、负相关基因(Top50),TMEM8A与ITFG3(r=0.675,P<0.001)、PIGQ(r=0.672,P<0.001)、CLCN7(r=0.611,P<0.001)等基因表达水平呈正相关(图3A),与PCBD2(r=-0.399,P<0.001)、MBLAC2(r=-0.390,P<0.001)等基因表达水平呈负相关(图3B)。TMEM8A呈正相关基因主要参与病毒过程、蛋白质泛素化、铁硫团簇组件等生物学过程;主要表达于溶酶体膜、雷帕霉素(TROC)复合物1和TROC复合体2;主要分子功能与连接酶活性、GTP酶激活剂活性、泛素蛋白连接酶结合有关(图3C)。负相关基因主要参与小亚基核糖体核糖核酸的成熟、核转录mRNA分解代谢过程、病毒转录、信号识别颗粒依赖性共翻译蛋白靶向膜、核糖体RNA加工、翻译起始生物学过程;主要表达于细胞核与核浆;主要分子功能与聚(A)RNA结合相关(图3D)。KEGG通路分析显示(图3E),正相关基因参与哺乳动物雷帕霉素(mTOR)信号通路(P=0.009);负相关基因参与核糖体形成(P=0.033)及新型冠状病毒感染(COVID-19)(P=0.067)。

注:A为TMEM8A表达正相关基因热图;B为TMEM8A表达负相关基因热图;C为TMEM8A表达正相关基因GO分析;D为TMEM8A表达负相关基因GO分析;E为TMEM8A表达相关基因KEGG分析。
3 讨 论
本研究旨在探索TMEM8A在卵巢癌中的表达水平变化及潜在预后价值。本研究发现,TMEM8A在卵巢癌组织中表达水平显著升高;并且TMEM8A表达水平与年龄呈正相关;而在TNM分期中,Ⅱ期卵巢癌患者TMEM8A表达水平显著高于Ⅲ期和Ⅳ期患者,TMEM8A表达随着肿瘤分期的进展而降低的可能原因为:(1)TMEM8A的表达水平可能与卵巢癌肿瘤细胞的分化程度相关,高分化肿瘤细胞TMEM8A表达水平较高,而低分化肿瘤细胞中TMEM8A表达水平较低。如李靖等[5]研究显示,SF3B1在胰腺癌患者中表达水平升高,但是与肿瘤分期呈负相关。(2)TMEM8A表达降低可能与其他肿瘤基因表达调控相关,在肿瘤进展中,一些肿瘤基因可能以反馈等效应影响TMEM8A的表达,从而降低其表达水平,但与TMEM8A功能机制相关的基因目前尚未明确,其确切的调控机制仍需更深入的研究。TMEM8A高表达水平的卵巢癌患者较TMEM8A低表达水平患者生存时间更短,提示TMEM8A表达水平可能成为卵巢癌患者的独立的预后标志物。肿瘤组织中TMEM8A表达水平与CD4+T细胞、调节性T细胞、中性粒细胞、单核细胞、肿瘤相关树突状细胞、自然杀伤细胞、癌症相关成纤维细胞、内皮细胞浸润呈正相关(P<0.05);与CD8+T细胞、CD4+Th1细胞、B细胞、单核细胞、浆细胞样树突状细胞、常见淋巴祖细胞浸润呈负相关(P<0.05)。Treg细胞在免疫稳态调节方面发具有重要作用,Treg细胞可促进肿瘤细胞的免疫逃逸,促进肿瘤进展,肿瘤组织Treg细胞增多提示预后不良,研究显示,Treg细胞可通过损害抗肿瘤免疫反应促进卵巢癌的进展,有研究表明TIGIT通过增强卵巢癌中的Tregs反应并介导了肿瘤免疫抑制[6-10]。因此,TMEM8A与Treg细胞浸润呈正相关提示其可能在卵巢癌发生发展起促进作用。中性粒细胞参与急性损伤和修复、癌症、自身免疫和慢性炎症过程,并且可通过抑制免疫反应限制炎症对组织的损害,但同样可能抑制抗肿瘤免疫反应[11]。本研究发现在TMEM8A高表达卵巢癌患者中,中性粒细胞高浸润的卵巢癌患者预后差,因而,TMEM8A高表达卵巢癌患者的中性粒细胞高浸润提示预后不良。树突状细胞可监测机体的感染或恶性肿瘤,并激活特异性T淋巴细胞,引发特异性免疫反应;但肿瘤微环境的改变可导致其在肿瘤发展中起促进作用[12],TMEM8A在卵巢癌中表达与DC呈正相关提示其可能与肿瘤微环境改变相关。单核细胞是癌症发生和发展的重要调节细胞,有研究证实淋巴细胞-单核细胞比值(LMR)是影响卵巢癌患者预后的独立因素,高LMR的患者预后较好[13]。自然杀伤细胞是重要的抗肿瘤免疫细胞,其主要通过释放穿孔素和颗粒酶诱导靶细胞凋亡介导肿瘤杀伤反应,但自然杀伤细胞活性受免疫抑制肿瘤微环境的限制,因此,肿瘤环境的自然杀伤细胞高浸润可能存在反馈效应[14-15],TMEM8A与自然杀伤细胞相关性提示其可能与肿瘤微环境改变有关。癌症相关成纤维细胞是卵巢癌微环境中的重要部分,其与癌细胞的相互作用促进癌症的进展,而且,癌症相关成纤维细胞还可以调节免疫细胞活性,抑制抗肿瘤免疫反应,因此,癌症相关成纤维细胞在肿瘤组织的浸润性提示可能参与肿瘤进展及抑制肿瘤免疫过程[16-17]。内皮细胞不仅可以促进肿瘤生长发育,也参与肿瘤转移过程。另外,内皮细胞也是癌症相关成纤维细胞的主要来源之一[18]。因此,TMEM8A与内皮细胞的浸润相关性提示其可能参与卵巢肿瘤的进展、肿瘤免疫的抑制及癌症相关成纤维细胞的形成。CD8+T细胞在清除细胞内感染、恶性细胞方面起着关键作用,并具有长期的免疫性保护,且有研究表明高CD8+T细胞浸润患者较低CD8+T细胞浸润患者的总生存期长[19- 20]。但是在慢性感染或癌症的情况下,CD8+T细胞暴露于持久的抗原或炎症信号会导致CD8+T细胞的功能逐渐恶化,这种状态被称为“衰竭”[21]。TMEM8A与CD8+T细胞的负相关性提示其可能参与CD8+T细胞消耗/衰竭过程。浆细胞样树突状细胞是树突状细胞的一个亚群,能产生大量Ⅰ型干扰素(IFN-Ⅰ/α),具有调节免疫系统的先天和适应性成分的作用,是癌症免疫的关键角色。MITCHELL等[22]研究表明,卵巢癌患者的浆细胞样树突状细胞正常活性遭到破坏,可使其作用从免疫刺激转变为免疫抑制,从而抑制抗肿瘤T细胞的功能。另外,本文分析显示,TMEM8A高表达水平的卵巢癌患者中,B细胞幼细胞高浸润患者预后差;TMEM8A低表达水平的卵巢癌患者中,浆细胞高浸润患者预后好;滤泡辅助T细胞高浸润患者预后好,KROEGER等[23]和LI等[24]相关研究亦有证实。在卵巢癌组织中,TMEM8A表达正相关基因主要参与病毒过程、蛋白质泛素化、铁硫团簇组件等生物学过程。而负相关基因主要参与小亚基核糖体核糖核酸的成熟、核转录mRNA分解代谢过程、病毒转录、信号识别颗粒依赖性共翻译蛋白靶向膜、核糖体RNA加工、翻译起始等生物学过程。卵巢癌中TMEM8A与PIGQ、AXIN1、CLCN7基因表达水平呈正相关。PIGQ参与GPI生物合成的第一步,TMEM8A(PGAP6)是GPI的加工酶,它是一种主要定位于细胞表面的GPI特异性磷脂酶A2,通过调节Cripto-Nodal信号对胚胎发育中前后轴的形成起着至关重要的作用,GPI锚定蛋白在不同癌症中发挥重要作用已经被证实,因而PIGQ与TMEM8A很可能通过共同参与GPI形成过程而参与肿瘤的发生发展[25]。CLCN7产物属于CLC氯化物通道蛋白家族,氯离子通道在质膜和胞内细胞器中起重要作用,有研究表明,各种氯离子通道通过促进肿瘤-基质相互作用和促进癌症转移在卵巢癌发生中发挥作用[26]。AXIN1编码的蛋白作为Wingless/Wnt信号通路的负调控因子,可诱导细胞凋亡,该基因的突变与肝细胞癌、肝母细胞瘤、卵巢子宫内膜腺癌和髓母细胞瘤相关。有研究表明,在恶性卵巢肿瘤中,Wingless/Wnt通路成分的表达增加,该信号通路可能在细胞转化和肿瘤进展中具有促进作用[27-28]。
综上所述,本文通过基于TCGA数据对TMEM8A(PGAP6)在卵巢癌中表达、生存分析、临床分期分级、肿瘤免疫浸润、以及相关基因的表达和生物分析等进行了探索,结果表明,TMEM8A在卵巢癌组织中表达水平显著升高;TMEM8A高表达与卵巢癌患者预后差相关。然而,TMEM8A在卵巢癌发生发展中的作用机制尚待进一步实验研究明确。

