ABCG1介导的胆固醇外流在SLE患者中的作用及机制研究*
寇艳婷,朱星星,李 莉,原江水△
1.大连医科大学研究生院,辽宁大连 116044;2.青岛市市立医院检验科,山东青岛 266071;3.青岛大学青岛医学院临床医学系,山东青岛 266073
系统性红斑狼疮(SLE)是一种累及多器官的自身免疫性结缔组织病,好发于育龄期女性。SLE患者易并发血脂代谢异常,SLE相关性的心血管系统疾病是SLE患者主要死亡原因之一[1-2]。ATP结合盒转运蛋白G1(ABCG1)是一种跨膜转运蛋白,由巨噬细胞广泛表达,在促进胆固醇和磷脂外流到高密度脂蛋白胆固醇(HDLC)的过程中起关键作用。本研究通过检测合并心血管并发症SLE患者和未合并心血管合并症的SLE患者中ABCG1介导的胆固醇外流能力(CEC)的变化,探讨ABCG1介导的胆固醇外流途径在SLE患者心血管疾病高发中可能的临床意义。
1 资料与方法
1.1一般资料 选取2017年1月至2021年10月在青岛市市立医院(下称本院)就诊的 SLE 患者73例作为SLE组,按是否合并心血管并发症分为合并心血管并发症患者40例(SY组),未合并心血管并发症患者33例(SN组),其中男12例,女61例,年龄16~83岁,平均(44±16)岁。纳入标准:患者均符合2009年美国风湿病学会制订的SLE诊断标准[3]。排除标准:排除存在感染、肿瘤及其他自身免疫性疾病的患者。选择同期在本院进行健康体检的52例体检健康者作为对照组(HC组)。其中男23例,女29例,年龄23~81岁,平均(43±15)岁。SLE组和HC组一般资料比较差异无统计学意义(P>0.05),具有可比性。标本采集经研究对象知情同意及本院伦理委员会审查批准。
1.2仪器与试剂 美国ABI荧光定量PCR循环仪;美国Invitrogen公司的TRIzol总RNA提取试剂(货号15596-026)和Lipofectamine 3000(货号L3000015);中国江苏凯基生物技术股份有限公司的0.1% DEPC Water(货号KGDN4500)和CHO-K1细胞;日本TaKaRa公司的cDNA第一链合成试剂盒(货号RR036B)和One Step TB GreenTMPrimeScriptTMRT-PCR Kit Ⅱ(SYBR Green)(货号RR086B);美国Corning Incorporated公司的6 well-cell culture plate(货号3516);英国abcam公司的胆固醇外流分析试剂盒(货号ab196985);美国Gibco公司的DMEM培养基(货号C11995500BT)。
1.3方法
1.3.1pcDNA3.1(+) -ABCG1过表达载体构建及转染 通过逆转录-聚合酶链反应在(RT-PCR)扩增获得ABCG1目的基因片段,扩增产物大小1 671 bp,产物以1%琼脂糖凝胶电泳,产物回收纯化按试剂盒说明书进行,将回收纯化后的产物及 pcDNA3.1(+) 载体分别通过Hind Ⅲ、EcoR I酶切,然后进行连接、转化,PCR鉴定重组克隆(F:5′-CCG GGG AAA GGT CTC GAA TC-3′,R:5′-CGC AGG GTT GTG GTA GGT AG-3′),测序比对经酶切验证的阳性克隆证实构建成功。将处于对数生长期的CHO-K1细胞接种于6孔板中,细胞密度达到70%~80%时采用Lipofectamine 3000将pcDNA3.1(+) -ABCG1过表达载体转染CHO-K1细胞,培养4~6 h后进行RT-PCR鉴定,更换新鲜培养基,将培养板置于37 ℃的含5% CO2培养箱中继续培养48 h,用于后续实验。
1.3.2血浆标本的采集及准备 清晨空腹静息状态下采集肘静脉血,使用乙二胺四乙酸二钾(EDTA-K2)抗凝,经4 ℃、3 000 r/min离心10 min后取上清液,保存于-80 ℃冰箱内备用。
去除ApoB血浆的制备:100 μL血浆中加入40 μL的PEG溶液(20%PEG,200 mmol/L的甘氨酸缓冲液,pH 7.4),沉淀血浆中含有ApoB的脂蛋白。孵育20 min后,于4 ℃ 10 000 r/min离心30 min沉淀,收集含有HDLC的上清液,处理后的血浆用于后续的胆固醇外流实验。
1.3.3血脂水平检测 脂代谢指标由本院检验科采用Beckman Au5821生化分析仪及相应配套试剂盒检测血浆三酰甘油(TG)、总胆固醇(TC)、HDLC、低密度脂蛋白胆固醇(LDLC) 、非高密度脂蛋白胆固醇(non-HDLC)。non-HDLC计算公式:non-HDLC=TC-HDLC。
1.3.4胆固醇外流率测定 CHO-K1细胞和ABCG1高表达CHO-K1细胞以1×106个细胞接种于96孔板,培养2 h后待细胞贴壁后去除培养基,将50 μL的Labeling Reagent和50 μL的Equilibration Buffer混匀后,每孔加入100 μL孵育16 h,去除上清,用200 μL培养基缓慢清洗细胞,分别在培养基中加入2.8%的去除ApoB脂蛋白的血浆孵育4 h,收集上清液,测量荧光强度(Ex/Em=482/515 nm)。用100 μL细胞裂解液裂解单层细胞,并用振荡器室温振荡30 min,使单层细胞完全裂解,并测量裂解液的荧光强度(Ex/Em=482/515 nm)。胆固醇外流率=上清液荧光强度/(上清液荧光强度+裂解液荧光强度)×100%。
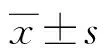
2 结 果
2.1各组基本情况及脂代谢指标 SLE组的脂代谢指标,与HC组相比较,TG、TC、HDLC水平差异无统计学意义(P>0.05);SLE组的LDLC、non-HDLC水平均高于HC组,差异有统计学意义(P<0.05),见表1。SY组的脂代谢指标,与SN组相比较,TC、HDLC、LDLC水平差异无统计学意义(P>0.05),TG水平显著高于SN组,差异有统计学意义(P<0.05),non-HDLC水平显著低于SN组,差异有统计学意义(P<0.05),见表2。

表1 SLE组与HC组的基本情况与血脂指标比较[M(P25~P75)或

表2 SY组与SN组的基本情况与血脂指标比较[M(P25~P75)或
2.2胆固醇外流率分析
2.2.1各组在ABCG1/CHO-K1细胞与CHO-K1细胞中胆固醇外流率分析 HC组中,与CHO-K1细胞(21.37%±0.40%)相比较,ABCG1/CHO-K1细胞胆固醇外流率(28.49%±0.68%)明显增高,差异有统计学意义(P<0.05,t=9.955);SLE组中,与CHO-K1细胞(34.36%±3.12%)相比较,ABCG1/CHO-K1细胞胆固醇外流率(38.75%±2.24%)明显增高,差异有统计学意义(P<0.05,t=2.798);SY组中,与CHO-K1细胞(37.14%±1.05%)相比较,ABCG1/CHO-K1细胞中胆固醇外流率(40.54%±0.95%)明显增高,差异有统计学意义(P<0.05,t=4.174);在SN组中,与CHO-K1细胞(31.58%±0.31%)比较,ABCG1/CHO-K1细胞胆固醇外流率(36.96%±1.43%)明显增高,差异有统计学意义(P<0.05,t=6.346)。见图1。

注:*P<0.05。
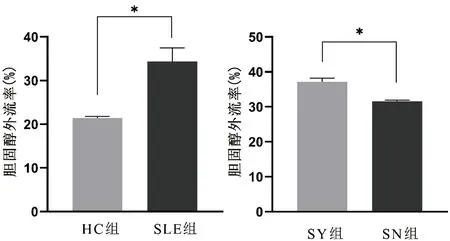
2.2.2HC组和SLE组在CHO-K1细胞中胆固醇外流率分析 CHO-K1细胞中,与HC组(21.37%±0.40%)相比较,SLE组的胆固醇外流率(34.36%±3.12%)明显增高,差异有统计学意义(P<0.01,t=10.032);与SN组(31.58%±0.31%)相比较,SY组(37.14%±1.05%)胆固醇外流率明显增高,差异有统计学意义(P<0.05,t=8.781)。见图2。
注:*P<0.05。
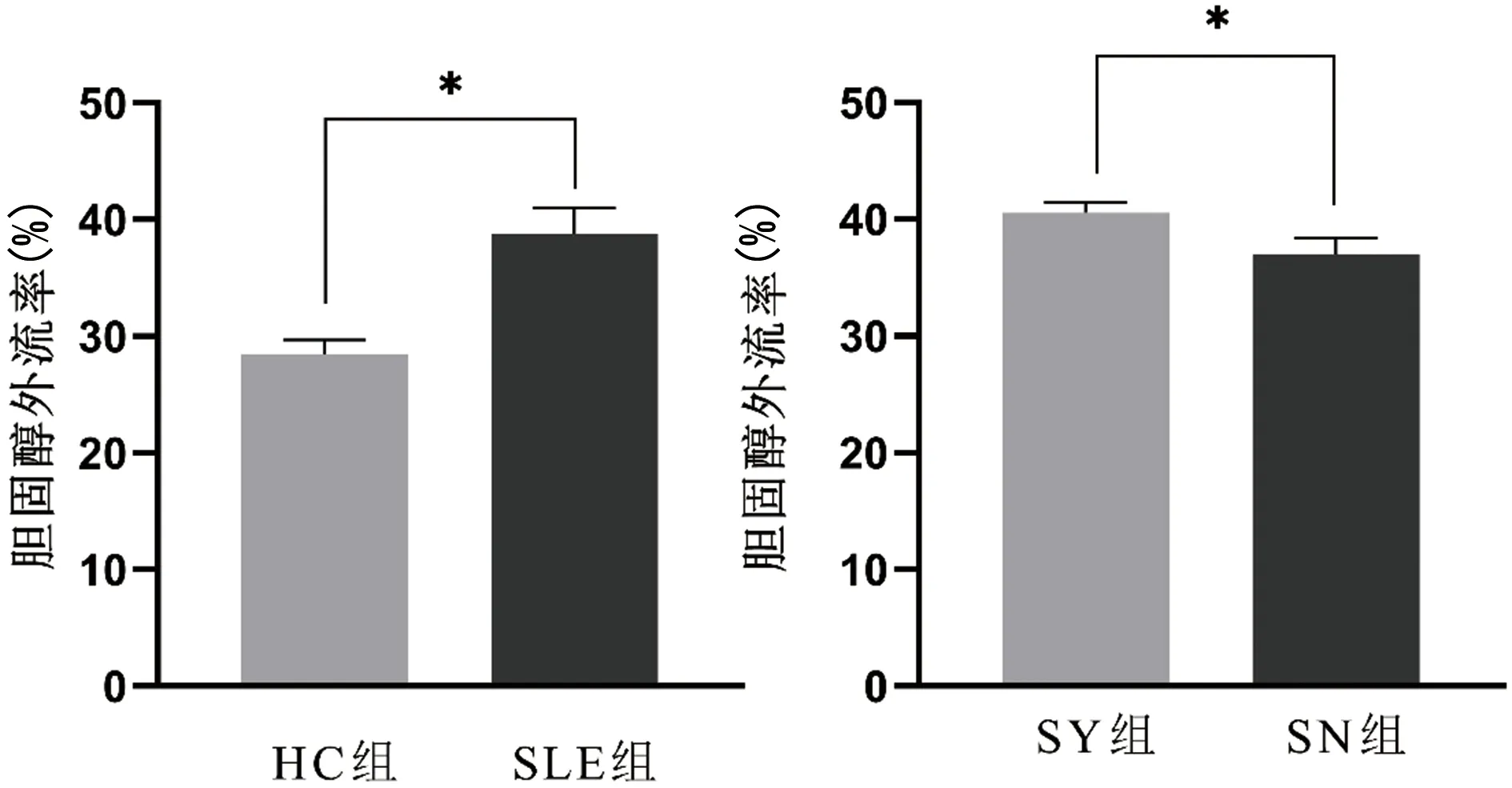
2.2.3HC组和SLE组在ABCG1/CHO-K1细胞中胆固醇外流率分析 ABCG1/CHO-K1细胞中,与HC组(28.49%±1.17%)相比较,SLE组的胆固醇外流率(38.75%±2.24%)明显增高,差异有统计学意(P<0.05,t=7.265);与SN组(36.96%±1.43%)相比较,SY组(40.54%±0.94%)胆固醇外流率明显增高,差异有统计学意义(P<0.05,t=3.616)。见图3。
注:*P<0.05。
3 讨 论
SLE作为一种累及多脏器、多系统的复杂的自身免疫性慢性结缔组织疾病,SLE发病与遗传和环境多种因素相关,中国SLE 患病率为 70/100 000,女性患病率为113/100 000[4-5]。SLE的死因呈双峰模式,早期主要是疾病本身所致的器官衰竭和感染,晚期死因是心血管系统疾病,已有研究发现,与普通人群相比,SLE患者呈现出更高的心血管系统疾病的死亡率,其中缺血性卒中和心肌梗死的发生率是健康人群的3倍[6]。脂代谢异常与SLE心血管合并症的发生密切相关,SLE患者中存在以TG水平升高和HDLC水平降低为主的脂质代谢紊乱[7]。有研究发现动脉粥样硬化患者的血脂指标与未发生动脉粥样硬化病变者相比较,TG、TC、LDLC水平偏高,HDLC水平偏低[8]。众所周知,育龄期的健康女性与年龄匹配的男性相比,患心血管疾病和冠心病的风险较低。但是,在SLE女性患者中,血脂异常的特征是LDLC水平升高和HDLC水平降低,消除了健康女性观察到的性别特异性的心血管疾病保护作用,此外过度激活促炎途径和某些SLE药物对脂质代谢的影响,所有这些都最终导致SLE患者的脂质谱改变[9]。动脉粥样硬化病变者血脂谱与SLE患者血脂谱相符合,提示脂代谢紊乱与SLE合并动脉粥样硬化相关。
胆固醇逆向转运(RCT)是机体清除过剩胆固醇的重要途径,对机体维持胆固醇稳态有重要意义。其中ABC转运蛋白家族介导的胆固醇外流是RCT途径之一,也是RCT关键的限速步骤。该途径包括ATP结合盒转运蛋白A1(ABCA1)和ABCG1的活性胆固醇外流。ABCA1介导从巨噬细胞流出的胆固醇和磷脂分子被无脂载脂蛋白ApoA-I接受,这是HDLC主要蛋白质部分,而ABCG1介导胆固醇流出至HDLC以进一步成熟[10-11]。ABCA1和ABCG1介导的胆固醇转运在很大程度上决定了细胞内胆固醇生理水平。ABCG1作为ABC转运蛋白家族的一员,有关其在动脉粥样硬化中的作用却一直存在争议。
SLE患者产生大量自身抗体和免疫复合物形成,并且自身抗原失耐受,其中dsDNA抗体可识别多种自身抗原,触发细胞凋亡、炎症反应和引起组织纤维化[12],SLE患者炎症状态扰乱机体胆固醇代谢稳态,与脂代谢异常及发生动脉粥样硬化之间的关系复杂。SLE患者的自身致病性抗体也是神经精神性红斑狼疮(NPSLE)发病的主要介质,NPSLE为影响SLE患者预后的主要因素之一[13]。
本研究发现在ABCG1表达上调的CHO-K1细胞中,在HC组、SY组和SN组中,细胞的胆固醇外流率均明显增加,说明ABCG1在胆固醇外流中可能起到促进作用,这与在ABCG1低表达的巨噬细胞中7-KC和7β-OHC胆固醇外流减少,胞内氧化固醇沉积增加[14]的研究结果在理论上具有一致性;TARLING 等[15]发现 ABCG1 基因敲除小鼠动脉粥样硬化病变区域粥样斑块体积缩小,巨噬细胞凋亡增加,提示ABCG1 低表达造成胞内氧化固醇堆积,加速细胞凋亡,这可能是机体抗动脉粥样硬化的相关机制。在多个动物及临床研究中,ABCG1对动脉粥样硬化的作用,结果并不一致,目前仍存在争议[16],本研究发现在ABCG1高表达的CHO-K1细胞中,SLE组胆固醇外流率明显增高,另外与SN组相比,SY组胆固醇外流率明显增高。
本研究基于去除ApoB血清CEC的研究,主要反映高密度脂蛋白的活性,高密度脂蛋白不仅反映血管中的脂质沉积情况,也对巨噬细胞和内皮细胞的炎症和免疫功能调节起重要作用[17]。SLE患者体内存在脂质代谢紊乱,血脂水平较健康者明显增高,研究表明SLE患者存在抗HDLC抗体及HDLC的结构和功能异常,导致SLE血脂谱主要表现为高TG、LDL、极低密度脂蛋白胆固醇(VLDLC)水平和低HDLC水平,血脂水平的增高可能与SLE患者中胆固醇外流率增加有一定的关系,但HDLC结构和功能上的变化对SLE患者胆固醇外流的影响及机制尚需要进一步的研究。
国内外学者对ABCG1在胆固醇外流及动脉粥样硬化中的研究结果不完全一致,近年有研究证实PPARγ表达与激活和胆固醇的外转运密切相关,可以促进ABCG1的表达上调,从而抑制泡沫细胞的形成,具有抗动脉粥样硬化的作用[18]。一项PPARγ改善结核分枝杆菌通过ABCG1依赖性胆固醇外流途径诱导泡沫细胞形成的研究表明PPARγ通过调节ABCG1表达参与改善泡沫状巨噬细胞形成[19]。因此,关于ABCG1介导的胆固醇外流途径在机体抗动脉粥样硬化疾病中特别是在心血管并发症高发的SLE等自身免疫性疾病中的功能及作用机制都需要进一步的深入研究,从而为临床SLE等自身免疫性疾病中心血管合并症高发提供良好的理论基础和诊断、治疗依据。

