1例输入性新冠无症状感染者核酸检验结果分析
吴 剑 龚 虹 黄振东 徐 媛 江艳萍 黄 冠 支林俊 黄国青
邵武市立医院 1 检验科 2 神经内科,福建省邵武市 354000
新型冠状病毒(SARS-CoV-2)引发的新型冠状病毒肺炎(COVID-19)疫情,使全世界深陷其中已两年有余。我国实行严格的“清零”政策,各地虽时有零星疫情发生,但也很快被消灭,但境外人员入境的疫情防控较难管理。2021年11月15日,本实验室1例隔离点“双采双检”新冠核酸检测标本的检验结果与市疾控中心结果不一致,后经标本交叉复查以及重采标本后复查,判定此患者鼻咽拭子新冠核酸检验结果为“阳性”,现将情况报告如下。
1 材料与方法
1.1 样本来源 患者男性,2021年10月18日入境,就地集中隔离观察,隔离期间核酸检验结果均为阴性。11月1日解除隔离后“点对点”闭环转运到本市集中隔离点进行医学观察,期间多次采样,结果均为阴性。11月15日即将解除隔离时按照“双采双检”要求[1],同时采集鼻咽拭子两管,分别送本市疾控中心与本实验室。(1)样本A1:送市疾控中心的样本。(2)样本A2:送本实验室的样本。(3)样本B:重新采集的双侧鼻咽拭子合并成一管的样本。
1.2 核酸提取 鼻咽拭子置于含胍盐的病毒保存液(浙江康康医疗器械股份有限公司,批号:批210301)中,震荡60s后取200μl样本用核酸提取试剂(中元汇吉生物技术股份有限公司,批号:5108101)在核酸提取仪(山东博科BK-HS32)上经17min提取后获得50μl的RNA溶液。
1.3 核酸扩增
1.3.1 扩增试剂1:某公司生产的新型冠状病毒2019-nCoV核酸检测试剂盒,批号:5109014,最低检测限200copies/ml。本产品设有外源性内标,按试剂说明书配制反应体系,反应程序:37℃ 1min;50℃ 5min;95℃ 2min;95℃ 5s;60℃ 30s;(48个循环),在 60℃进行荧光检验,荧光检验通道选择 FAM/ROX/VIC,passive reference选择 NONE。提取出的核酸放在苏州雅睿实时荧光定量PCR仪(型号MA-6000)上进行扩增。新冠病毒基因N和ORF1ab与内标阳性判断值为<40。
1.3.2 扩增试剂2:另一品牌公司生产的新型冠状病毒2019-nCoV核酸检测试剂盒,批号:2021099,最低检测限500copies/ml。本试剂盒同时包括内源性内标检测系统,本试剂盒同时包括内源性内标,按试剂说明书配制反应体系,反应程序:50℃ 2min;95℃ 2min;95℃ 5s;60℃ 35s;95℃ 5s;60℃ 35s;(44个循环),荧光检验通道选择 FAM/VIC/CY5,新冠病毒基因N、ORF1ab与内标阳性判断值为<30。
1.3.3 核酸扩增仪:苏州雅睿实时荧光定量PCR仪,型号MA-6000。
以上采样管、提取仪、提取试剂、扩增仪、扩增试剂组成的检测体系均已通过性能验证实验。
2 结果
第一次采样(双采双检),本实验室标本(A2)提取两次,中元汇吉试剂扩增两次,N基因与ORF1ab基因未检验到荧光扩增信号,判定结果为“阴性”。但“双采双检”送至市疾控中心的标本(A1)检验结果却为“可疑阳性”。这一情况引起了双方实验室的高度重视,紧急通知隔离点重新采集标本(B)送本实验室,并将标本A1转运至本实验室,A1与B同时用中元与达安两种扩增试剂复核,另将标本A2用达安试剂复核。每份标本提取两次,扩增两次。复查A1的结果是:达安基因扩增为“可疑阳性”;中元汇吉扩增结果为“阳性”;标本A2用达安扩增,N基因与ORF1ab基因及内标均未检测到荧光扩增信号;标本B,用以上两种扩增试剂并行检测结果均为“阳性”。见表1。
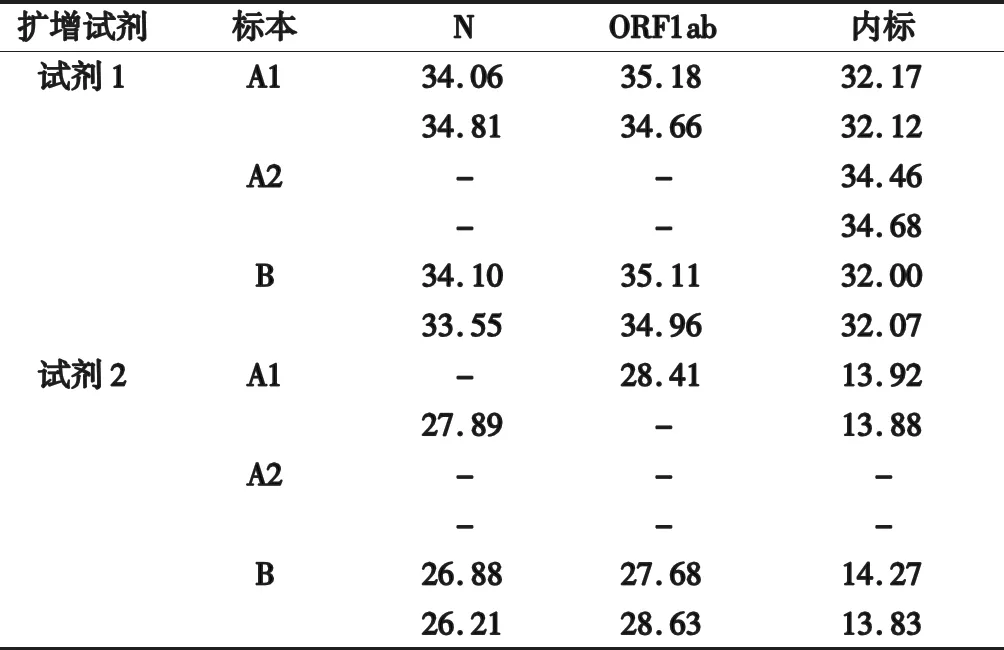
表1 本例无症状感染者鼻咽拭子各标本相关基因核酸检验CT值
3 讨论
SARS-CoV-2与宿主易感细胞表面的ACE2受体结合从而侵入机体[2],其结合的方式与SARS-CoV相似,但亲和力却比SARS-CoV强10~20倍[3],证明了SARS-CoV-2具有比SARS-CoV更强的传染性与致病性。且SARS-CoV-2属于RNA病毒,相比DNA病毒,其单链结构更易发生变异[4]。我国将COVID-19归为乙类传染病,但采取甲类传染病的预防、控制措施[5]。WHO推荐的识别SARS-CoV-2感染病例的方法是新型冠状病毒核酸检验[6],此方法也是目前我国新冠疫情防控重要且有效的手段。
新冠核酸检测试剂盒内通常包含内标基因用以避免因标本不合格、核酸提取失败或扩增失败等原因而造成“假阴性”问题[2]。内标基因与标本同时进行提取与扩增,如果实验完成后内标基因未扩增出曲线,则实验失败,需重做并分析查找原因。内标基因通常分为外源性与内源性两类:外源性内标是在试剂配制时加入待测标本中的假病毒核酸片段,能有效监测核酸提取与扩增的全过程,但无法监测标本采样是否合格;内源性内标是人体各组织细胞自带的基因片断,故内源性内标可监测到标本是否合格,但因内源性内标和靶核酸提取效率不尽相同,所以内源性内标不一定能监测到提取过程存在的问题。综上,此二类内标各有优劣。本例无症状感染者第一次“双采双检”时,送到本实验室的鼻咽拭子标本A2用含有外源性内标的扩增试剂1检验,结果为“阴性”,但用含能监控采样质量的内源性内标的扩增试剂2复查时,内标基因未起荧光扩增曲线,推断此份标本采样不合格。如未对此例患者的A2标本进行不同品牌的含不同类型内标试剂复核,则极大可能造成漏检,说明对高风险人群及“可疑”结果的样本,需用不同品牌的试剂交叉复查,才能最大限度保证不漏检。有研究表明鼻咽拭子较口咽拭子阳性率高[7],但鼻咽拭子的采集难度较大,且因不适感更强或者心理抗拒而导致被采者依从性更低。在一份经验交流中提到[8]鼻咽拭子采集前需与被采者做好充分的沟通,以减轻被采样者的恐惧感,提高依从性,且在采样时要注意“触、停、转”等的操作技巧,以保证标本质量。在充分认识到标本质量的重要性后,重新采集的鼻咽拭子B,经三家实验室(本实验室、市疾控中心与地区疾控中心)共同复核,均为“阳性”结果,证明了标本质量是新冠核酸检验质量保证的重要影响因素之一。
另外,在复检A1标本时,检测限更低的扩增试剂1(200copies/ml)能够把靶核酸的ORF1ab基因与N基因完全扩增出来,而扩增试剂2(最低检测限500copies/ml)仅能得出“可疑”的结果。基于目前国内外均无SARS-CoV-2核酸定量的标准品,国内获批的SARS-CoV-2核酸检验试剂均为定性试剂,则在判断试剂检测灵敏度时,最低检测限是一项尤为重要的指标[9]。有文件[10]建议在新冠核酸检验时选用高灵敏的、最低检测限≤500copies/ml的扩增试剂。特别是对于新冠无症状感染者或弱阳性患者,高灵敏的检验试剂能避免漏检,并更迅速地发现阳性患者而采取有效的隔离与治疗措施。有文件[1]指出当标本初次检测结果为阳性时,应使用另外更加灵敏的试剂对原始标本进行复核后再发报告,以尽量避免检验质量问题的发生。
新冠核酸检验结果阳性是 COVID-19 确诊的金标准,因此,每一份新冠核酸检验报告的质量不容轻视。本市自新冠疫情发生以来无1例本土病例,且此例患者在隔离期间多次核酸检测均为“阴性”结果,如果此次未“双采双检”,则很有可能发生“漏检”的严重事故。为保证新冠核酸检验质量,除了做好室间质量评价与室内质控外,还应该注意检验全流程的质量管理,特别是合规的采样以及对高风险人群、“可疑”结果的标本需进行不同品牌试剂的交叉复核。

