基于实验和密度泛函理论的NaHCO3 吸附SeO2 机理研究
李岩松,邓双,胡红云,董璐,黄永达,邹潺,吴诗勇,4,*
(1. 华东理工大学 能源化工系,上海 200237;2. 中国环境科学研究院,北京 100012;3. 华中科技大学 煤燃烧国家重点实验室,湖北 武汉 430074;4. 宁夏大学 煤炭高效利用与绿色化工国家重点实验室,宁夏 银川 750021)
近年来,随着中国城市化和工业化的快速发展,危险废物的产生量越来越多,数据显示,中国的危险废物产生量从2010 年的1587 万吨增长至2020 年的7281 万吨,且增长速率越来越快[1]。焚烧是危险废物处理的重要方式,随着中国对生态环保的日益重视,对危废焚烧厂的烟气污染物排放限制也愈加严格。单一脱酸工艺无法满足日益严格的排放标准,危废焚烧厂逐渐采用干法与湿法结合的工艺,实现烟气污染物的超低排放。常见的干法脱酸药剂有钙基吸附剂(CaO 和Ca(OH)2等)和钠基吸附剂(NaHCO3),其中,钙基药剂脱酸效率较低[2,3],为实现危废焚烧烟气污染物的超低排放,需成倍增加钙基吸附剂的消耗,导致飞灰产量增加以及布袋糊袋加重等问题,此外生成难溶性的CaClOH 会限制飞灰的资源化利用[4]。NaHCO3作为一种常见的干法脱酸吸附剂,在确保脱酸效率的同时[5],避免了钙基吸附剂带来的一系列问题,逐渐被一些危废焚烧厂所使用[6]。
除了酸性气体污染物,对人体健康和环境危害极大的重金属也逐渐受到广泛关注。在危险废物焚烧过程中,硒作为易挥发性重金属,通常以SeO2(g)的形式存在于烟气之中,虽然可以通过物理吸附和化学吸附的形式富集在飞灰颗粒上进而被除尘装置捕集[7],但由于其饱和蒸气压较高,硒仍主要以气态形式存在,难以被常规烟气净化装置捕集,进而易排放进入大气[8]。排放至环境中的硒可通过呼吸道、消化道和皮肤接触等方式进入人体,进而造成慢性中毒。其主要表现为上呼吸道刺激症状、牙齿釉质破坏以及关节病变等[9,10]。由于重金属Se 与S 同族,具备相似的化学性质,因此,NaHCO3可能也具有吸附SeO2的潜力,在脱酸的过程中协同脱除重金属硒对实现污染物超低排放意义重大。
目前,对于SeO2的吸附主要以钙基吸附剂为主。于梦竹等[11]研究了CaO 和CaCO3对SeO2的吸附特性,发现CaCO3热分解为CaO 后吸附SeO2效果比CaO 更好,归因于CaCO3热分解产生的CaO 活性更强。Yuan 等[12]进一步发现,300-900 ℃温度下CaO 对SeO2的吸附性能,随着温度的上升,呈现先增加后减小的趋势,在700 ℃时CaO 对SeO2的吸附能力最强。进一步地,一些学者对钙基吸附剂捕集SeO2的反应机理进行研究。Ghoshdastidar等[13]通过XRD 表征发现,石灰石吸附SeO2的产物主要为CaSeO3;Fan 等[14]通过基于密度泛函理论的量化计算模拟发现,CaO 表面O 原子是CaO吸附SeO2过程中的活性位点;Yuan 等[15]通过基于密度泛函理论的量化计算模拟研究了Ca(OH)2吸附SeO2的机理,发现Ca(OH)2表面的O 原子是吸附的活性位点,在产生最终产物CaSeO3的过程中有中间产物Ca(HSeO3)OH 的产生。因此,可以看到硒吸附过程复杂,钙基吸附剂吸附气相SeO2的研究已经很详尽,但是钠基吸附剂对SeO2的吸附特性及机理还有待研究。深入解析NaHCO3的硒吸附性能和吸附机制,有助于通过钠基吸附剂高效控制重金属硒污染。
为了明确NaHCO3对SeO2的吸附特性及吸附机理,通过实验以及基于密度泛函理论的量子化学计算结合的方法,探究了温度对于NaHCO3吸附SeO2效果的影响、NaHCO3的自身热分解行为和硒吸附产物形态,掌握了温度对于NaHCO3吸附SeO2的影响方式以及吸附的机理,进而为后续脱酸塔中脱除酸性气体的同时,协同脱除气相SeO2的研究提供了理论基础,对危废焚烧厂控制重金属硒污染提供了理论指导。
1 材料与方法
1.1 实验部分
1.1.1 实验样品
实验所用的碳酸钠(NaHCO3)、二氧化硅(SiO2)、盐酸和硝酸购自国药集团化学试剂有限公司,其中,NaHCO3和SiO2为分析纯,盐酸和硝酸为优级纯。SeO2购自山东西亚化学股份有限公司,纯度为分析纯。
1.1.2 吸附实验
使用管式炉搭建用于吸附SeO2的固定床实验台架,如图1 所示,台架分为两个部分,即SeO2发生段和SeO2吸附段。在SeO2发生段,载气与雾化后SeO2水溶液均匀进入反应装置,SeO2的输入量为0.16 mg/h。SeO2水溶液在400 ℃下快速蒸发后升华成为SeO2(g)。在SeO2吸附段,预热到指定温度(140、180 和220 ℃),将样品放入,稳定1 min以确保样品的温度趋于吸附温度后,进行10 min的吸附实验。气氛条件为79% N2、6% O2及15%H2O,每组实验至少重复三次,以确保可重复性。
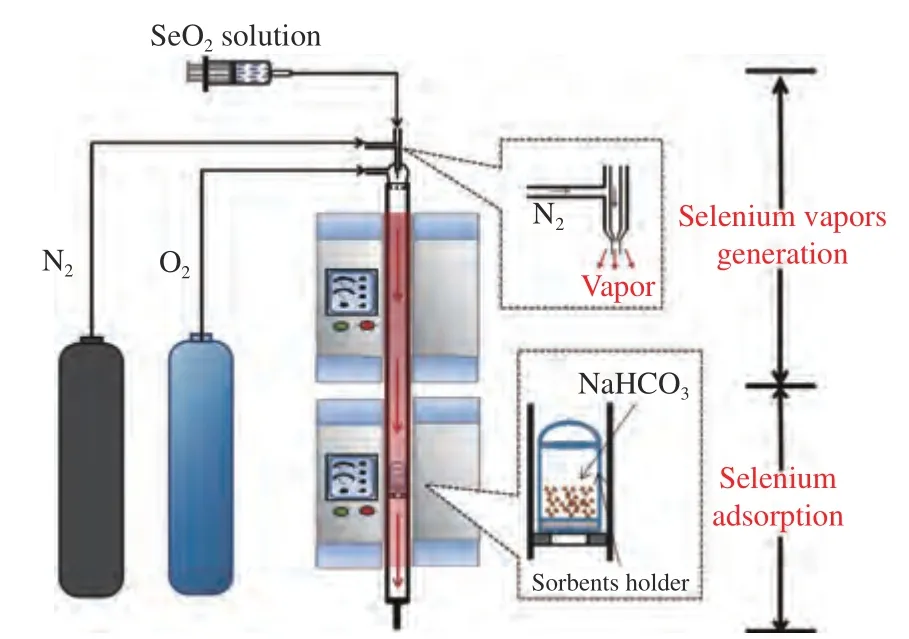
图1 吸附实验装置示意图Figure 1 Schematic diagram of the adsorption experimental setup
1.1.3 样品表征
使用体积比9∶1 盐酸和硝酸的混合体系对吸附产物进行石墨消解,消解温度80 ℃,时长2 h,使Se 保留在液态消解液中,稀释一定比例后,通过原子荧光光度计(AFS,北京吉天仪器有限公司8220)对产物中总硒进行测定。NaHCO3热失重分析通过同步热分析仪(STA,Netzcsh 449F3,氮气气氛,升温速率50 ℃/min)测定。反应前后样品的微观形貌通过扫描电子显微镜(SEM,卡尔蔡司Sigma300)进行观察。热分解反应前后的微孔面积和孔径通过比表面积与孔径测定仪(BET,Micromeritics ASAP 2020,氮吸附,77 K)进行测定。形态和价态的测定可以将吸附产物与SiO2以质量比1∶7 的比例混合,置于350 ℃的管式炉中煅烧1 h[16],将脱附后的产物消解后(8∶2 硝酸和氢氟酸)部分以1∶1 的比例用盐酸还原。由于NaHCO3受热易分解,导致吸附后的质量相差较大,为了统一相同质量标准便于探究NaHCO3的吸附性能,单位质量NaHCO3吸附的硒含量通过式(1)进行计算:

式中,β为单位NaHCO3吸附的硒含量;β*为吸附硒测试量;m*为吸附后产物的质量;m为吸附前NaHCO3的质量。
1.2 计算部分
1.2.1 晶胞参数
根据后续对吸附机理探究的实验结果可知,NaHCO3热分解反应后生成Na2CO3,因此,以Na2CO3晶胞构建周期性吸附模型。在本研究的吸附温度范围内,Na2CO3单斜晶系形式存在[17](如图2(a)所示)。其参数为:α=β=90°,γ=120°,a=0.5273 nm,b=0.5273 nm,c=0.6402 nm。根据蔡天意[18]的研究,Na2CO3(001)表面相较于(010)、(111)、(100)、(011)、(101)以及 (110)等表面,具备最低的表面能,是单斜Na2CO3晶体最易断裂形成的表面,所以选择(001)表面作为吸附表面更为合理。SeO2优化后键角为115.378°,键长为0.1615 nm。
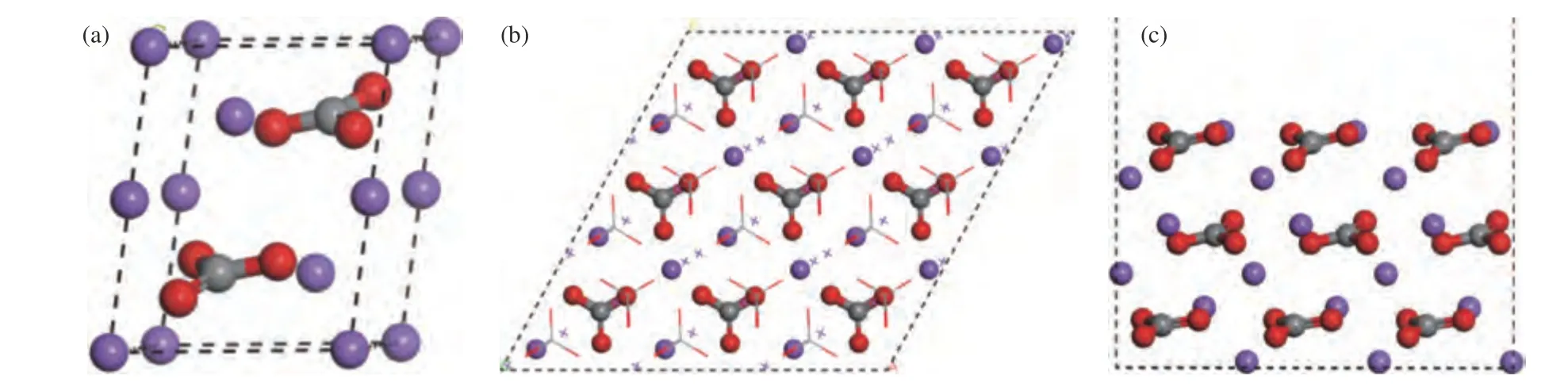
图2 Na2CO3 原胞和Na2CO3(001)模型Figure 2 Na2CO3 proto-cell and Na2CO3(001) models (Red: O;Gray: C;Purple: Na)
1.2.2 计算参数
本研究计算采用Material studio 软件中的CASTEP模块进行计算优化。构建了三层周期性的Na2CO3(001)模型(如图2(b)和(c)所示,其中,(b)为俯视图,(c) 为主视图)。截断能设置为350 eV,k 点设置为2×2×1。BFGS 算法中的结构优化标准为:自洽场精度收敛标准为10-6eV/atom;能量精度收敛标准为10-5eV/atom;最大位移为5×10-4nm;最大力收敛标准为0.5 eV/nm;最大应变收敛精度为0.05 GPa。
1.2.3 吸附能
吸附能即吸附前后物质总能量的变化,其值表示了吸附能力的强弱,可通过公式(2)进行计算:

其中,Etotal为吸附后总能量,Eslab为吸附前Na2CO3(001)体系的能量,Emolecule为吸附前被吸附物质(SeO2)的能量。当Eads为负值时表示吸附反应可以发生,且数值越大吸附能力越强。通常-30 kJ/mol<Eads<-10 kJ/mol 时,认为发生物理吸附,-960 kJ/mol<Eads<-50 kJ/mol 发生化学吸附[19]。
2 结果与讨论
2.1 吸附本质与产物分析
单位质量NaHCO3对SeO2的吸附能力如图3所示,在140-220 ℃,随着温度的升高,NaHCO3对SeO2的吸附能力得到显著增强,在220 ℃下NaHCO3对SeO2的吸附量最高,可达到171 mg/kg,是140 ℃下吸附量的4.6 倍左右。温度促进NaHCO3吸附SeO2的原因,一方面可能是温度通过改变物质组成,受热反应后产生的物质从单一的物理结构、化学性质或者两方面共同促进了与SeO2的反应;另一方面可能是温度升高从热力学角度促进了SeO2吸附反应的自发趋势。
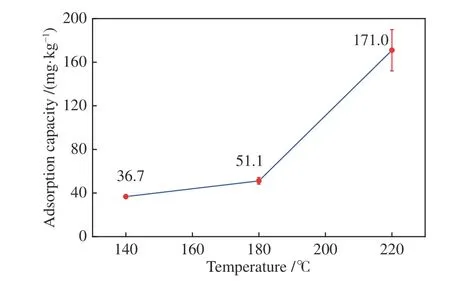
图3 不同温度下NaHCO3 对SeO2 的吸附量Figure 3 Adsorption capacity of NaHCO3 on SeO2 at different temperatures
因此,通过热重分析判断是否发生物质的变化,若发生物质的变化,则从物理结构变化及化学反应趋势变化两个角度对温度促进吸附的现象进行解析。NaHCO3热稳定性差[20],受热会发生分解反应,吸附剂化学性质的改变会直接影响吸附效果。为了探究NaHCO3在不同吸附温度下是否发生物质变化,对NaHCO3进行热重分析,由图4 可知,NaHCO3在105 ℃开始分解,在155 ℃下分解速率最快,180 ℃分解完全,发生的反应如式(3)所示。结果表明,在吸附过程中吸附剂以NaHCO3和Na2CO3两种形式共存。为了探究在吸附过程中,热分解反应产生的物质变化对于吸附能力的影响,将稳定时间延长至20 min 以确保NaHCO3更多地向Na2CO3转化,将延长吸附时间得到的产物命名为NaHCO3-TD(Thermal decomposition),并在同等条件下进行吸附实验,测定热分解前后吸附硒总量并与稳定时间1 min 的产物测定的硒总量进行对比。由图5 可知,延长热分解反应后,NaHCO3对于SeO2的吸附量明显高于延长热分解之前,这说明热分解后产生的Na2CO3对SeO2具备更强的吸附能力。为了解释热分解后产生的Na2CO3对SeO2吸附能力更强的现象,从物理结构以及化学反应热力学的角度进行进一步的分析。
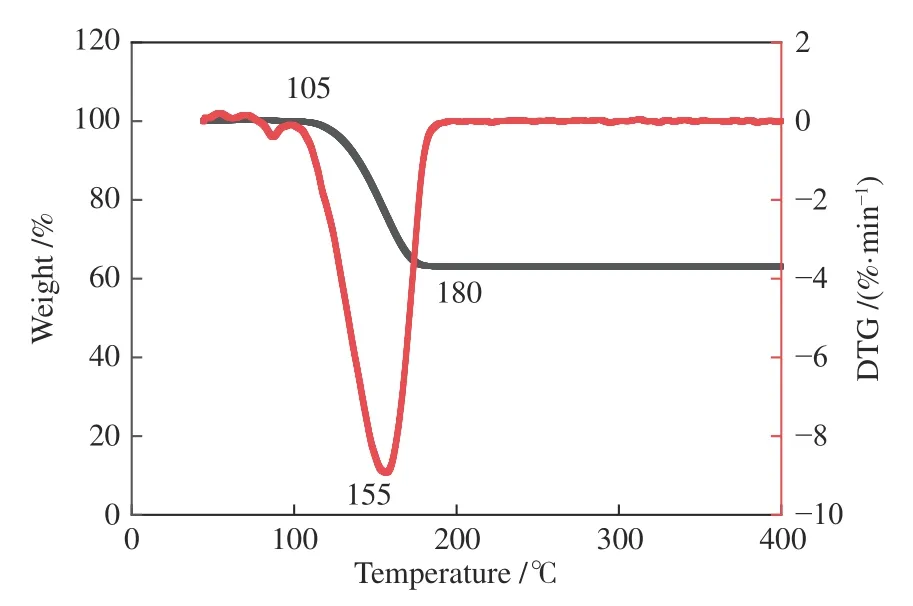
图4 NaHCO3 的热重曲线Figure 4 Thermogravimetric curve of NaHCO3
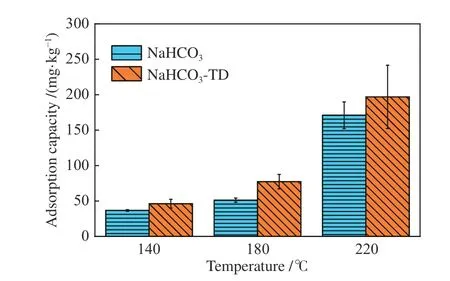
图5 热分解前后对SeO2 的吸附能力Figure 5 Adsorption capacity for SeO2 before and after thermal decomposition
为了探究热分解前后NaHCO3表面的微观变化,对充分热分解前后的样品进行扫描电镜分析,如图6 所示。通过对比可知,热分解前的NaHCO3表面相对光滑,没有明显的孔结构,而热分解之后的产物表面凹凸不平,具备明显的孔结构。对不同温度下充分热分解产生的样品进行比表面积及孔分析(不同温度下热分解后产生的Na2CO3命名为Na2CO3-R,其中,R为对应的热分解温度),结果如表1 所示。结果表明,随着温度的升高,分解后的Na2CO3的比表面积随之增大,孔径减小,孔体积增大,在220 ℃下热分解的产物比表面积升至热分解前的20 倍左右,孔体积增至原来17 倍左右。这说明热分解后的产物可以为吸附提供更多的空间,增加吸附的位点,因而获得更高的反应活性,且温度越高扩孔效果越好,更有利于吸附[21-23]。
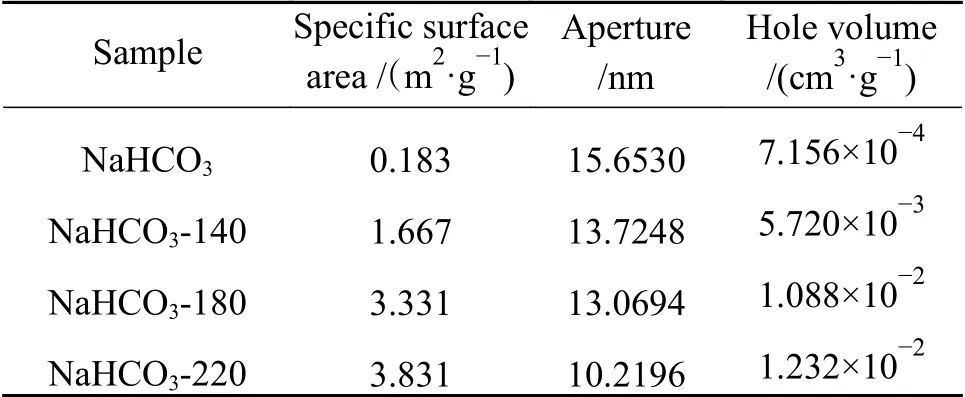
表1 比表面积及孔结构分析Table 1 Specific surface area and pore analysis

图6 热分解前后NaHCO3 的SEM 照片Figure 6 SEM images of NaHCO3 before and after thermal decomposition
通过扫描电镜和比表面积分析可知,温度升高会通过改变物理结构的方式促进NaHCO3对于SeO2的吸附,但是没有考虑到温度升高对于反应发生趋势的影响,因此,通过HSC 软件对NaHCO3和Na2CO3吸附SeO2进行了热力学计算,如图7 所示,在式(4)和(5)的反应中,吉布斯自由能随着温度的升高而降低,即从化学反应的热力学角度,温度升高会促进两种物质与SeO2的反应,结果表明,温度不仅从改变物质结构上促进吸附反应的发生,同时也会促进反应自发的趋势。
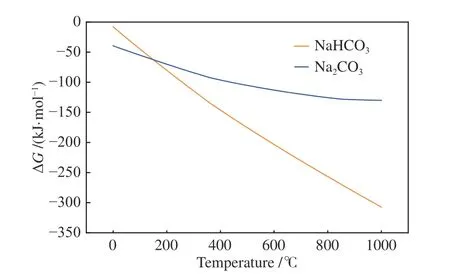
图7 NaHCO3 和Na2CO3 吸附SeO2 的热力学计算Figure 7 Thermodynamic calculations of SeO2 adsorption by NaHCO3 and Na2CO3
为了进一步确定吸附方式,对吸附产物进行脱附实验来测定硒在吸附产物的存在形式,脱附前后以及脱附还原后的硒总量并进行对比。由图8可知,吸附产物中几乎没有以物理吸附形式存在的SeO2,产物主要以Se4+为主,即Na2SeO3为主要的吸附产物。
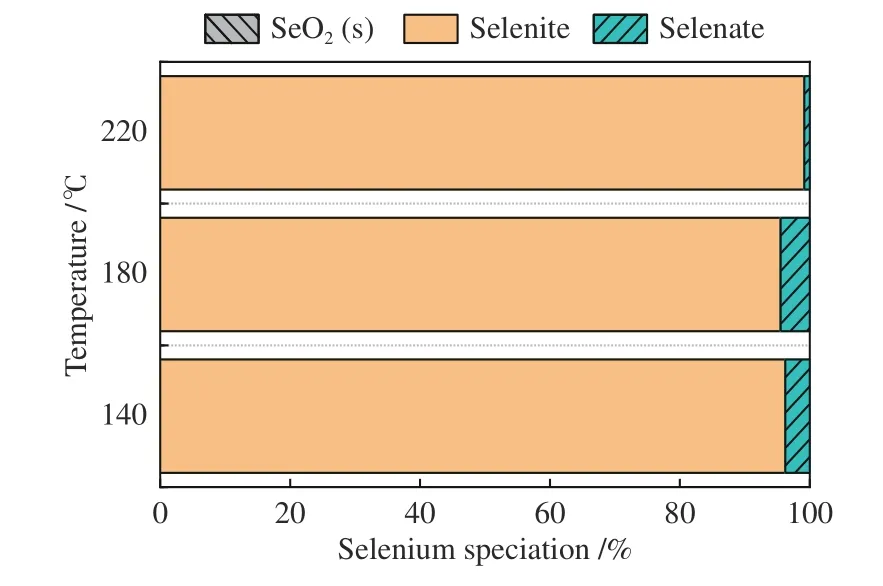
图8 吸附产物中Se 的形态及价态分布Figure 8 Morphology and valence distribution of Se in adsorption products
综上可知,温度升高会促进NaHCO3吸附SeO2的反应,且温度越高促进效果越明显。一方面,从物理结构的角度,温度的升高促进了NaHCO3分解为Na2CO3,热分解产生的Na2CO3具备更好的孔结构和更高的反应活性,促进了吸附过程;另一方面,从热力学角度,温度的升高会使吉布斯自由能的负值增大,促进反应的自发趋势[24]。通过价态分析实验可以确定,NaHCO3吸附SeO2的产物以Na2SeO3为主,发生如下反应,且以反应(5)为主导。

2.2 吸附点位及成键分析
为了更好地实现对于SeO2的控制,从微观方面对反应位点及机理进行探究。因此,通过密度泛函理论从分子角度对吸附过程进行解析。SeO2在Na2CO3(001) 表面的吸附考虑三种吸附位点:Osurftop 位、空位vacancy 以及Na top 位,每种吸附又考虑了平行与垂直底物平面两种方式。共建立六种吸附构型并计算其对应的吸附能,优化后的结构及吸附能如表2 所示。
通过对比表2 中各种构型的吸附能可知,构型(a)在六中构型中吸附能最大,为-127.529 kJ/mol,说明SeO2在Na2CO3(001)表面的吸附位点为表面的O 原子,且吸附过程属于很强的化学吸附。

表2 SeO2 在Na2CO3(001)表面的吸附构型及吸附能Table 2 Adsorption configuration of SeO2 on the surface of Na2CO3(001) and adsorption energy(Red: O;gray: C;purple: Na;orange: Se)
为了进一步研究SeO2在Na2CO3(001) 表面的作用机理,对构型(a)的总电荷密度分布和分态密度进行了分析。图9 为构型(a)的电荷分布密度,从图9 中可以看出,Se 原子和Osurf原子的电子发生一定程度的离域化,两原子的电子云发生重叠,存在电子重新组合,Se 原子与Osurf原子的距离缩短至0.242 nm,SeO2分子中靠近Osurf原子的Se-O 键由原来的0.1615 nm 增至0.1626 nm,Osurf原子的C-O 键的键长由原来的0.1303 nm 增至0.1322 nm,同一碳酸根中的其他两个C-O 键均有缩短,这说明SeO2与Na2CO3(001)表面的O 原子具有明显的成键作用[18],即SeO2在Na2CO3表面发生了化学吸附。图10 为几何优化后构型(a)中SeO2和Na2CO3(001)表面在吸附SeO2之前和之后的分态波密度(PDOS)光谱,描述了吸附前后电子状态的变化。对比吸附前后Se 的PDOS 光谱,多处峰值均有减小,说明反应后的Se 更加稳定,s轨道在-7.8 eV处分裂出一个峰,p轨道分裂成三个峰,分别在-7.8、-6.2 和-5.7 eV 处。对比吸附前后Osurf的PDOS 光谱,s轨道在-20.1 和-4.0 eV 处分裂出两个峰,p轨道在-10.3 和-4.0 eV 处分裂出两个峰。对比吸附后Se 原子和Osurf原子的PDOS 光谱可以看到,吸附后Se 原子新增的峰与Osurf原子的峰有所重合,同时吸附后Osurf原子新增的峰与Se 原子的峰亦有所重合,在大约-20.1 eV 处存在Se 和O 原子s轨道的共振峰,在大约-10.3、-7.8、-6.2 以及-4.0 eV处存在Se 和O 原子p轨道的共振峰,这说明吸Se 和Osurf之间存在很强的相互作用[25]。结果表明,Se 原子和O 原子之间存在强烈的轨道杂化,原子之间存在强烈的相互作用。Se 原子与表面O 原子之间形成Se-O 键,表面O 原子是Na2CO3(001)表面吸附SeO2的活性中心。
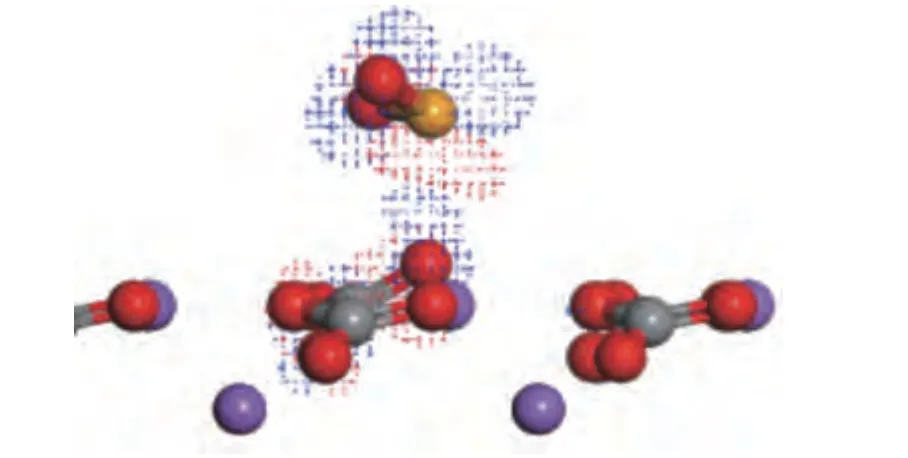
图9 SeO2 在Na2CO3(001)表面吸附的电荷密度分布Figure 9 Charge density distribution of SeO2 adsorbed on the surface of Na2CO3 (001) (red: O;gray: C;purple: Na;orange:Se;blue area: gain electrons,red area: lose electrons)
3 结论
本研究采用实验与密度泛函理论计算结合的方式,从反应物、产物以及分子角度详细地探究了NaHCO3吸附SeO2的反应机理。研究结果表明:
在140-220 ℃,随着温度的上升,NaHCO3对SeO2的吸附作用随之增强,220 ℃时NaHCO3对SeO2的吸附效果有显著的增强。
温度促进NaHCO3吸附SeO2的原因分为两方面,一方面从物理结构的角度,吸附过程伴随着热分解反应的发生,热分解后产生的Na2CO3具有更丰富的空隙结构,更多的反应位点,具备更高的反应活性;另一方面从化学反应趋势角度,温度的升高促进了NaHCO3/ Na2CO3与SeO2反应自发的趋势。
Na2CO3(001)表面的O 原子是吸附反应的活性位点,SeO2的Se 原子与Na2CO3(001)表面的O 原子在接触的过程中会发生电荷的迁移,形成Se-O 键。

