番茄脱落酸受体PYL基因家族全基因组鉴定及表达分析
王傲雪,孟令君,陈秀玲,莫福磊,吕 瑞,薛小棚,孟凡越,齐浩楠,张珍珠
(1.东北农业大学园艺园林学院,哈尔滨 150030;2.东北农业大学生命科学学院,哈尔滨 150030;3.齐齐哈尔大学生命科学与农林学院,黑龙江 齐齐哈尔 161006)
番茄(Solanum lycopersicum)原产自南美洲,是典型一年生或多年生草本植物,含有丰富营养物质,在我国广泛栽培。低温、干旱和盐害等不适宜生长的环境制约番茄生产,通过分子手段发掘番茄抗逆优质基因并对其进行功能研究是解决这一难题的可行办法。
PYL(PYR/PYL/RCARs)是目前已知最大的植物激素受体基因家族,主要功能是识别ABA信号并启动信号传递,在ABA信号转导途径中位于最上游部位,是ABA信号转导启动者[1]。PYL家族基因编码蛋白具有一个保守的疏水配体结合域,可与ABA特异性结合,参与ABA信号转导响应非生物胁迫[2]。经典的ABA信号通路模型表示,在ABA缺失或者含量极低时,PYL蛋白不与2C型蛋白磷酸酶(PP2Cs)结合,从而激活PP2Cs磷酸酶活性,导致SnRK2s无法启动下游因子表达[3];当植物遭受逆境胁迫时,其体内ABA含量迅速上升,PYR/PYL/RCARs抑制PP2Cs和SnRK2s之间相互作用,阻止PP2C去磷酸化SnRK2s,导致SnRK2s激活下游靶基因表达[4]。
目前PYL基因家族已相继在拟南芥(Arabidopsis thaliana)[5]、玉米(Zea mays)[6]、水稻(Oryza sativa)[7]、大豆(Glycine max)[8]等物种中得到鉴定。水稻中OsPYL5在正常生长条件下诱导逆境胁迫响应基因表达,提高植株耐旱耐盐性[9]。拟南芥中AtRCAR12和AtRCAR13基因既参与高温胁迫应答同时也响应低温胁迫,在高温胁迫下两个基因过表达诱导热激蛋白表达,提高植株应对高温胁迫的能力;低温胁迫下,两个基因可诱导低温响应转录因子CBFs表达,提高植株应对低温胁迫能力[10]。番茄中PYR/PYL/RCAR家族均以ABA依赖方式不同程度抑制PP2C活性,且具有增强植物抗旱性的作用[11]。
本研究利用生物信息学手段,综合分析番茄PYL基因家族生物学特征和表达模式,利用实时荧光定量PCR技术进一步明确6个番茄PYL基因在不同处理条件下表达情况。本研究将为PYL基因对番茄逆境胁迫响应方面的研究提供理论参考。
1 材料与方法
1.1 植物材料培养
番茄品种Ailsa Craig(AC)由东北农业大学园艺生物技术实验室提供,选取颗粒饱满种子浸种12 h后直接播种于栽培基质(蛭石∶基质土为1∶1)中。播种后将营养钵置于光周期为16 h/8 h(昼/夜)、温度为22℃、湿度为60%植物培养箱中。
1.2 植物材料胁迫处理
当番茄幼苗生长至五叶一心时,对番茄幼苗进行非生物胁迫及激素处理。分别在处理0、1、6、12、24和48 h时取顶端生长点下第二片完全展开真叶100 mg,液氮速冻后放置于-80℃冰箱中,用于后续基因表达研究。冷胁迫:培养温度为4℃;干旱胁迫:将番茄幼苗置于10%聚乙二醇(Polyethylene glycol,PEG)溶液中;脱落酸(Abscisic acid,ABA)处理:0.1 mmol·L-1ABA溶液均匀喷施于番茄幼苗表面,直至溶液即将从叶片边缘滴落;盐胁迫:200 mmol·L-1NaCl溶液均匀喷施于番茄幼苗表面,直至溶液即将从叶片边缘滴落。
1.3 番茄PYL基因家族成员鉴定与生物信息学分析
1.3.1 番茄PYL基因家族成员鉴定与序列分析
从Ensembl plants(http://plants.ensembl.org)数据库下载番茄基因组文件、蛋白质序列文件以及基因组注释文件。从Pfam数据库(http://pfam.xfam.org)中获得PYL的Pfam号PF10604,下载其隐马尔可夫模型(HMM,Hidden Markov Model)文件。使用PYL的HMM文件作为输入,使用hmmsearch(v3.3.2)软件在番茄蛋白质序列文件中进行搜索,其次,从Ensembl plants数据库下载拟南芥(A.thaliana)PYL蛋白序列,使用blastp(v2.13.0)在番茄蛋白文件中搜索,合并得到候选基因ID,提取候选基因蛋白质序列,提交至Pfam、CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml和SMART(http://smart.embl-heidelberg.de)数据库进行结构域确认,得到确定的番茄PYL基因。
1.3.2 番茄PYL基因家族成员染色体定位分析
在番茄基因组注释文件中,获得番茄12条染色体长度信息以及所有番茄PYL基因在染色体上位置信息,同时TBtools(v1.098765)用于绘制番茄PYL基因染色体定位图,表示所有番茄PYL基因家族成员在染色体上位置信息及距离关系[12]。
1.3.3 番茄PYL基因家族成员系统进化分析
在Ensembl plants数据库分别下载番茄(S.lycopersicum)、拟南芥(A.thaliana)、水稻(O.sativa)和马铃薯(Solanum tuberosum)的PYL家族蛋白质序列,使用MEGA(v7.0.26)软件绘制系统进化树。比对方法选择Clustal W,采用邻接法(Neighbor-joining method)构建系统进化树,模型选择泊松模型,boot值设置为1 000。
1.3.4 番茄PYL基因家族成员蛋白保守基序及基因结构分析
番茄所有PYL蛋白质序列作为输入文件,使用MEME(v4.12)软件分析保守基序,设置参数如下:鉴定保守基序数量为10,最小基序氨基酸长度为6,最大基序氨基酸长度为100,检索次数为10 000次。使用TBtools分析基因结构,鉴定基因上蛋白质编码区(Coding sequence,CDS)及非翻译区(Untranslated region,UTR)。最后使用TBtools对番茄PYL蛋白保守基序及基因结构进行可视化。
1.3.5 番茄PYL基因家族成员启动子区域顺式作用元件分析
提取所有SlPYL上游1.5 kb序列用于分析启动子区域顺式作用元件,提交到PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)分析顺式作用元件,使用Python(v3.8.5)程序对顺式作用元件预测结果进行统计,并使用TB-tools进行可视化。
1.3.6 番茄PYL基因家族成员共线性分析
从番茄基因组网站(https://solgenomics.net/)下载番茄基因组序列文件和基因结构注释文件,运用TBtools对番茄全基因组序列进行自身比对,分析SlPYL家族成员复制事件。从Ensembl Plants数据 库(http://plants.ensembl.org/info/website/ftp/index.html)下载水稻、拟南芥和马铃薯全基因组序列文件和基因结构注释信息文件,运用TBtools分别与番茄全基因组序列作比对,获得水稻、拟南芥和马铃薯与番茄PYL基因共线性关系。
1.4 基于转录组数据番茄PYL基因家族成员表达分析
在NCBI(National center for biotechnology information)数据库(https://www.ncbi.nlm.nih.gov/sra/)下载项目号为GSE151277转录组数据,分析番茄PYL基因在干旱和高温胁迫下表达情况,使用TBtools进行可视化。
1.5 在非生物胁迫和激素处理下部分番茄PYL基因家族成员表达分析
使用Trizol法从番茄叶片中提取总RNA,采用HiScript III RT SuperMix for qPCR试剂盒反转录成cDNA。在NCBI上设计引物用于qRT-PCR试验,引物序列如表1所示。每个反应包含10 μL ChammQ Universal SYBR qPCR Master Mix预混液,0.4 μL正向引物,0.4 μL反向引物和1.0 μL稀释cDNA样本,最后加入无菌超纯水补充到20 μL。反应条件为:95℃预变性30 s;95℃变性10 s,60℃变性30 s,共40个循环。采用2-ΔΔCt法计算相对表达量。以Slβ-Actin基因作为标准化内参,将未处理植株相对mRNA水平归一化,每个样品设3个生物重复。使用Graphpad(v9.3)进行可视化绘图,采用Excel(v16.24)软件分析qRT-PCR数据。

表1 qRT-PCR引物Table 1 Primers for qRT-PCR
2 结果与分析
2.1 番茄PYL基因家族成员鉴定及序列信息
根据Hmmsearch与Blastp结果,共确定32个候选基因,经结构域信息过滤后,得到20个番茄PYL基因家族成员,根据其在染色体上不同位置,分别将其命名为SlPYL1到SlPYL20。表2分别列出20个SlPYL基因名称、基因ID、所在染色体编号、在基因组上起始位置和终止位置、基因编码氨基酸长度、蛋白质相对分子质量和蛋白等电点等信息。该基因家族成员编码氨基酸长度分布在153~275,平均编码氨基酸长度为197.1。对应蛋白质相对分子质量为17.09~30.51 ku,平均蛋白质相对分子质量为22.10 ku。12个SlPYL基因等电点小于7,另外8个SlPYL基因大于7,整体分布在4.4~10.34。
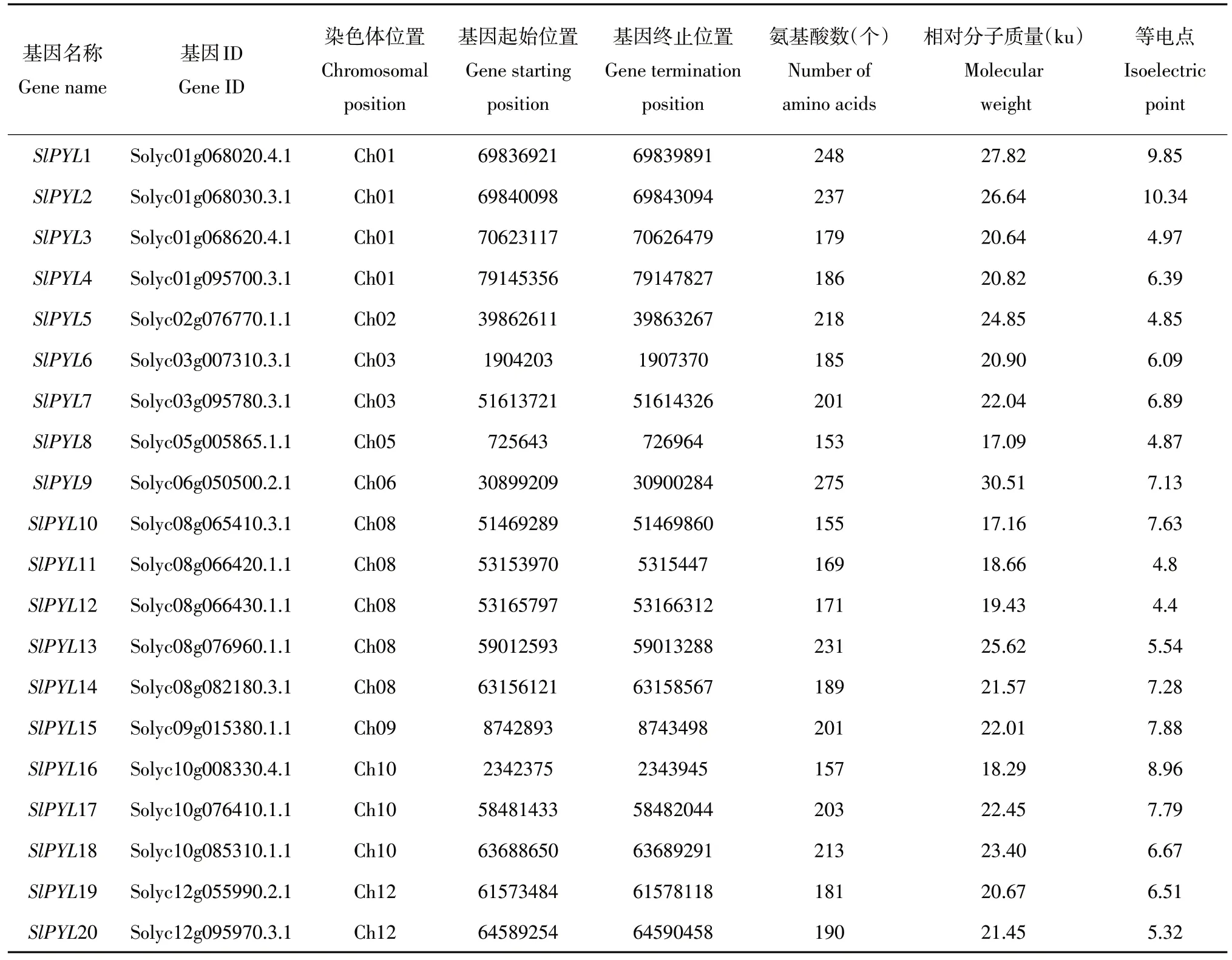
表2 番茄PYL基因家族成员信息Table 2 Information of tomato PYL gene family members
2.2 番茄PYL基因家族成员染色体定位
在番茄全基因组范围内共鉴定出20个PYL基因存在于番茄12条染色体中的9条染色体上,且分布不均匀。根据其在基因组注释文件中信息,使用TBtools可视化SlPYL在染色体位置,以展示Sl-PYL基因分布及基因间距离。如图1所示,除2、5、6和9号染色体上仅分布有1个SlPYL基因之外,1、3、8、10和12号染色体上均分布有多个SlPYL基因,且SlPYL基因在1号和8号染色体上分布较为密集。同时,也可发现SlPYL5、SlPYL7和SlPYL9位于染色体中间部分,即着丝粒附近,而其他所有SlPYL基因均分布在染色体两端远离着丝粒区域。
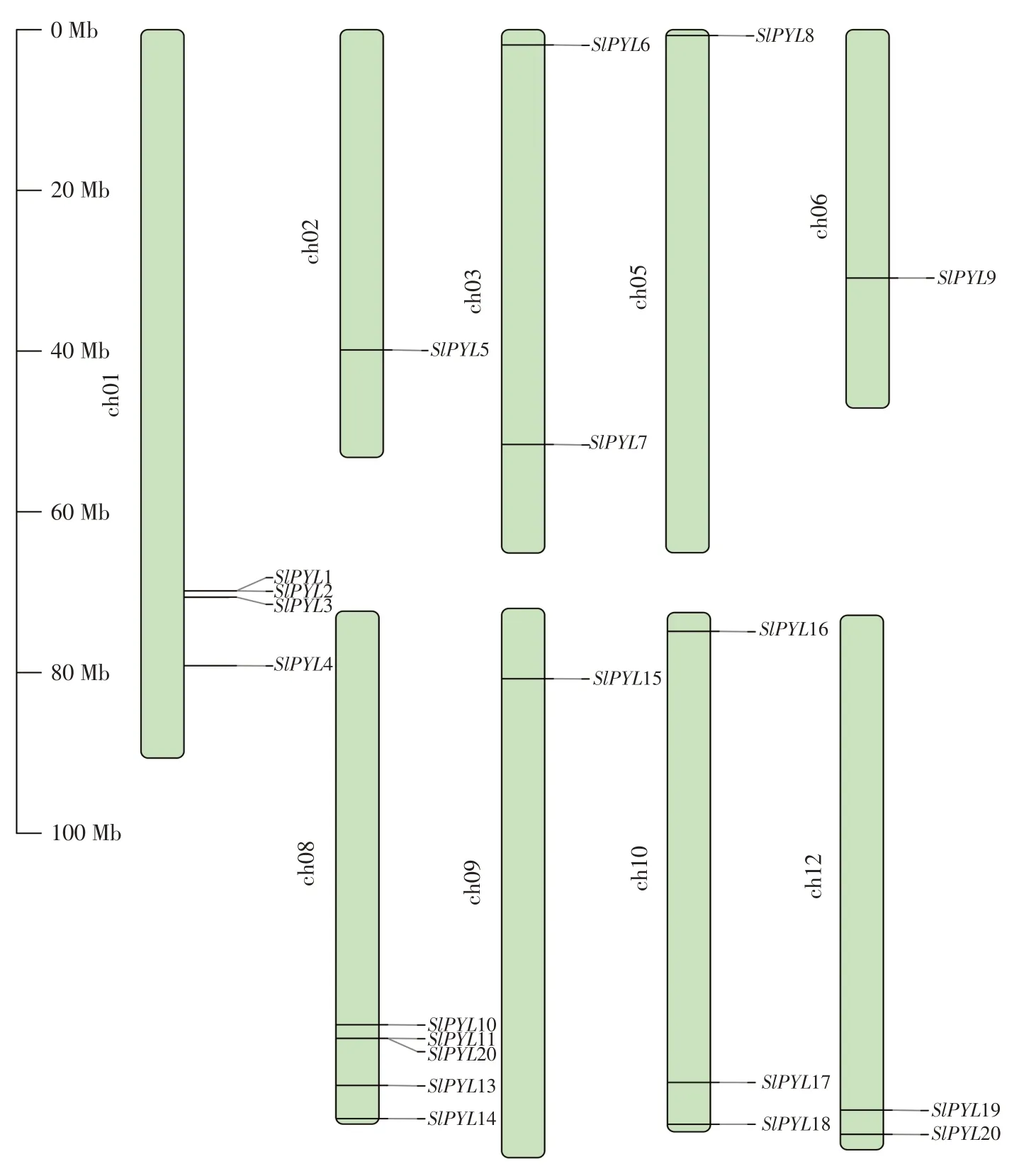
图1 番茄PYL基因染色体定位Fig.1 Chromosome mapping of PYL genes in tomato
2.3 番茄PYL蛋白系统进化关系
为探索番茄PYL蛋白系统发育关系,本研究将番茄PYL成员与马铃薯、拟南芥和水稻同源蛋白进行多序列比对构建系统发育树。如图2所示,PYL蛋白可分为3个分支(I、II和III),其中分支I包含5个SlPYL蛋白,分支II包含3个SlPYL蛋白,分支III包含12个SlPYL蛋白。另外,在分支I中,6个StPYL和2个AtPYL与5个SlPYL聚 为 一类;分 支II中,7个OsPYL和4个StPYL以 及5个AtPYL与3个SlPYL聚为一类;分支III中,5个Os-PYL和7个StPYL以及7个AtPYL与12个SlPYL聚为一类。值得注意的是,根据进化树发现分支I中包含大量SlPYL和StPYL蛋白,这表明其在进化过程中保守性较高,可能具有相似功能。

图2 拟南芥、水稻、番茄和马铃薯PYL蛋白系统发育进化树Fig.2 Phylogenetic tree of PYL proteins in Arabidopsis,rice,tomato and potato
2.4 番茄PYL蛋白保守基序及基因结构
蛋白保守基序分析发现20个番茄PYL蛋白在保守基序方面一致性较高,除SlPYL1、SlPYL2、SlPYL3、SlPYL8、SlPYL11、SlPYL12和SlPYL16外(见图3)。Motif1、Motif2和Motif3在大部分PYL蛋白上均有出现,同时这些基因存在独特的保守基序,如SlPYL3、SlPYL11和SlPYL12存在Motif8,而SlPYL1和SlPYL2存在Motif4和Motif10。基序不同排列和组合构成基因特定结构,这些特定基序分布是基因分类和基因功能预测的理论基础[13]。研究表明,在特定基因家族中,大多数外显子-内含子结构相似基因具有相似进化关系[14]。在基因结构上,番茄PYL基因家族并不属于内含子富集型基因家族,内含子数量仅在0(SlPYL5、Sl-PYL7、SlPYL11、SlPYL12、SlPYL13、SlPYL15、SlPYL17和SlPYL18)~6(SlPYL1和SlPYL2)之间;外显子数量则是1~7之间,其中SlPYL1和SlPYL2属于一个分支,且结构十分相近。

图3 番茄PYL蛋白保守基序及基因结构Fig.3 Conserved motif and gene structure of tomato PYL protein
2.5 番茄PYL家族基因启动子区域顺式作用元件
SlPYL基因启动子区顺式元件分析发现27种顺式作用元件高频率出现(见图4)。这些顺式作用元件可分为四类:非生物胁迫响应元件、生物胁迫响应元件、光响应相关元件和植物生长发育相关元件。大部分SlPYL均含有不止一种非生物胁迫响应元件,且SlPYL启动子区域ABRE、MYB和MYC位点数量相对较多,其中MYB和MYC是干旱胁迫响应元件,ABRE是参与脱落酸响应顺式作用元件,表明大部分SlPYL 参与ABA 通路调节。MYB 转录因子对激素及干旱、高温、高盐等多种逆境胁迫作出应答,这可能是PYL 基因家族在番茄中功能繁多原因之一。

图4 番茄PYL基因家族启动子顺式作用元件Fig.4 Cis-acting elements of promoters of tomato PYL gene family
生物胁迫方面,SlPYL3、SlPYL7 和SlPYL8 含有胁迫响应相关元件。光响应方面,SlPYL3 和SlPYL6 启动子区域GATA-motif 位点数量较多,表明SlPYL可能与光胁迫响应有关。14个SlPYL基因包含G-box(生长发育相关元件),6 个SlPYL基因包含CAT-box(分生组织特异性顺式作用调节元件),表明这些基因可能在发育中发挥重要作用。PYL基因家族顺式作用元件种类多样性是SlPYL功能多样性前提之一。
2.6 番茄PYL基因家族共线性及复制
基因复制是新基因产生和功能分化的重要因素[15]。在对SlPYL基因串联重复事件分析中,确定8对串联重复基因,如图5a所示,不同颜色线条表示不同基因对。其中PYL基因家族中SlPYL4 和Sl-PYL6、SlPYL4 和SlPYL14、SlPYL5 和SlPYL17 以及SlPYL17 和SlPYL18 存在线性关系。另外,SlPYL7和Solyc05g052420.3.1 存在线性关系、SlPYLL9 也和Solyc05g052420.3.1存在线性关系。
为进一步确定番茄PYL基因与其他植物之间同源关系,分析拟南芥(A. thaliana)、马铃薯(S. tuberosum)和水稻(O. sativa)与番茄(S. lycopersicum)之间共线性。如图5b 所示,在番茄和拟南芥中存在22对共线性关系,在番茄和马铃薯中存在31对共线性关系,在番茄和水稻中存在10 对共线性关系。一些SlPYL基因至少与两对同源基因相关,特别是SlPYL4、SlPYL6和SlPYL17与其他基因组密切相关,可能在PYL基因家族进化中发挥重要作用。番茄与其他植物PYL基因比较分析对建立种间亲缘关系和预测基因功能具有重要意义。

图5 番茄PYL基因家族成员共线性和PYL基因种间共线性Fig.5 Collinearity of SlPYL gene family members and interspecific collinearity of PYL genes
2.7 基于转录组番茄PYL基因家族表达情况
利用转录组数据分析干旱和高温胁迫下SlPYL基因家族表达情况(见图6),发现全部SlPYL基因在不同条件下均具有独特表达情况,表明PYL基因家族在番茄中响应干旱和高温胁迫。在干旱组,存在两种明显趋势,一组为胁迫后呈下降趋势为主,SlPYL1、SlPYL2、SlPYL3、SlPYL4、SlPYL6和SlPYL18 等;另一组为呈先升再降趋势,如Sl-PYL8、SlPYL9、SlPYL10、SlPYL14 和SlPYL20 等,表达量最高点为处理后1 或2 d,但因样品采集时间间隔长,SlPYL在胁迫初期响应状况并不能十分明晰呈现。在高温组,变化趋势可分为3组,大部分SlPYL基因随处理时间变化呈下调趋势,另外两个分组表达量趋势分别为SlPYL2、SlPYL3、Sl-PYL8、SlPYL16 和SlPYL20 组先升再降和SlPYL1、SlPYL4、SlPYL5、SlPYL12 和SlPYL14 组整体呈升高趋势。其中SlPYL1、SlPYL4 和SlPYL12 在处理12 h时表达量达最大值;SlPYL5和SlPYL14则是在24 h。这些SlPYL基因表达量变化趋势多样性也间接揭示PYL基因家族在番茄生长发育中的功能多样性,说明SlPYL参与非生物胁迫响应,但目前具体功能尚未确定,需进一步试验验证。
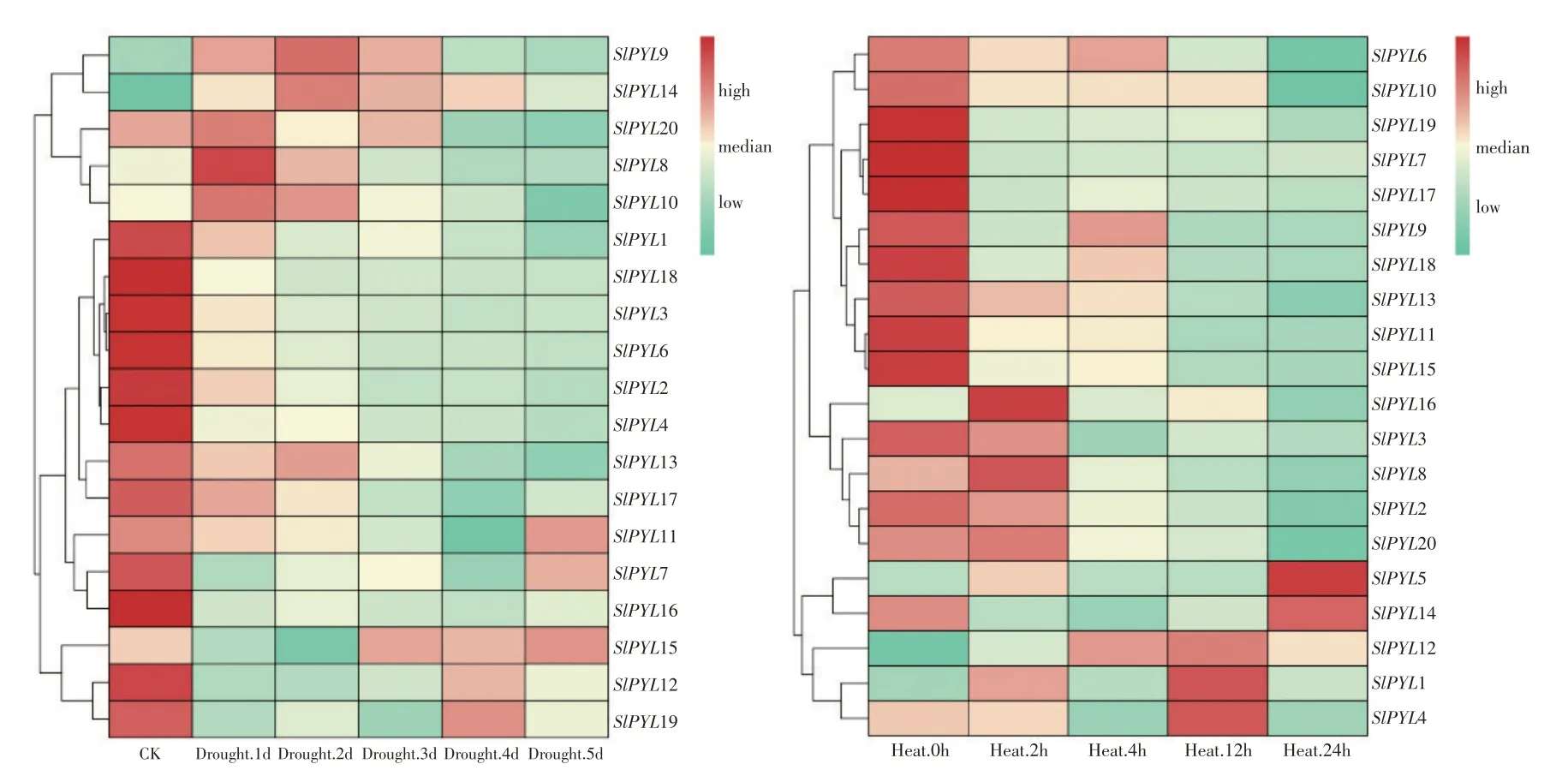
图6 番茄PYL基因在干旱和高温胁迫下表达热图Fig.6 Heatmap of tomato PYL gene expression under drought and high temperature stress
2.8 番茄PYL 基因家族在非生物胁迫和激素处理下表达情况分析
为进一步验证SlPYL基因家族对非生物胁迫响应情况,基于RNA-Seq 数据选择胁迫处理后表达量上下调趋势相对明显的6 个SlPYL基因,对其开展4 种胁迫处理后的qRT-PCR 试验分析(见图7)。冷胁迫下,6个SlPYL基因在处理6 h时均呈下调趋势,其中SlPYL8、SlPYL15 和SlPYL16 在处理24 h时表达量迅速增加,且表达量为对照20 倍。NaCl处理时,整体变化趋势不明显,仅SlPYL8、Sl-PYL15 和SlPYL16 表现为上调趋势。它们共同点是,表达量随处理时间呈先升后降再升趋势,且表达量最低时间点均为处理12 h(均低于对照)。由于PYL是ABA直接受体,干旱时植物体内产生大量ABA,SlPYL可直接结合ABA,响应干旱胁迫。PEG模拟干旱处理时,全部6个SlPYL基因均响应干旱胁迫,在处理6 h时表达量显著上升,且SlPYL8、Sl-PYL15和SlPYL16在处理24 h时表达量也上调明显。外源ABA处理时,6个SlPYL基因响应模式在处理6 h时与PEG处理时相同,均为显著上调。且整体表达量趋势表现为先升再降,SlPYL1、SlPYL4 和Sl-PYL14在处理6 h时达到表达量峰值,而SlPYL8、Sl-PYL15和SlPYL16则是在ABA处理12 h后。这些结果与转录组数据一致,且SlPYL8、SlPYL15 和Sl-PYL16基因在4种处理下表达模式相似,可能是Sl-PYL基因家族逆境胁迫响应重要基因。

图7 6个SlPYL基因在不同非生物胁迫下相对表达量Fig.7 Relative expression of six SlPYL genes under different abiotic stresses
3 讨 论
非生物胁迫是包括干旱、高盐和极端温度等在内的影响植物正常生长和发育的环境逆境,是影响农作物产量主要因素。非生物胁迫抑制植物光合作用,影响叶绿体稳定性并诱导叶绿体降解,引起植株早衰,最终影响农作物产量[16]。不适宜生长的环境条件带来的伤害严重限制番茄产量,挖掘植物中优良抗逆基因成为当今研究者主要手段之一。
由于PYL 广泛存在于植物中,且功能具有多样性,近年来PYL基因家族已从许多物种中鉴定得到。本研究在番茄基因组中共鉴定得到20个Sl-PYL基因,多于拟南芥14个AtPYL基因[17],少于棉花 27 个GhPYL基因[18]。在对番茄PYL家族成员鉴定中发现,番茄PYL基因家族成员平均分子质量为22.10 ku,平均pI 为6.7(见表2)。构建拟南芥、水稻、马铃薯和番茄中PYL蛋白系统进化树,比较PYL蛋白在不同物种中系统发育关系,其中一个分组中番茄和马铃薯PYL蛋白亲缘较近(见图2)。在对番茄PYL基因染色体定位分析中发现,其在1 号和8号染色体上存在较高密度分布,可能与基因串联复制有关(见图1)。此外,为更好了解PYL基因家族在番茄中进化关系,通过与拟南芥、马铃薯和水稻共线性分析,在番茄和3 个物种中分别鉴定出22、31和10对同源染色体对(见图5b)。推测这些共线性基因是由基因复制产生,ABA是植物应对逆境胁迫最重要激素,PYL家族基因复制可能是番茄作为一个古老物种适应环境变化的一种进化机制[19]。在番茄物种内PYL基因共线性分析时发现,尽管Solyc06g061180.2.1 和Solyc05g052420.3.1 存在共线性关系,但这两个基因并不含有PYL 特征结构,原因可能是这两个基因在复制过程中丢失部分特征结构(见图5a)。在植物进化过程中,具有相似内含子-外显子结构和保守基序的基因通常具有相似功能(见图3)[20]。进一步基因结构分析表明,两个SlPYL基因内含子-外显子结构包含7 个外显子。在20 个SlPYL基因中,大部分基因内含子数量均小于4个,表明内含子丢失的存在。顺式作用元件与基因核心启动子单元协同作用参与基因表达调控,是生物信号转导一种方式,也是基因间相互连接的重要通道[21]。研究已知顺式元件有三类功能:生长发育(如G-box)[22]、激素反应(如ABRE)[23]和应激反应(如LTR)[24]。PYL基因家族中20个成员中14个存在ABRE位点,且SlPYL19含有的ABRE 位点数量为6 个(见图4)。与本研究结果相似,已发现ABRE 是一个ABA 激素信号结合位点,与bZIP1转录因子结合,调节拟南芥中生物和非生物胁迫[25]。
转录组数据和荧光定量分析数据显示两种方法下各基因相对表达量不同,但表达变化趋势一致,相关性较好,表明SlPYLs对非生物胁迫响应(见图6、7)。Li 等在番茄中研究发现,干旱处理下SlPYL4 沉默的植物比对照植物枯萎得更快,且沉默植株抗氧化酶活性均低于对照植株,表明Sl-PYL4 在番茄植株抗旱性中发挥积极作用[26]。在其他物种研究中也证实了这一观点,例如,在蒺藜苜蓿中进行重度干旱胁迫,发现大部分基因表现出显著下调趋势,仅MTRPYL2 和MTRPYL12 显著上调[27]。外源ABA 处理的qRT-PCR 结果表明PYL基因家族表达受外源ABA 所诱导,在处理6 或12 h 时达到表达量峰值。在油棕中外源ABA 处理的qRT-PCR结果与本试验一致,11个EgPYLs基因表达量随外源ABA 处理显著上调,表明EgPYL基因可能参与油棕对逆境胁迫的响应[28]。进一步证实番茄PYL家族基因不仅参与植物内源ABA 信号传导,还参与植物对外源ABA响应。
4 结 论
本研究通过生物信息学方法在番茄中鉴定出20个SlPYL基因,详细分析其基因结构、染色体位置、系统发育关系、家族进化树以及基于转录组数据表达等,利用qRT-PCR分析6个SlPYL基因在不同处理下表达模式,发现这6个SlPYL基因对于干旱胁迫和外源ABA 处理相比于冷和盐胁迫响应明显。总之,番茄PYL基因家族作为ABA 受体在番茄抵抗逆境胁迫中确实发挥作用,后续可进一步研究SlPYL8、SlPYL15和SlPYL16功能。
——以多重共线性内容为例

